KEYNOTE-671試験
非小細胞肺癌:国際共同臨床試験成績:切除可能なⅡ期、ⅢA期又はⅢB期(T3-4N2)の非小細胞肺癌患者を対象とした術前・術後補助療法:国際共同第Ⅲ相試験<KEYNOTE-671試験>
承認時評価資料:国際共同第Ⅲ相試験(KEYNOTE-671試験)
Wakelee H et al. N Engl J Med 2023; 389: 491-503
本試験はMSD社の資金提供により行われた。Heather WakeleeはMSD社から研究費などを受領している。また、著者のうち、Jing Yang、Steven M. Keller、Ayman Samkariは同社の社員である。その他の著者にMSD社より研究費などを受領している者が含まれる。
試験概要
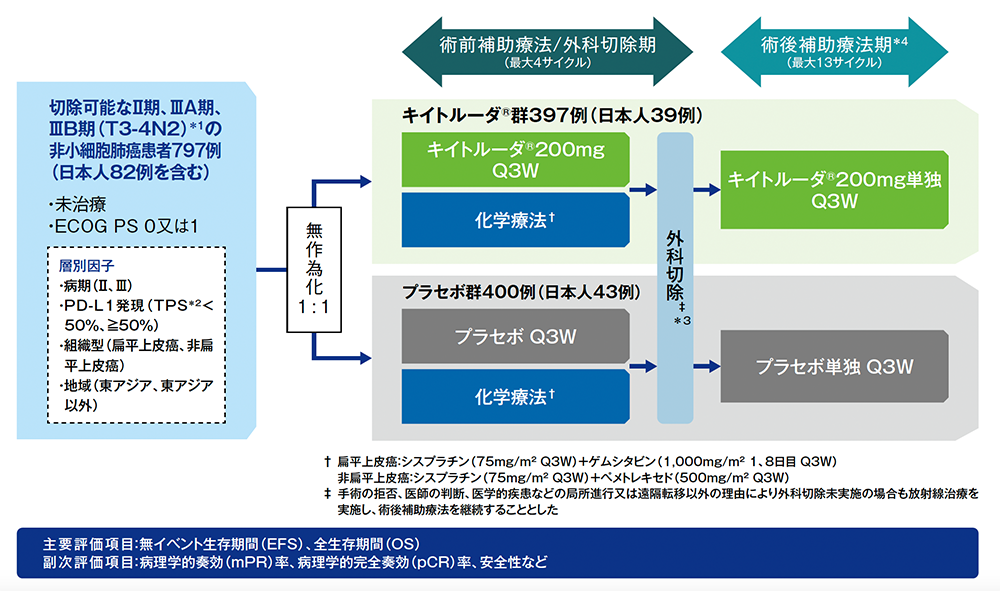
【目 的】切除可能なⅡ期、ⅢA期又はⅢB期(T3-4N2)の非小細胞肺癌患者における、キイトルーダ®群(キイトルーダ®と化学療法の併用による術前補助療法を実施後に外科切除を行い、続いてキイトルーダ®単独投与による術後補助療法を実施)と、プラセボ群(プラセボと化学療法の併用による術前補助療法を実施後に外科切除を行い、続いてプラセボ単独投与による術後補助療法を実施)の有効性及び安全性について比較検討する。
【デザイン】国際共同無作為化二重盲検第Ⅲ相試験[優越性試験][第1回中間解析結果(データカットオフ日:2022年7月29日)][第2回中間解析結果(データカットオフ日:2023年7月10日)]
【対 象】切除可能なⅡ期、ⅢA期又はⅢB期(T3-4N2)の非小細胞肺癌患者797例(日本人82例を含む)
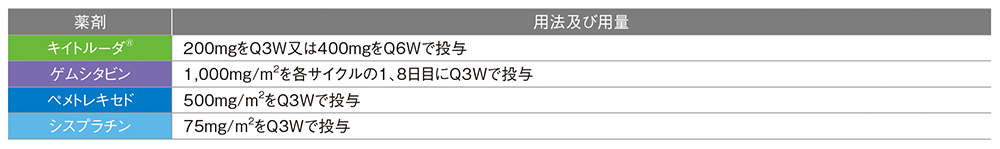
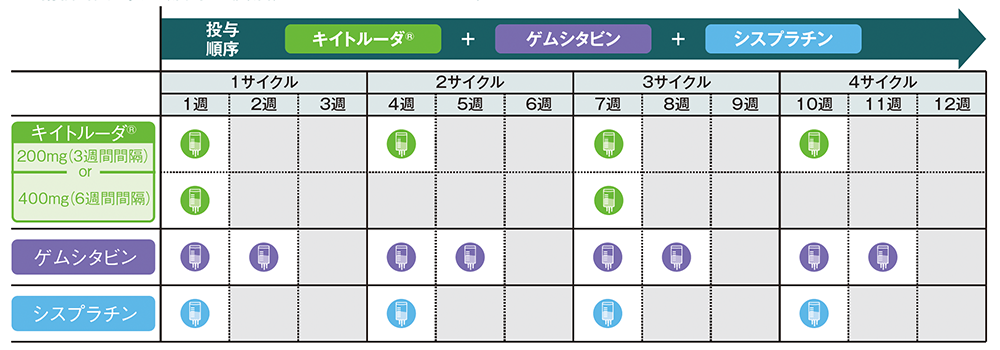
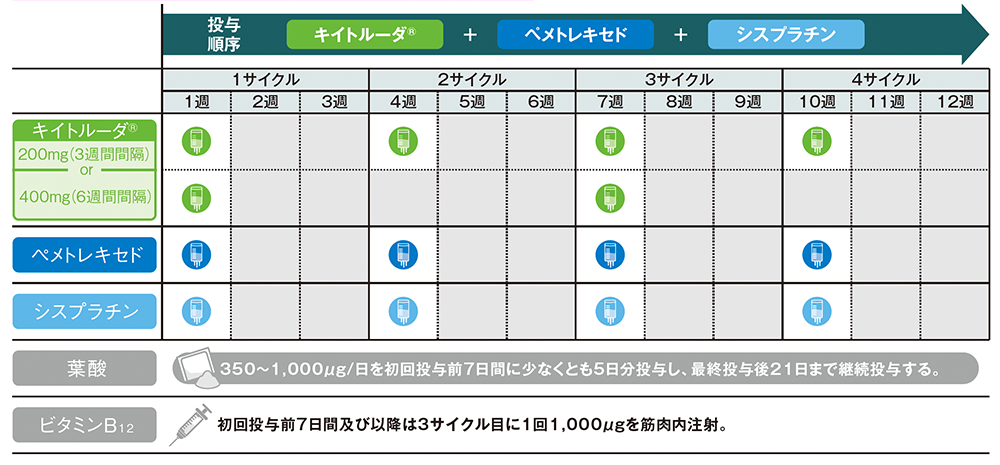
【方 法】キイトルーダ®群とプラセボ群に1:1の割合で無作為に割り付け、両群ともに3週間間隔を1サイクルとして以下の用法及び用量で投与した。
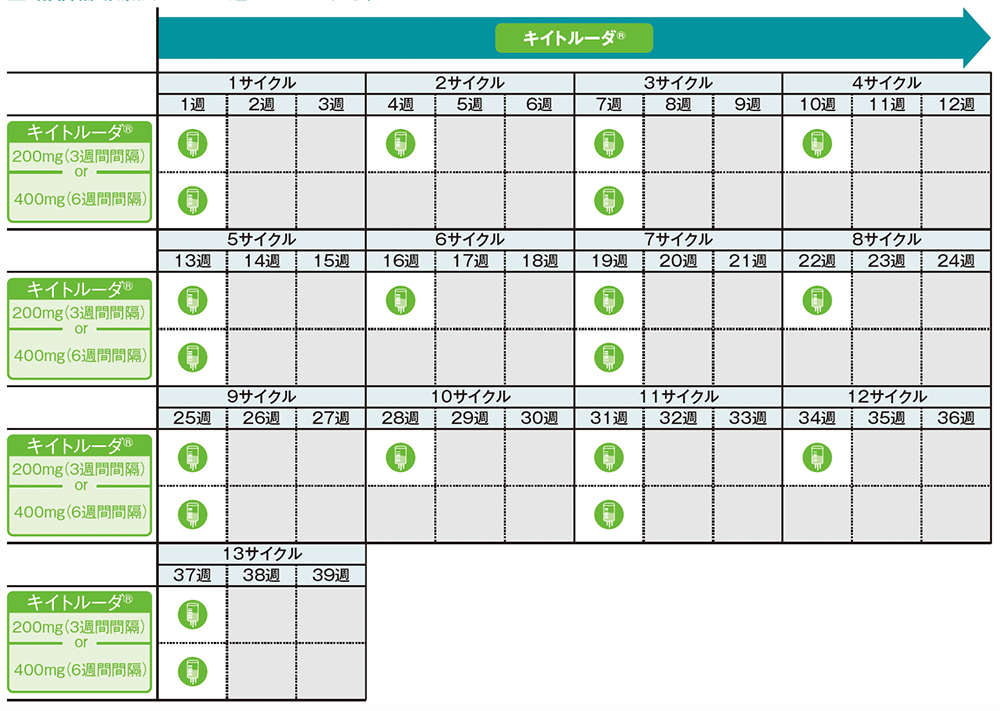
キイトルーダ®群:術前補助療法として、キイトルーダ®200mgと化学療法併用(各サイクル1日目にシスプラチン75mg /m2 +1日目及び8日目にゲムシタビン1,000mg /m2の併用療法又は1日目にシスプラチン75mg /m2 +ペメトレキセド500mg /m2の併用療法)を最大4サイクルまで点滴静注した。その後、外科切除に続く術後補助療法として、キイトルーダ®200mgを最大13サイクルまで点滴静注した。
プラセボ群:術前補助療法として、プラセボと化学療法併用(各サイクル1日目にシスプラチン75mg /m2 +1日目及び8日目にゲムシタビン1,000mg /m2の併用療法又は1日目にシスプラチン75mg /m2 +ペメトレキセド500mg /m2の併用療法)を最大4サイクルまで点滴静注した。その後、外科切除に続く術後補助療法として、プラセボを最大13サイクルまで点滴静注した。
投与完了(キイトルーダ®又はプラセボを17サイクル)、進行又は再発、許容できない有害事象の発現等による投与中止まで継続した。プラセボからキイトルーダ®へのクロスオーバーは許容しなかった。
【評価項目】主要評価項目:無イベント生存期間(event free survival;EFS)1)、全生存期間(overall survival;OS)1)
副次評価項目:病理学的完全奏効(pathological complete response;pCR)率1)、病理学的奏効(major pathological response;mPR)率1)、健康関連QOLに関する患者報告アウトカム(PRO):EORTC QLQ-C30の全般的健康状態の術前補助療法/外科切除期及び術後補助療法期のベースラインからの変化量の平均値、安全性
1)検証的解析項目
【判定基準】
●EFSは無作為割付から以下のイベントが最初に確認されるまでの期間と定義した
- RECISTガイドライン1.1版に基づく治験担当医師の画像評価による進行
- 予定されている外科切除を妨げる局所進行、切除不能の腫瘍、局所又は遠位再発
- 原因を問わない死亡
●pCR、mPRは盲検化された中央検査機関の病理医が以下の定義に基づき評価した
- pCR:術前補助療法完了後の切除肺標本及びリンパ節のヘマトキシリン・エオジン染色スライドで残留浸潤癌が消失
- mPR:切除原発腫瘍及びすべての切除リンパ節中のviable tumor cellが10%以下
【解析計画】解析対象集団:有効性の解析はITT集団*5、安全性の解析はASaT集団*6、PROの解析は FAS集団*7を対象として実施した。
有効性解析の統計手法:EFS、OSについて、Kaplan-Meier法を用いて生存曲線を推定し、層別ログランク検定を用いて群間を比較した。投与群を共変量とした層別Cox比例ハザードモデル(タイデータにはEfron法で対応する)によりハザード比(HR)及び95%信頼区間(95%CI)を算出した。mPR率及びpCR率の群間比較には例数で重み付けした層別Miettinen and Nurminen 法を用いた。主要評価項目(EFS、OS)のサブグループ解析を、層別因子[病期(Ⅱ、Ⅲ)、PD-L1発現(TPS<50%、≧50%)、組織型(扁平上皮癌、非扁平上皮癌)、地域(東アジア、東アジア以外)]、年齢(<65歳、≧65歳)、性別(女性、男性)、人種(白人、白人以外)、喫煙状況(喫煙歴なし、喫煙歴あり、現喫煙者)、EGFR遺伝子変異(あり、なし)、ALK融合遺伝子(あり、なし)について、投与群を共変量とした非層別Cox比例ハザードモデルを用いて実施した。日本人集団については、ITT集団と同じ統計手法を用いて解析したが、層での調整は行わなかった。また、治験実施計画書に規定されていないが、pCR又はmPR達成の有無別のEFSに対するサブグループ解析を実施し、評価資料として承認時に評価された。
健康関連QOLに関するPRO評価の統計手法:EORTC QLQ-C30の全般的健康状態/QOLスコア(項目29及び30)について、ベースラインから術前補助療法/外科切除期及び術後補助療法期の変化量について、PROスコアを応答変数とし、投与群と時点の交互作用及び層別因子を共変量とする制約付き経時データ解析(cLDA)モデルを用いて評価した。また、ベースラインからの平均変化量について、すべての時点を通した折れ線グラフを作成することとした。
*1 UICC/AJCC病期分類(第8版)に基づく。ⅢB期はT3N2M0、T4N2M0を対象
*2 TPS(tumor proportion score):腫瘍細胞のうちPD-L1発現陽性細胞の割合
*3 治験薬投与が4サイクルの場合、治験薬初回投与から20週間以内に外科切除を実施した(治験薬投与が4サイクル未満の場合、治験薬最終投与後4~8週間以内に外科切除を実施)
*4 外科切除後に顕微鏡下又は肉眼的な遺残を認めた場合は放射線治療を実施した
*5 ITT(intention to treat)集団:無作為化されたすべての患者
*6 ASaT(all subjects as treated)集団:無作為化され、治験薬が1回以上投与されたすべての患者
*7 FAS(full analysis set)集団:無作為化後に治験薬が1回以上投与され、PROの評価が1回以上得られたすべての患者
ペメトレキセドの効能又は効果は以下のとおりです。
4.効能又は効果
悪性胸膜中皮腫、切除不能な進行・再発の非小細胞肺癌
ゲムシタビンの効能又は効果は以下のとおりです。
4.効能又は効果
非小細胞肺癌、膵癌、胆道癌、尿路上皮癌、手術不能又は再発乳癌、がん化学療法後に増悪した卵巣癌、再発又は難治性の悪性リンパ腫
シスプラチンの効能・効果は以下のとおりです。
【効能・効果】(抜粋)シスプラチン通常療法
睾丸腫瘍、膀胱癌、腎盂・尿管腫瘍、前立腺癌、卵巣癌、頭頸部癌、非小細胞肺癌、食道癌、子宮頸癌、神経芽細胞腫、胃癌、小細胞肺癌、骨肉腫、胚細胞腫瘍(精巣腫瘍、卵巣腫瘍、性腺外腫瘍)、悪性胸膜中皮腫、胆道癌
以下の悪性腫瘍に対する他の抗悪性腫瘍剤との併用療法
悪性骨腫瘍、子宮体癌(術後化学療法、転移・再発時化学療法)、再発・難治性悪性リンパ腫、小児悪性固形腫瘍(横紋筋肉腫、神経芽腫、肝芽腫その他肝原発悪性腫瘍、髄芽腫等)
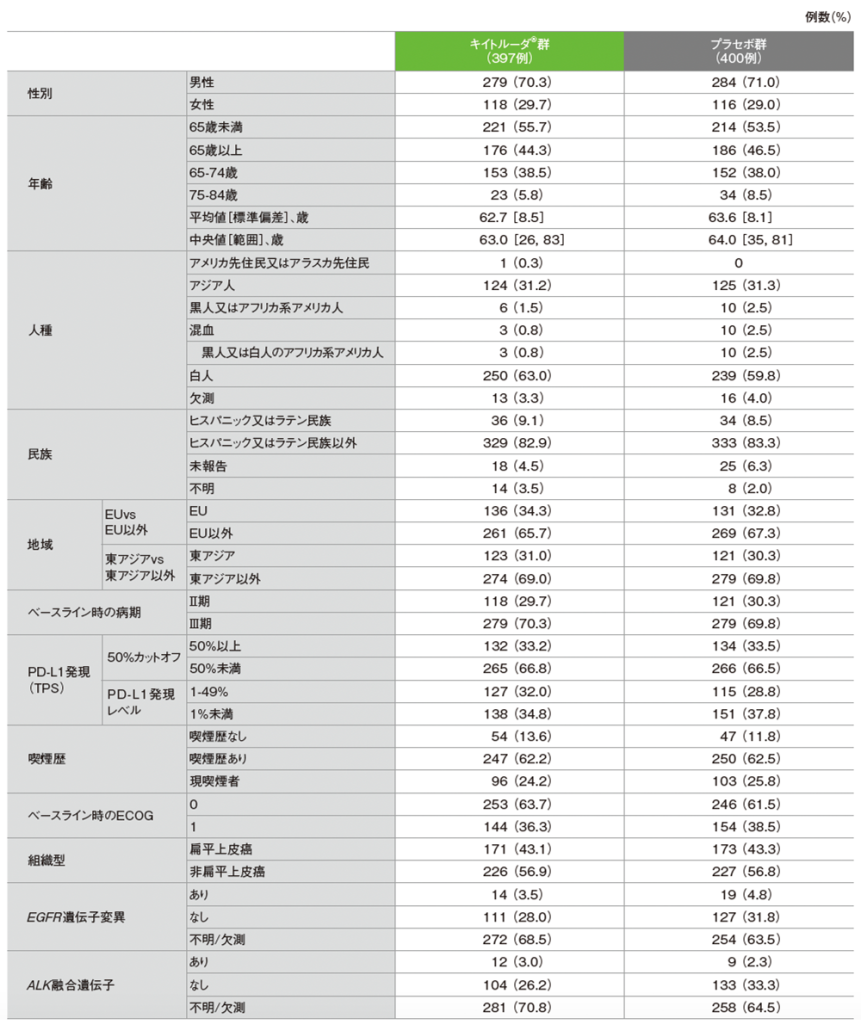
患者背景(ITT 集団)
主要評価項目(優越性試験) 無イベント生存期間:EFS(検証的解析結果)
■ 無イベント生存期間(EFS)のKaplan-Meier曲線(ITT集団)

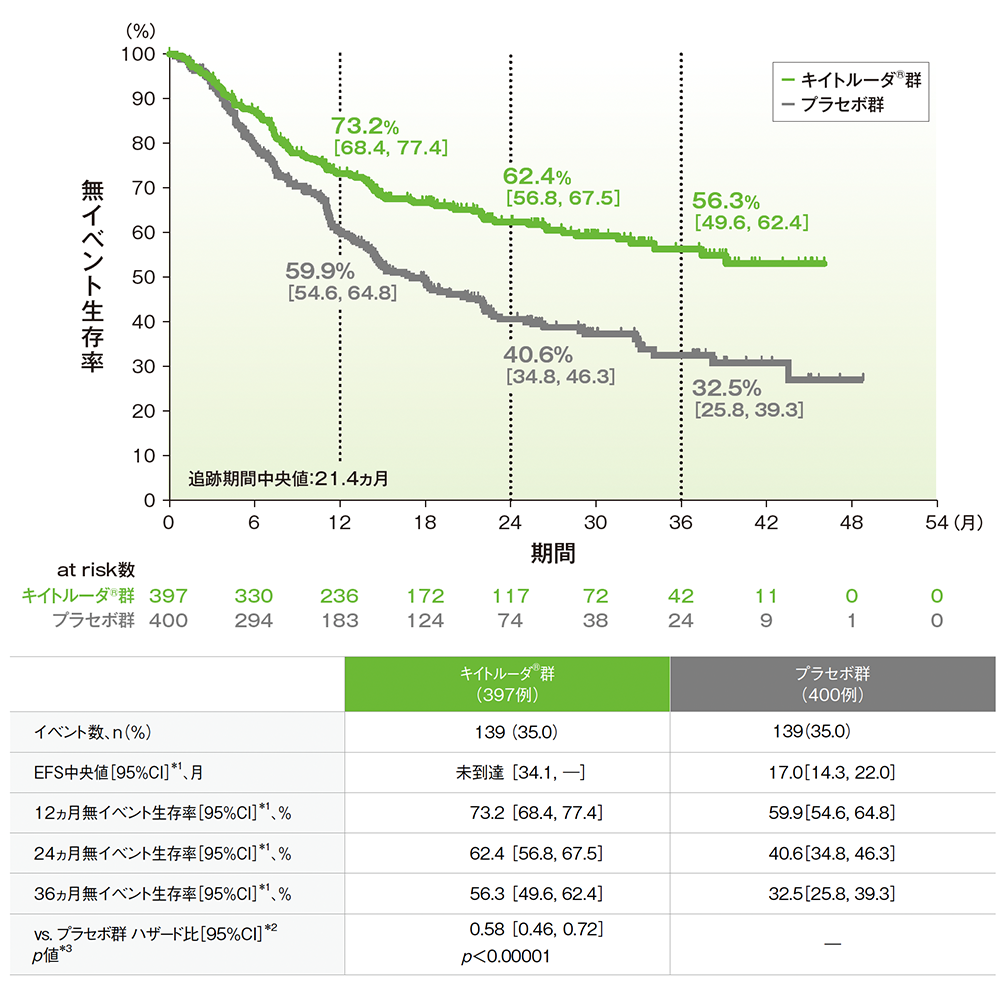
EFS:無作為割付から以下のイベントが最初に確認されるまでの期間
(イベント:RECISTガイドライン1.1版に基づく治験担当医師の画像評価による進行、予定されている外科切除を妨げる局所進行、切除不能の腫瘍、局所又は遠位再発、原因を問わない死亡)
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、病期(Ⅱ、Ⅲ)、PD-L1発現(TPS<50%、≧50%)、組織型(扁平上皮癌、非扁平上皮癌)、地域(東アジア、東アジア以外)を層別因子(無作為化に用いた層別因子)とした層別Cox比例ハザードモデルに基づく
*3 層別ログランク検定[片側](層別因子は無作為化に用いた層別因子)、有意水準α=0.00462(検証的解析結果)
(データカットオフ日:2022年7月29日)
- 第1回中間解析におけるEFS中央値は、キイトルーダ®群で未到達(95%CI:34.1,未到達)、プラセボ群で17.0ヵ月(95%CI:14.3, 22.0)でした。キイトルーダ®群のプラセボ群に対するEFSのハザード比は0.58であり、EFSは有意に延長しました(HR:0.58、95%CI:0.46, 0.72、p<0.00001、層別ログランク検定[片側]、有意水準α=0.00462;検証的解析結果)。
主要評価項目 無イベント生存期間:EFS
■ 無イベント生存期間(EFS)のKaplan-Meier曲線(ITT集団)

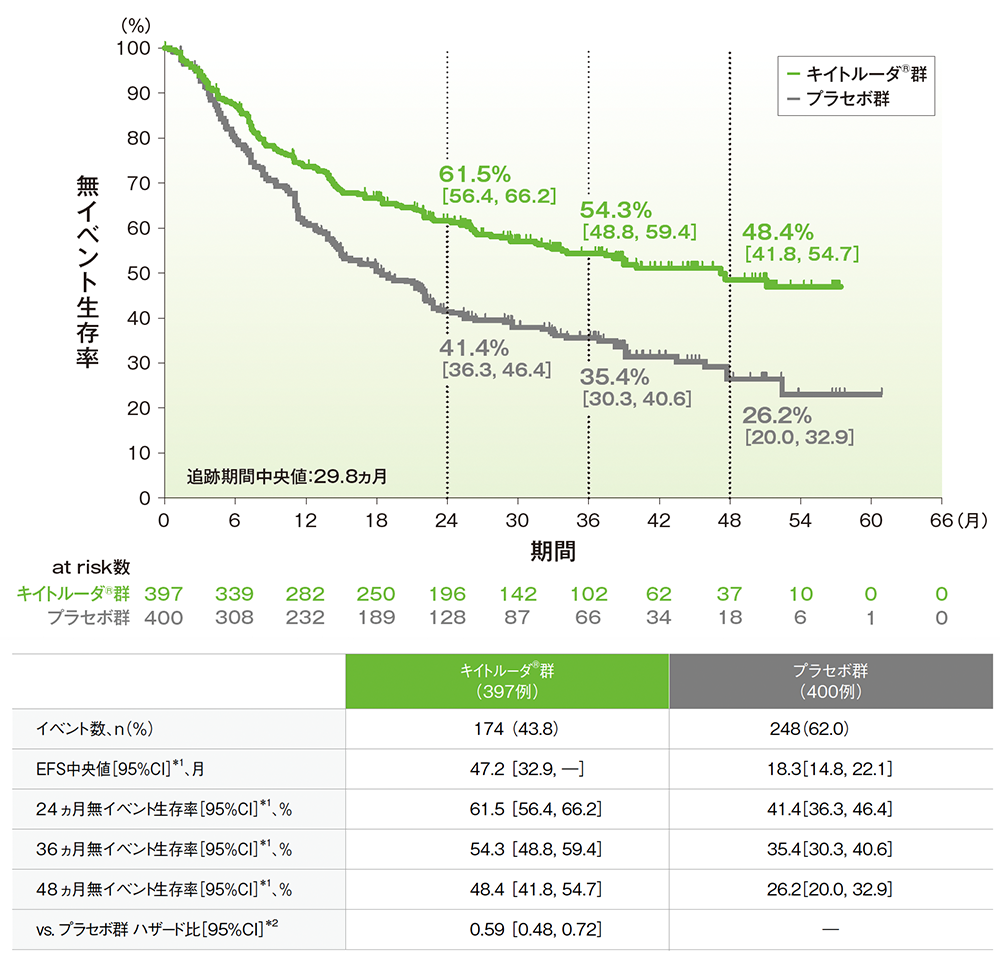
EFS:無作為割付から以下のイベントが最初に確認されるまでの期間
(イベント:RECISTガイドライン1.1版に基づく治験担当医師の画像評価による進行、予定されている外科切除を妨げる局所進行、切除不能の腫瘍、局所又は遠位再発、原因を問わない死亡)
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、病期(Ⅱ、Ⅲ)、PD-L1発現(TPS<50%、≧50%)、組織型(扁平上皮癌、非扁平上皮癌)、地域(東アジア、東アジア以外)を層別因子(無作為化に用いた層別因子)とした層別Cox比例ハザードモデルに基づく
(データカットオフ日:2023年7月10日)
- 第2回中間解析におけるEFS中央値は、キイトルーダ®群で47.2ヵ月(95%CI:32.9, 未到達)、プラセボ群で18.3ヵ月(95%CI:14.8, 22.1)でした。
サブグループ解析 部分集団因子別の無イベント生存期間:EFS
■ 無イベント生存期間(EFS)のハザード比のフォレストプロット(ITT集団)

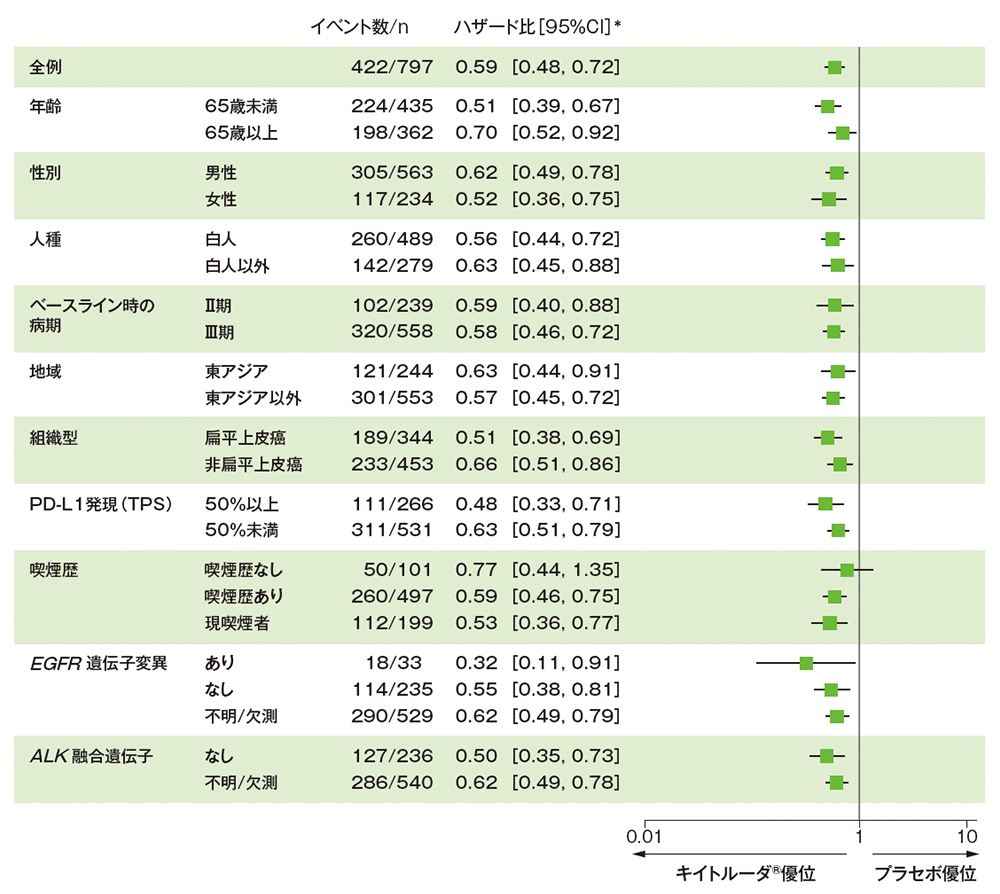
* 全集団は投与群を共変量とし、病期(Ⅱ、Ⅲ)、PD-L1発現(TPS<50%、≧50%)、組織型(扁平上皮癌、非扁平上皮癌)、地域(東アジア、東アジア以外)を層別因子(無作為化に用いた層別因子)とした層別Cox比例ハザードモデル、部分集団は投与群を共変量とした非層別Cox比例ハザードモデルに基づく
(データカットオフ日:2023年7月10日)
主要評価項目(優越性試験) 全生存期間:OS(検証的解析結果)
■ 全生存期間(OS)のKaplan-Meier曲線(ITT集団)

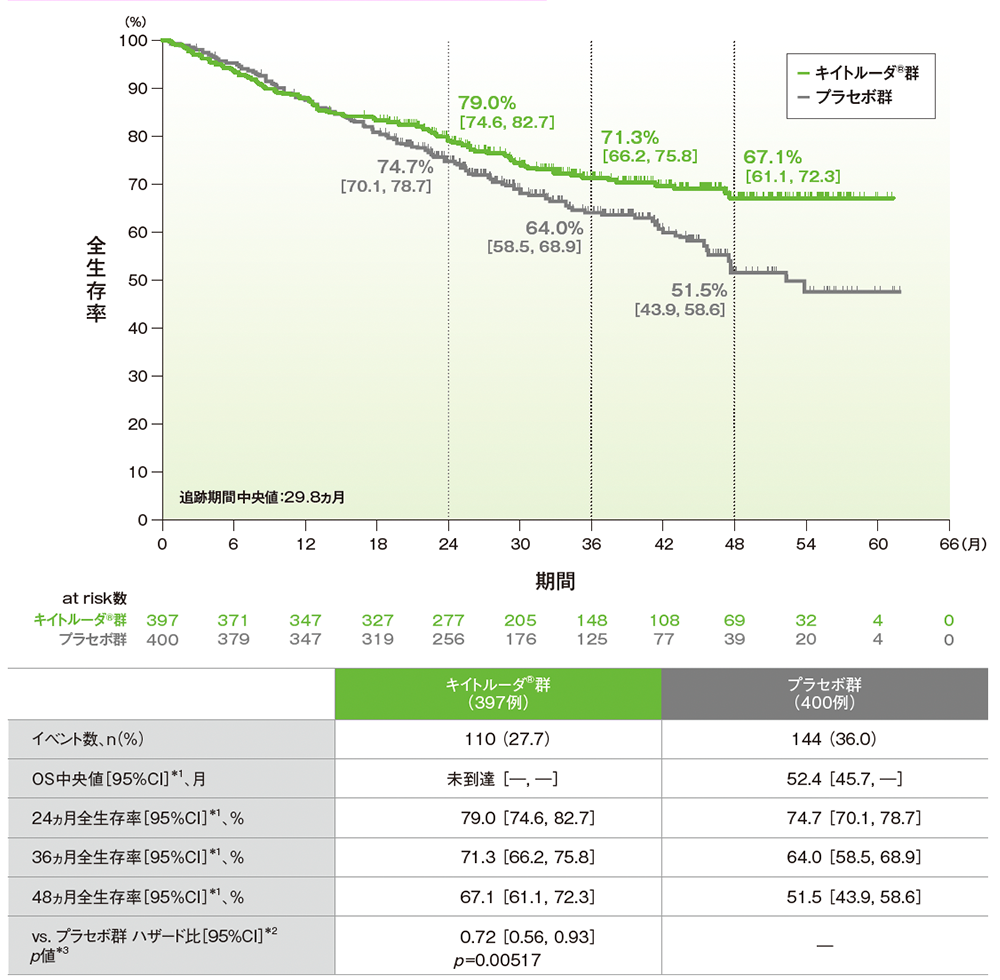
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、病期(Ⅱ、Ⅲ)、PD-L1発現(TPS<50%、≧50%)、組織型(扁平上皮癌、非扁平上皮癌)、地域(東アジア、東アジア以外)を層別因子(無作為化に用いた層別因子)とした層別Cox比例ハザードモデルに基づく
*3 層別ログランク検定[片側](層別因子は無作為化に用いた層別因子)、有意水準α=0.005426(検証的解析結果)
(データカットオフ日:2023年7月10日)
- 第2回中間解析における OS中央値は、キイトルーダ®群で未到達(95%CI :未到達,未到達)、プラセボ群で52.4ヵ月(95%CI:45.7, 未到達)でした。キイトルーダ®群のプラセボ群に対するOSのハザード比は0.72(95%CI:0.56, 0.93)であり、OSは有意に延長しました(p=0.00517、層別ログランク検定[片側]、有意水準 α=0.005426;検証的解析結果)。
サブグループ解析 部分集団因子別の全生存期間:OS
■ 全生存期間(OS)のハザード比のフォレストプロット(ITT集団)

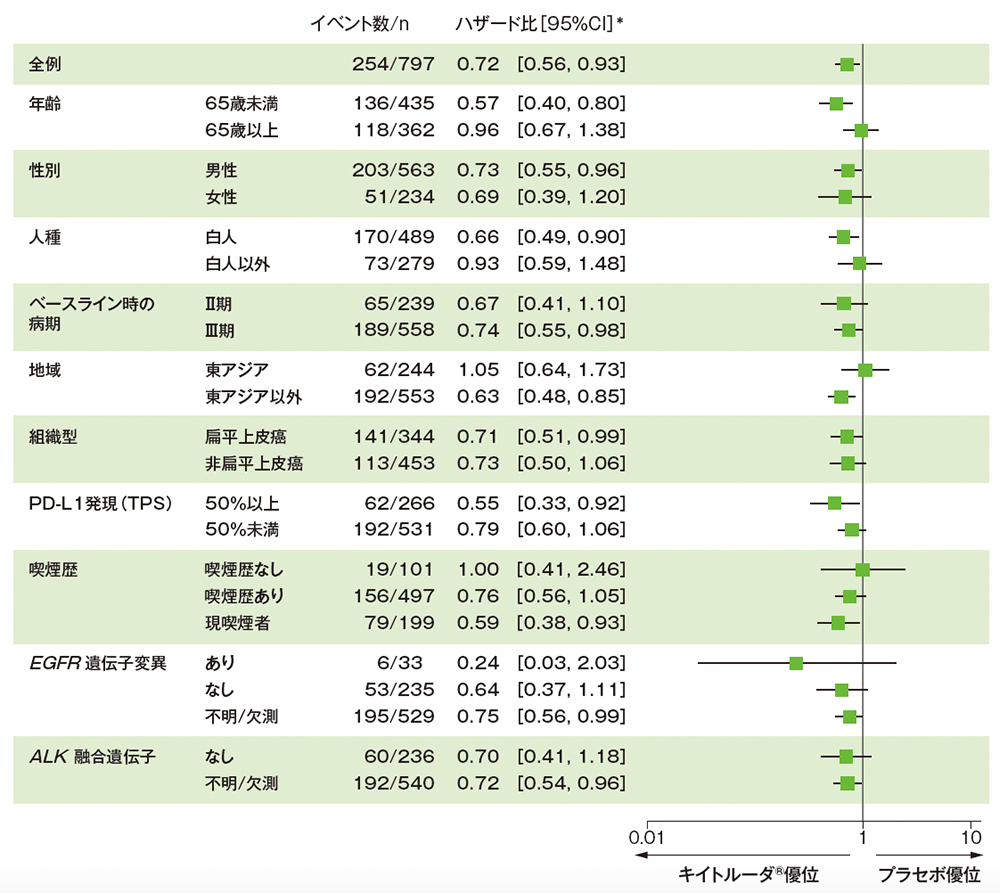
* 全集団は投与群を共変量とし、病期(Ⅱ、Ⅲ)、PD-L1発現(TPS<50%、≧50%)、組織型(扁平上皮癌、非扁平上皮癌)、地域(東アジア、東アジア以外)を層別因子(無作為化に用いた層別因子)とした層別Cox比例ハザードモデル、部分集団は投与群を共変量とした非層別Cox比例ハザードモデルに基づく
(データカットオフ日:2023年7月10日)
副次評価項目 病理学的完全奏効率:pCR率/病理学的奏効率:mPR率(検証的解析結果)
■ 病理学的完全奏効(pCR)率の要約(ITT集団)

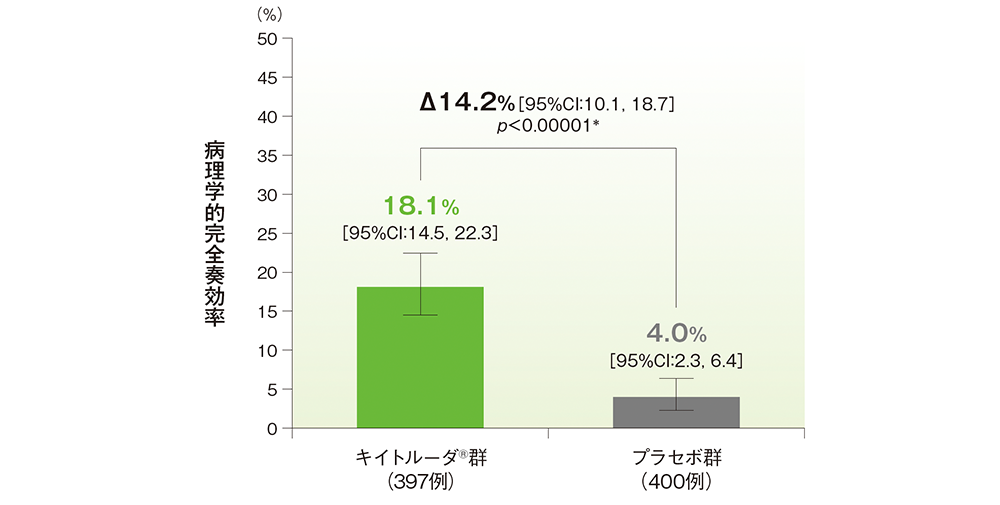
pCR:術前補助療法完了後の切除肺標本及びリンパ節のヘマトキシリン・エオジン染色スライドで残留浸潤癌が消失
* 病期(Ⅱ、Ⅲ)、PD-L1発現(TPS<50%、≧50%)、組織型(扁平上皮癌、非扁平上皮癌)、地域(東アジア、東アジア以外)を層別因子(無作為化に用いた層別因子)とした層別Miettinen and Nurminen法[片側]、有意水準α=0.0001(検証的解析結果)
追跡期間中央値:21.4ヵ月(データカットオフ日:2022年7月29日)
- 第1回中間解析におけるpCR率はキイトルーダ®群で18.1%( 95%CI:14.5, 22.3)、プラセボ群で4.0%( 95%CI:2.3, 6.4)であり、キイトルーダ®群で有意に改善しました(群間差:14.2%、95%CI:10.1, 18.7、p<0.00001、層別Miettinen and Nurminen法[片側]、有意水準α=0.0001;検証的解析結果)。
■ 病理学的奏効(mPR)率の要約(ITT集団)

![]()
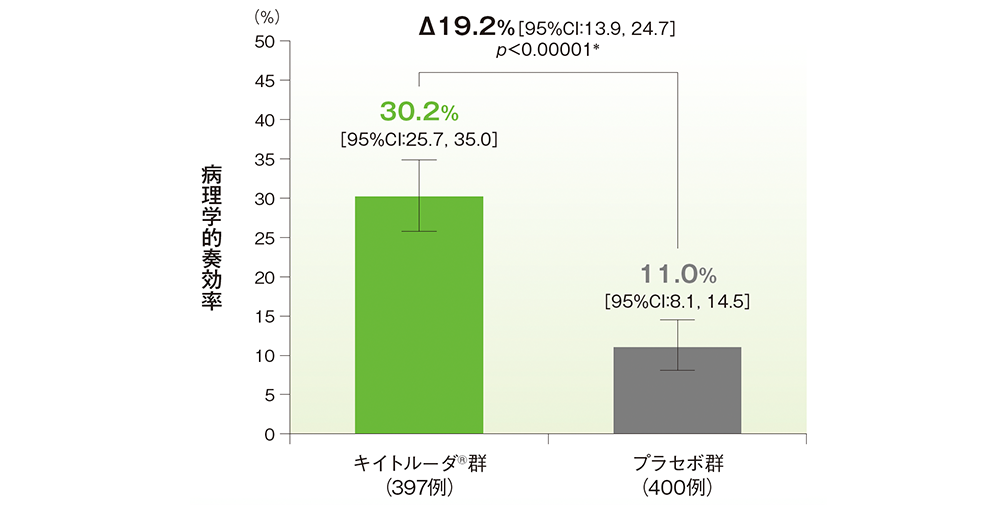
mPR:切除原発腫瘍及びすべての切除リンパ節中のviable tumor cellが10%以下
* 病期(Ⅱ、Ⅲ)、PD-L1発現(TPS<50%、≧50%)、組織型(扁平上皮癌、非扁平上皮癌)、地域(東アジア、東アジア以外)を層別因子(無作為化に用いた層別因子)とした層別Miettinen and Nurminen法[片側]、有意水準α=0.0001(検証的解析結果)
追跡期間中央値:21.4ヵ月(データカットオフ日:2022年7月29日)
- 第1回中間解析におけるmPR率はキイトルーダ®群で30.2%( 95%CI: 25.7, 35.0)、プラセボ群で11.0%( 95%CI: 8.1, 14.5)であり、キイトルーダ®群で有意に改善しました(群間差:19.2%、95%CI: 13.9, 24.7、p<0.00001、層別Miettinen and Nurminen法[片側]、有意水準α=0.0001;検証的解析結果)。
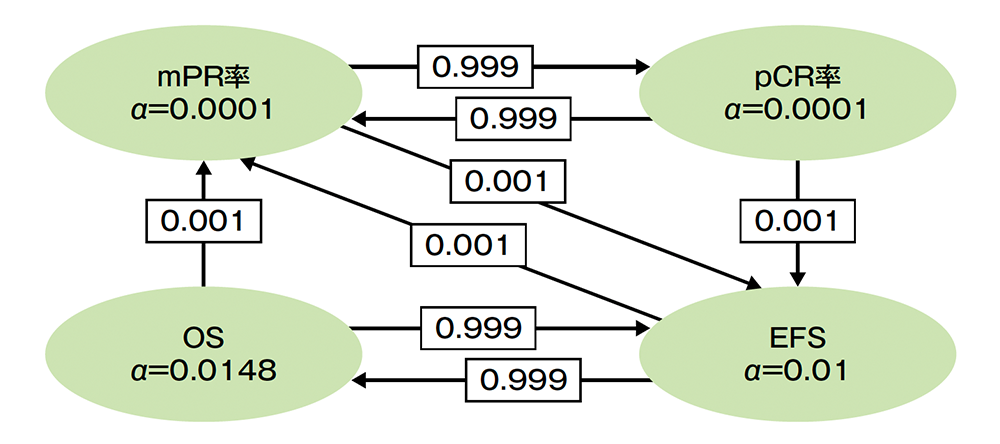
pCR又はmPR達成有無別のEFSは事前規定されていないが、評価資料として承認時に評価されたため記載した
サブグループ解析 病理学的完全奏効(pCR)・病理学的奏効(mPR)達成有無別の無イベント生存期間:EFS
■ 病理学的完全奏効(pCR)達成有無別の無イベント生存期間(EFS)のKaplan-Meier曲線(ITT集団)

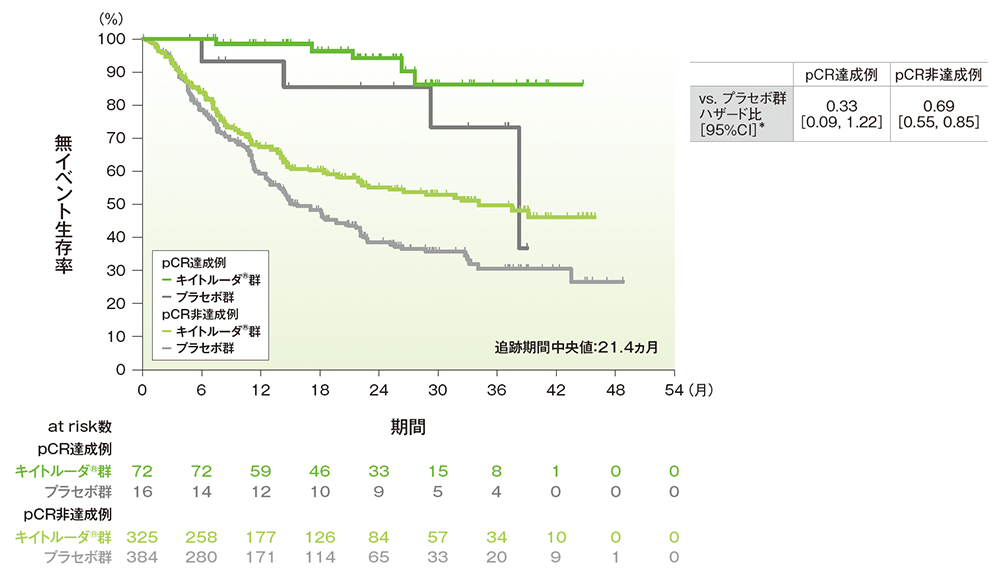
* 投与群を共変量とした非層別Cox比例ハザードモデルに基づく
(データカットオフ日:2022年7月29日)
■ 病理学的奏効(mPR)達成有無別の無イベント生存期間(EFS)のKaplan-Meier曲線(ITT集団)


* 投与群を共変量とした非層別Cox比例ハザードモデルに基づく
(データカットオフ日:2022年7月29日)
外科切除の実施状況
■ 外科切除未実施の内訳(ITT集団)

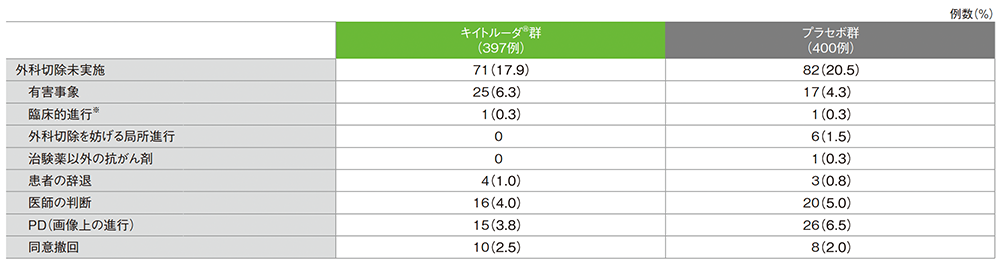
※ 画像上の進行はないものの、疾患進行に関連する臨床的状態悪化を認める
(データカットオフ日:2022年7月29日)
■ 外科切除例における術式(外科切除実施集団)


* 肺葉切除術実施の1例に転移を認めたため切除不能と判断
† 肺葉切除術実施の2例に転移を認めたため切除不能と判断
‡ 肺葉切除術を予定していたものの、術中に広範囲の外科切除を要することが判明し、同意が得られず、リンパ節郭清のみを実施
(データカットオフ日:2022年7月29日)
■ 外科切除の内訳(外科切除実施集団)

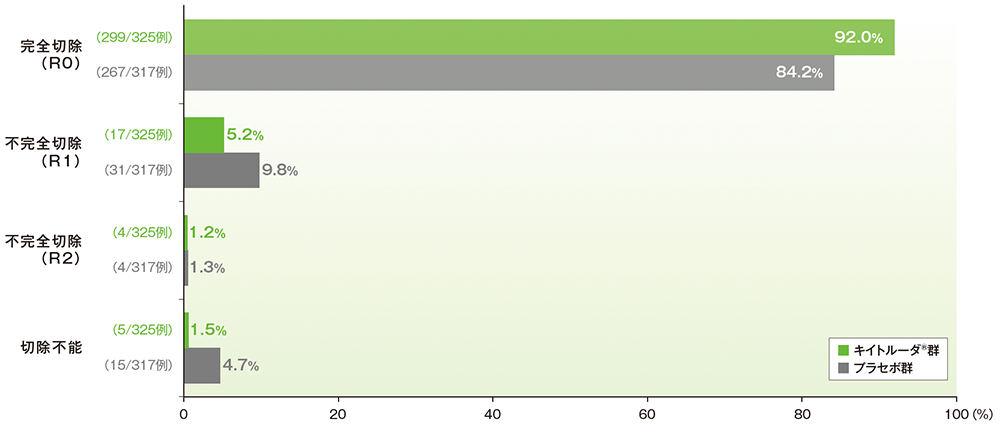
断端陰性
R0: 気管支断端又は気管支周囲軟部組織に浸潤癌を認めない/肺動脈、肺静脈縁部又は周囲軟部組織に浸潤癌を認めない/胸壁切除断端の内側、外側、上縁及び下縁に浸潤癌を認めない/腫瘍からの距離が最短となる切除断端に悪性腫瘍細胞を認めない(気管支形成異常は断端陰性とみなされる)
断端陽性
R1:気管支肺静脈又は肺動脈断端、又は周囲軟部組織における顕微鏡的浸潤性癌/気管支断端に上皮内癌が残存している
R2:肉眼的遺残病変
(データカットオフ日:2022年7月29日)
安全性
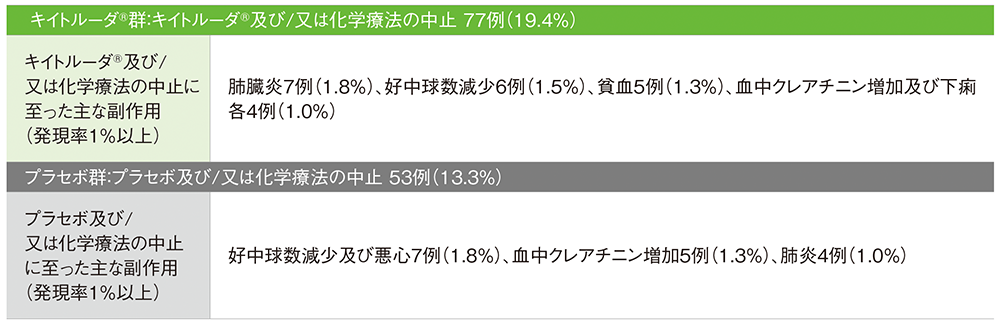
副作用の詳細(ASaT集団)

主な副作用

重篤な副作用
投与中止に至った副作用
死亡に至った副作用
MedDRA/J version 26.0
(データカットオフ日:2023年7月10日)
■副作用一覧(いずれかの投与群で発現率5%以上)

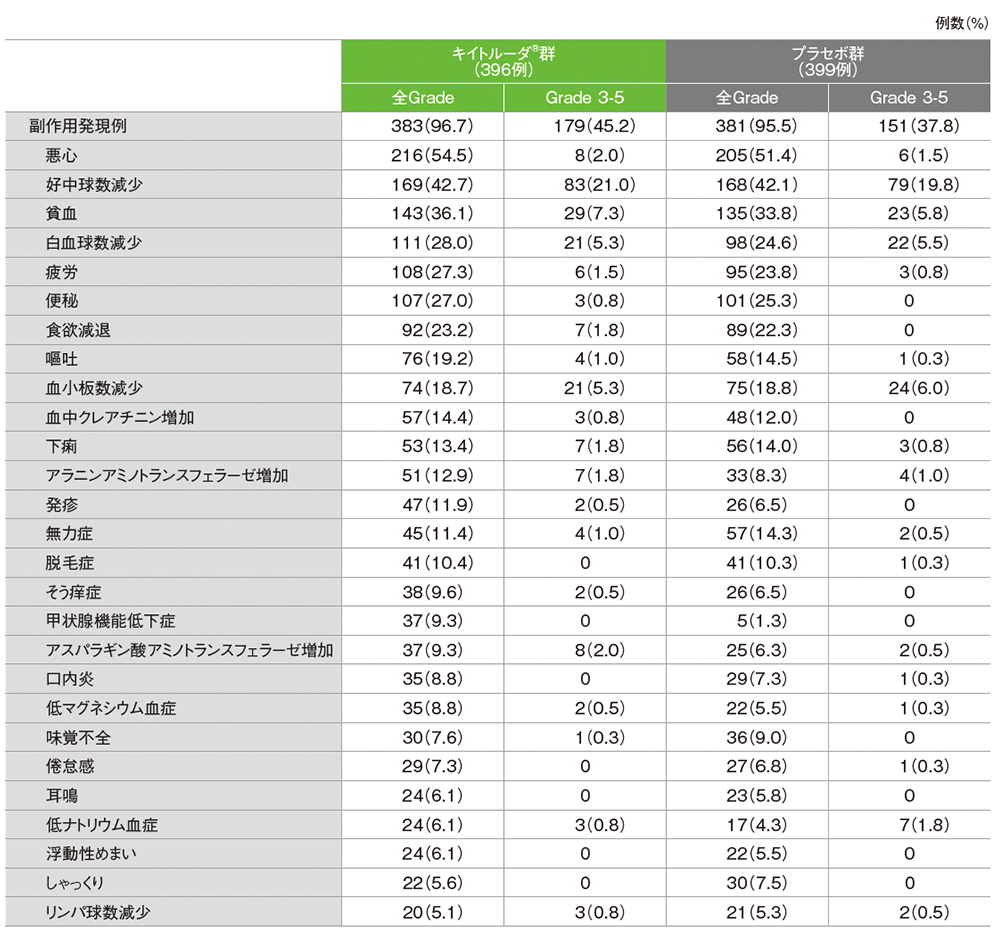
MedDRA/J version 26.0、GradeはCTCAE version 4.03
(データカットオフ日:2023年7月10日)
免疫関連など特に注目すべき有害事象

免疫関連など特に注目すべき有害事象(ASaT集団)


MedDRA/J version 26.0、GradeはCTCAE version 4.03
(データカットオフ日:2023年7月10日)
キイトルーダ®投与期間中は、以下の検査スケジュールを参考に患者さんの状態を観察してください
キイトルーダ®200mg及び併用化学療法を3週間間隔で投与したKEYNOTE-671試験における検査スケジュール(キイトルーダ®は術前補助療法/外科切除期は最大4回、術後補助療法期は最大13回投与)

バイタルサイン:体温、脈拍数、呼吸数、血圧
妊娠検査:妊娠の可能性がある女性の場合に、投与前24時間以内に実施
血液学的検査:血小板数、赤血球数、ヘモグロビン、ヘマトクリット、赤血球指数(MCV、MCH、網状赤血球%)、白血球数及び分画(好中球数、リンパ球数、単球数、好酸球数、好塩基球数)
血液生化学的検査:BUN/尿素、アルブミン、クレアチニン、グルコース(非空腹時)、K、HCO3‒(標準手順に入っている場合)、Na、Ca、AST/SGOT、Cl、ALT/SGPT、ALP、総ビリルビン(総ビリルビンが基準値上限を超えた場合、直接ビリルビン)、P、総蛋白
尿検査:比重、pH、尿糖、尿蛋白、尿潜血、ケトン体、鏡検法(尿潜血又は尿蛋白が異常の場合)
*1 日本特有の検査項目(肺臓炎/間質性肺疾患の早期診断補助のため)
*2 2サイクル目以降、外科切除前の最終来院前72時間以内に実施することができた
*3 2サイクル目以降、外科切除まで6週毎
*4 施行したサイクル数により、以下のように規定されていた
4サイクル施行時:初回投与から7週間後、及び13週間後
3サイクル施行時:初回投与から7週間後、及び10週間後
2サイクル施行時:初回投与から7週間後
1サイクル施行時:初回投与から4週間後
*5 術後補助療法開始前4週間以内及び術前補助療法開始日を起点に16週毎の評価が規定されていた
投与スケジュール
■ 術前補助療法(扁平上皮癌):1~12週、1~4サイクル
■ 術前補助療法(非扁平上皮癌):1~12週、1~4サイクル
Q3W:3週間間隔、Q6W:6週間間隔
併用する抗悪性腫瘍剤の使用にあたっては、各製品電子添文を熟読の上、投与を行ってください。
■術後補助療法:1~39週、1~13サイクル