KEYNOTE-024試験(日本人集団)
日本人集団における患者背景(ITT集団)
日本人集団における無増悪生存期間:PFS(サブグループ解析)
日本人集団における無増悪生存期間(PFS)のKaplan-Meier曲線(ITT集団)
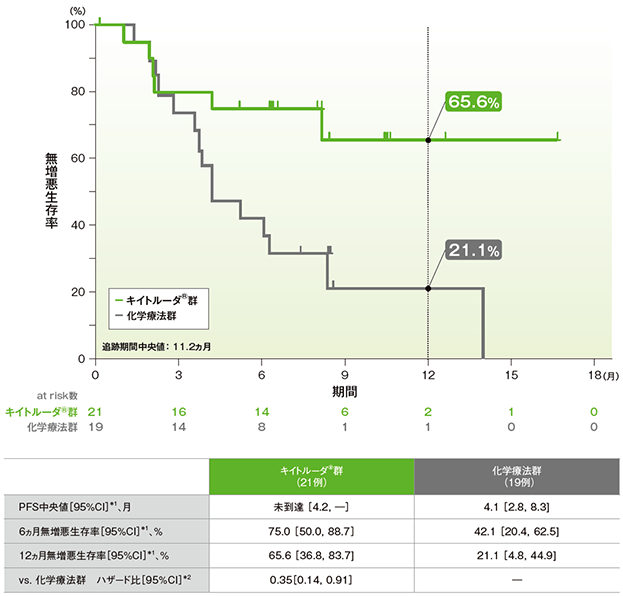
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、治験実施医療機関の地域(東アジア、東アジア以外)、ECOG PS(0、1)、非小細胞肺癌組織型(扁平上皮癌、非扁平上皮癌)を層別因子とした層別Cox比例ハザードモデルに基づく
(全体集団(ITT)追跡期間中央値:11.2ヵ月)(データカットオフ日:2016年5月9日)
日本人集団における全生存期間:OS(サブグループ解析)
日本人集団における全生存期間(OS)のKaplan-Meier曲線(ITT集団)
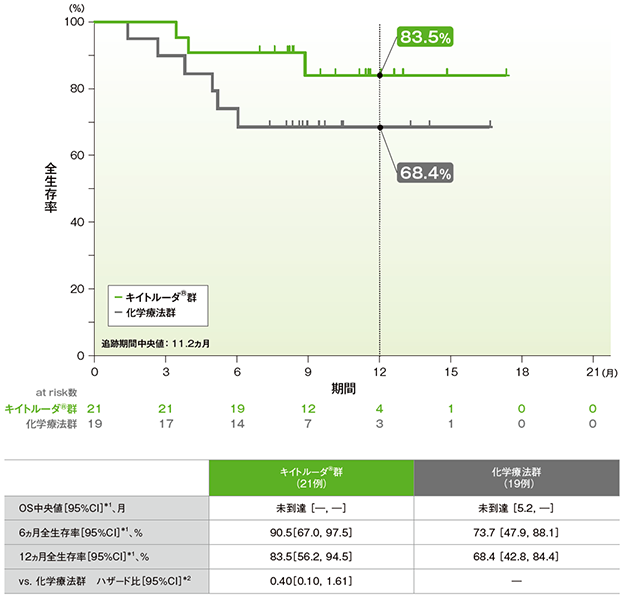
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、治験実施医療機関の地域(東アジア、東アジア以外)、ECOG PS(0、1)、非小細胞肺癌組織型(扁平上皮癌、非扁平上皮癌)を層別因子とした層別Cox比例ハザードモデルに基づく
(全体集団(ITT)追跡期間中央値:11.2ヵ月)(データカットオフ日:2016年5月9日)
日本人集団における奏効率:ORR(サブグループ解析)
日本人集団における独立判定評価に基づく奏効率(ORR)の要約(ITT集団)

(全体集団(ITT)追跡期間中央値:11.2ヵ月)(データカットオフ日:2016年5月9日)
日本人集団における奏効期間:DOR(サブグループ解析)
日本人集団における独立判定評価に基づく奏効までの期間及び奏効期間(DOR)の要約(ITT集団)
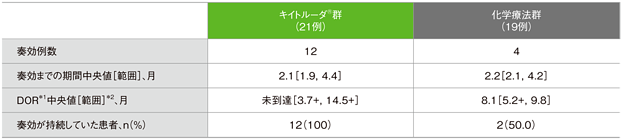
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 「+」は最後の疾患評価までPDがみられないことを示す
(全体集団(ITT)追跡期間中央値:11.2ヵ月)(データカットオフ日:2016年5月9日)
日本人集団における主な副作用
キイトルーダ®群で副作用は、20/21例(95.2%)に認められました。主な副作用(発現率10%以上)は、発熱5例(23.8%)、下痢4例(19.0%)、甲状腺機能低下症、口内炎、注入に伴う反応、食欲減退、斑状丘疹状皮疹、発疹各3例(14.3%)でした。重篤な副作用は4例(19.0%)に認められ、その内訳は肺臓炎、血液量減少症・顔面浮腫・心膜炎、疲労、注入に伴う反応・下痢・腸炎各1例(4.8%)でした。副作用による中止は2例で、その内訳は肺臓炎、疲労各1例(4.8%)でした。副作用による死亡例は認められませんでした。
化学療法群で副作用は18/19例(94.7%)に認められました。主な副作用(発現率10%以上)は、食欲減退12例(63.2%)、悪心11例(57.9%)、貧血9例(47.4%)、倦怠感、血小板数減少(臨床検査)、白血球数減少(臨床検査)各8例(42.1%)、しゃっくり6例(31.6%)、便秘5例(26.3%)、好中球数減少(臨床検査)、低アルブミン血症各4例(21.1%)、下痢、末梢性感覚ニューロパチー各3例(15.8%)、好中球減少症、嘔吐、発熱、疲労、肺感染、アラニンアミノトランスフェラーゼ増加(臨床検査)、関節痛、味覚異常、脱毛症各2例(10.5%)でした。重篤な副作用は5例(26.3%)に認められ、その内訳は肺胞出血、肺感染・血小板数減少、肺臓炎、蜂巣炎、肺感染各1例(5.3%)でした。副作用による投与中止は、低酸素症及び肺胞出血による1例(5.3%)でした。副作用による死亡は、肺胞出血による1例(5.3%)でした。
副作用(いずれかの投与群で発現率5%以上)(ASaT集団)
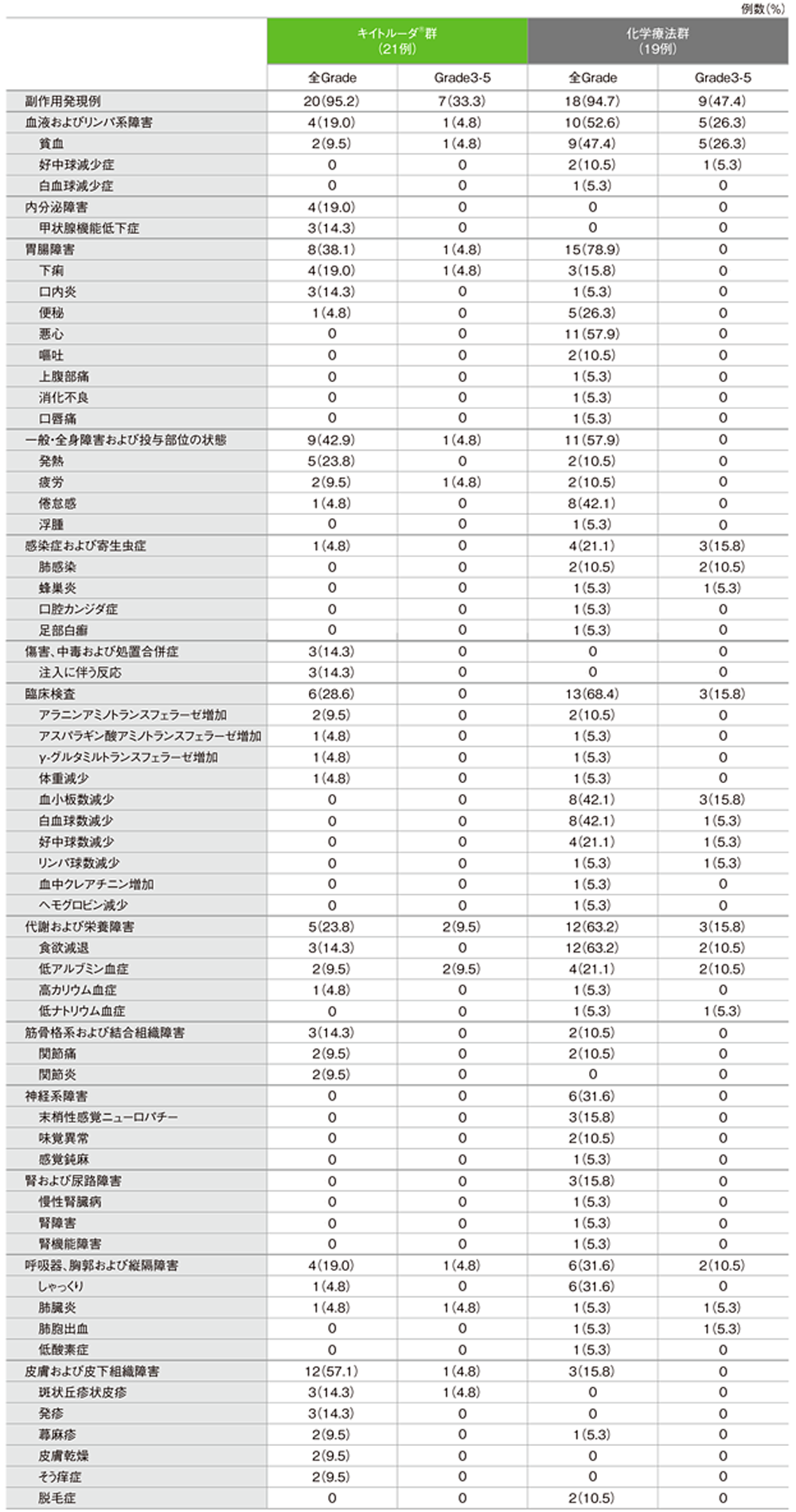
MedDRA/J version 19.0、GradeはCTCAE version 4.0 (データカットオフ日:2016年5月9日)
日本人集団における免疫関連など特に注目すべき有害事象
キイトルーダ®群で免疫関連など特に注目すべき有害事象(以下、注目すべき有害事象)は9/21例(42.9%)に認められました。主な注目すべき有害事象(発現率5%以上)は、Infusion reaction 4例(19.0%)、甲状腺機能低下症3例(14.3%)、肺臓炎2例(9.5%)でした。重篤な注目すべき有害事象は2例(9.5%)、起因する中止例は肺臓炎による1例(4.8%)、死亡例は認められませんでした。
化学療法群で注目すべき有害事象は1/19例(5.3%)に認められ、重篤な注目すべき有害事象と判断されました。注目すべき有害事象に起因する中止例、死亡例は認められませんでした。
免疫関連など特に注目すべき有害事象一覧(ASaT集団)
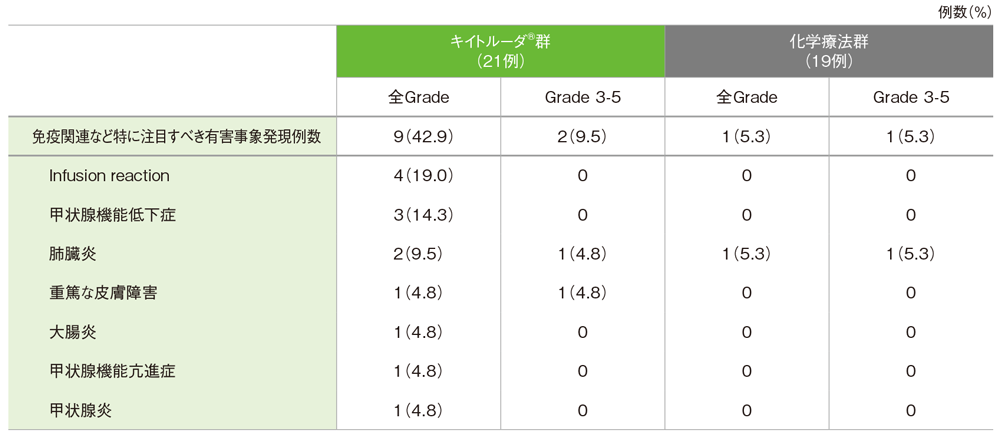
MedDRA/J version 19.0、GradeはCTCAE version 4.0 (データカットオフ日:2016年5月9日)
3年間フォローアップでの日本人集団における奏効率:ORR(サブグループ解析)
日本人集団における3年間フォローアップでの奏効率(ORR)の要約(ITT集団)
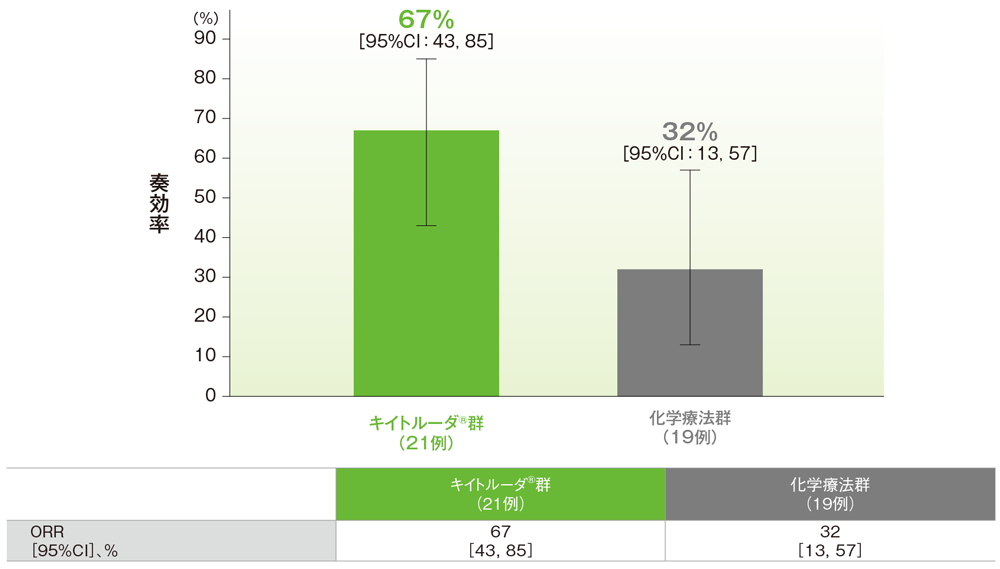
欠測データはNRIで補完
(追跡期間中央値:43.3ヵ月)(データカットオフ日:2019年2月15日)
Satouchi M et al. Cancer Sci 2021; 112: 5000-5010
本試験はMSD社の資金提供により行われた。
- ORRはキイトルーダ®群で67%(95%CI:43,85)、化学療法群で32%(95%CI:13,57)でした。
3年間フォローアップでの奏効期間:DOR(サブグループ解析)

*1 奏効例14例(部分奏効)のうち7例は35サイクル(2年間)の治療を完遂し、そのうち3例はキイトルーダ®の投与第2期を実施した(論文中に化学療法群の奏効例数の記載なし)
*2 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
(追跡期間中央値:43.3ヵ月)(データカットオフ日:2019年2月15日)
Satouchi M et al. Cancer Sci 2021; 112: 5000-5010
本試験はMSD社の資金提供により行われた。
- DOR中央値は、キイトルーダ®群において29.1ヵ月(範囲:4.2, 39.5)、化学療法群で、6.4ヵ月(範囲:3.1, 10.4)でした。
3年間フォローアップでの日本人集団における安全性*
【副作用】
キイトルーダ®群:21/21例(100%) 主な副作用(発現率10%以上):発熱5例(24%)、下痢及び発疹各4例(19%)、食欲減退3例(14%)、貧血、倦怠感、低アルブミン血症各2例(10%)化学療法群:18/19例(95%) 主な副作用(発現率10%以上):食欲減退12例(63%)、悪心11例(58%)、貧血9例(47%)、倦怠感、血小板数減少、白血球数減少各8例(42%)、しゃっくり6例(32%)、便秘5例(26%)、好中球数減少、低アルブミン血症各4例(21%)、下痢、末梢性感覚ニューロパチー各3例(16%)、発熱2例(11%)
【投与中止に至った副作用】
キイトルーダ®群:4例(19%) 内訳:肺臓炎2例、疲労、ぶどう膜炎各1例
化学療法群:1例(5%) 内訳:低酸素症及び肺胞出血
【死亡に至った副作用】
キイトルーダ®群:認められなかった
化学療法群:1例(5%) 内訳:肺胞出血
* 重篤な副作用の例数及び内訳は論文中に記載なし
(データカットオフ日:2019年2月15日)
3年間フォローアップでの日本人集団における副作用一覧(いずれかの群で発現率15%以上)(ASaT集団)
【キイトルーダ®群】
全Grade:21/21例(100%) 内訳:発熱5例(24%)、下痢、発疹各4例(19%)、食欲減退3例(14%)、貧血、倦怠感、低アルブミン血症各2例(10%)、しゃっくり、便秘、末梢性感覚ニューロパチー各1例(5%)
Grade 3-5:8/21例(38%) 内訳:低アルブミン血症2例(10%)、下痢、貧血各1例(5%)
【化学療法群】
全Grade:18/19例(95%) 内訳:食欲減退12例(63%)、悪心11例(58%)、貧血9例(47%)、倦怠感、血小板数減少、白血球数減少各8例(42%)、しゃっくり6例(32%)、便秘5例(26%)、低アルブミン血症、好中球数減少各4例(21%)、下痢、末梢性感覚ニューロパチー各3例(16%)、発熱2例(11%)
Grade 3-5:9/19例(47%) 内訳:貧血5例(26%)、血小板数減少3例(16%)、食欲減退、低アルブミン血症各2例(11%)、白血球数減少、好中球数減少各1例(5%)
GradeはCTCAE version 4.0
(データカットオフ日:2019年2月15日)
Satouchi M et al. Cancer Sci 2021; 112: 5000-5010
本試験はMSD社の資金提供により行われた。
3年間フォローアップでの日本人集団における免疫関連など特に注目すべき有害事象(ASaT集団)
【キイトルーダ®群】
全Grade:11/21例(52%) 内訳:Infusion reaction 4例(19%)、肺臓炎、甲状腺機能低下症各3例(14%)、大腸炎、肝炎、甲状腺機能亢進症、重篤な皮膚障害、甲状腺炎、ぶどう膜炎各1例(5%)
Grade 3-5:4/21例(19%) 内訳:肺臓炎、肝炎、重篤な皮膚障害、ぶどう膜炎各1例(5%)
【化学療法群】
全Grade:4/19例(21%) 内訳:甲状腺機能低下症2例(11%)、Infusion reaction、肺臓炎、副腎機能不全各1例(5%)
Grade 3-5:1/19例(5%) 内訳:肺臓炎1例(5%)
GradeはCTCAE version 4.0
(データカットオフ日:2019年2月15日)
Satouchi M et al. Cancer Sci 2021; 112: 5000-5010
本試験はMSD社の資金提供により行われた。