KEYNOTE-189試験
非小細胞肺癌:国際共同臨床試験成績:化学療法未治療患者を対象とした化学療法併用試験:国際共同第Ⅲ相試験<KEYNOTE-189試験>
承認時評価資料:国際共同第Ⅲ相試験(KEYNOTE-189試験)
Gandhi L et al. N Engl J Med 2018; 378: 2078-2092
Gandhi L et al. N Engl J Med 2018; 378: 2078-2092 Supplementary Data(Protocol)
Gadgeel S et al. J Clin Oncol 2020; 38: 1505-1517
Garassino MC et al. Lancet Oncol 2020; 21: 387-397
Rodríguez-Abreu D et al. Ann Oncol 2021; 32: 881 895
Horinouchi H, et al. Cancer Science 2021; 112: 3255-3265
Garassino MC et al. J Clin Oncol 2023; 41 : 1992-1998
Garassino MC et al. J Clin Oncol 2023; 41: 1992-1998 Supplementary Data(Protocol)
本試験はMSD社の資金提供により行われた。Leena GandhiはMSD社から顧問料などを受領している。また、著者のうち、John Vida、Ziwen Wei、Jing Yang、Harry Raftopoulos、M. Catherine Pietanzaは同社の社員である。その他の著者にMSD社より講演料、顧問料などを受領している者が含まれる。2年間フォローアップの解析報告では、Shirish GadgeelはMSD社から研究援助を受けている。また、著者のうち、Jing Yang、Tuba Bas、M. Catherine Pietanzaは同社の社員である。その他の著者にMSD社より講演料、顧問料などを受領している者が含まれる。最終解析報告では、D. Rodríguez-Abreu、Enriqueta Felip、Manuel Dómine、Nir Peled、Rina HuiはMSD社から顧問料などを受領している。著者のうち、Jing Yang、M. Catherine Pietanza、Fabricio Souzaは同社の社員である。その他の著者に MSD社より講演料、顧問料などを受領している者が含まれる。拡大コホートを含む日本人集団のフォローアップの解析報告では、Hidehito Horinouchi、Naoyuki NogamiはMSD社から顧問料などを受領している。著者のうち、Noriaki Adachi、Kazuo Noguchiは同社の社員である。その他の著者にMSD社より講演料、顧問料などを受領している者が含まれる。5年間フォローアップ解析報告では、Marina C. GarassinoはMSD社から講演料、研究費などを受領している。また、著者のうち、Paul Schwarzenberger、M. Catherine Pietanzaは同社の社員である。その他の著者にMSD社より講演料、研究費などを受領している者が含まれる。
試験概要
【目的】化学療法未治療の、EGFR遺伝子変異陰性、ALK融合遺伝子陰性の進行・再発の非扁平上皮非小細胞肺癌患者における、キイトルーダ®とペメトレキセド及びプラチナ製剤(以下、化学療法)併用と、プラセボと化学療法の併用の有効性及び安全性を比較検討する。
【デザイン】国際共同無作為化二重盲検第Ⅲ相試験[優越性試験][第1回中間解析結果(データカットオフ日:2017年11月8日)][2年間フォローアップ解析結果(データカットオフ日:2018年9月21日)][最終解析結果(データカットオフ日:2019年5月20日)][5年間フォローアップ解析結果(データカットオフ日:2022年3月8日)]
【対象】化学療法未治療の、EGFR遺伝子変異陰性、ALK融合遺伝子陰性の進行・再発の非扁平上皮非小細胞肺癌患者616例(日本人10例を含む)
【方法】キイトルーダ®と化学療法併用群(以下、キイトルーダ®併用群:キイトルーダ® 200mgとペメトレキセド*1 500mg/m2とシスプラチン75mg/m2又はカルボプラチンAUC*25相当量を3週間間隔で4サイクル点滴静注後、キイトルーダ®200mgとペメトレキセド*1 500mg/m2を3週間間隔で点滴静注)又はプラセボと化学療法併用群(以下、プラセボ併用群:プラセボとペメトレキセド*1 500mg/m2とシスプラチン75mg/m2又はカルボプラチンAUC*2 5相当量を3週間間隔で4サイクル点滴静注後、プラセボとペメトレキセド*1 500mg/m2を3週間間隔で点滴静注)に2:1の割合で無作為割り付けした。
最初の48週間は、6週目、12週目、その後は9週間ごとに、48週以降は12週間ごとに画像診断により腫瘍縮小効果を判定し、病勢進行(PD)、許容できない有害事象の発現等による投与中止、投与完了(キイトルーダ®及びプラセボのみ:35回)まで継続した。また、キイトルーダ®併用群に割り付けられた患者はPDが認められるが臨床的に有益であると判断された場合、合計35回の投与完了までキイトルーダ®単独療法を受けることができた。プラセボ併用群に割り付けられた患者はPDと判定され、クロスオーバーに関する基準#をすべて満たした場合は、任意でキイトルーダ®の単独投与を受けられることとした。
♯クロスオーバーに関する基準
- 盲検下独立判定委員会(BICR)によるRECISTガイドライン1.1版に基づくPDが認められる
- 化学療法と因果関係がある有害事象(脱毛を除く)がある場合は、Grade 1(CTCAE v4.0)以下に回復している
- 新規又は進行した脳転移により状態が不安定でない患者
- ECOG PS 0-1
- 本試験において施行された化学療法以外の全身性の抗悪性腫瘍薬による治療を施行していない
- クロスオーバー期の治療開始前7日間以前に30Gy以下の緩和的放射線療法を完了している
なお、BICRでPDが確認されたが、患者がクロスオーバー期への基準を満たさない場合、盲検解除を検討できる
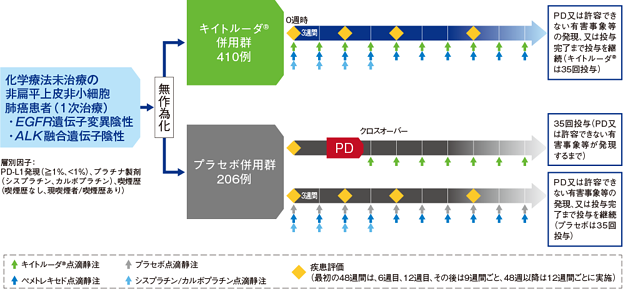
【評価項目】主要評価項目:全生存期間(overall survival; OS)※1、無増悪生存期間(progression-free survival; PFS)※1
副次評価項目:奏効率(overall response rate; ORR)※2、奏効期間(duration of response; DOR)、安全性
探索的評価項目:PD-L1発現状況(TPS*3)別のOS、PFS及びORR、ランダム化割付けから2次治療開始後での病勢進行、又は死亡のいずれかが先に起こるまでの期間(PFS2)、患者報告アウトカム(PRO):健康関連QOLなど
※1 第1回中間解析、最終解析の検証的解析項目 ※2 第1回中間解析の検証的解析項目
【判定基準】PFS、ORR、DORは、盲検下独立判定委員会(BICR)がRECISTガイドライン1.1版に基づき評価した。
【解析計画】解析対象集団:有効性の解析はITT集団*4、安全性の解析はASaT集団*5 を対象として実施した。
有効性評価の統計手法:OS、PFS、PFS2の生存曲線はKaplan-Meier法を用いて推定した。OS、PFSの群間比較には、層別ログランク検定を用いた。OS、PFS、PFS2の投与群のみを共変量とした層別Cox比例ハザードモデルを用いて、ハザード比(HR)及び95%信頼区間(95%CI)を算出した。ORRの群間比較には、層別Miettinen and Nurminen法を用いた。DORはKaplan-Meier法による中央値と四分位点を用いて記述的に要約した。OS、PFSのサブグループ解析を、PD-L1発現状況[陰性(TPS<1%)、陽性(TPS≧1%)]、プラチナ製剤の種類(カルボプラチン、シスプラチン)、喫煙歴(現喫煙者/喫煙歴あり、喫煙歴なし)の層別因子*6に加え、年齢(<65歳、≥65歳)、性別(男性、女性)、ECOG PS(0、1)、PD-L1発現状況(TPS<1%、TPS1-49%、TPS≥50%)、脳転移(あり、なし)などのベースライン時の背景因子別の部分集団を対象に、層別Cox比例ハザードモデルを用いて実施した。ORRのPD-L1発現状況(陰性、低発現、高発現)のサブグループ解析ではClopper-Pearson法(二項分布の確率計算による正確法)を用いて95%CIを算出した。日本人集団については、本試験に既に組み入れられていた症例及び拡大コホートに組み入れられた症例を対象とし、OS、PFS、PFS2、ORR、DOR、奏効までの期間等を全体集団と同様に検討することとした。また、補足的にTwo-stageモデルを用いてクロスオーバーの影響を調整したOSの解析を行った。
健康関連QOLに関するPRO評価の統計手法:健康関連QOLに関するPROの評価は1、2、3、4及び5サイクル時、その後1年目までは3サイクルごと、2、3年目は4サイクルごとに増悪まで実施した。FAS集団*7を解析対象とし、EORTC QLQ-C30 GHS/QOLスコアのベースラインからの変化量と群間差(12、21週時の最小二乗平均)は、応答変数としてEORTC QLQ-C30 GHS/QOLスコア、投与群、時点、投与群と時点の交互作用項を説明変数、無作為化層別因子*6を共変量に含めたcLDAモデルで評価した。また、QLQ-LC13 咳嗽、胸痛及びQLQ-C30 呼吸困難の複合スコアの悪化までの期間*8は層別ログランク検定及び層別Cox比例ハザードモデルを用いて評価した。
多重性の調整:本試験は、2回の中間解析を事前に計画し、試験全体の有意水準を片側2.5%とした。1回目の中間解析では、PFS、OS及びORRの検定を、2回目の中間解析ではOS及びPFSの検定を、最終解析ではOSの検定を実施することとした。なお、PFSかつOSの仮説検定で優越性が示された場合のみ、1回目の中間解析のデータを用いてORRの仮説検定を行う計画とした。OS、PFS、ORRの多重性はMaurer and BretzによるGraphical法により調整した。事前に規定された解析結果とともに、2年間フォローアップ解析(データカットオフ日:2018年9月21日)、5年間フォローアップ解析(データカットオフ日:2022年3月8日)から得られた有効性及び安全性の結果を示す。
*1 ビタミン補充を伴う
*2 AUC(area under the concentration-time curve):濃度-時間曲線下面積
*3 TPS(tumor proportion score):腫瘍細胞のうちPD-L1発現陽性細胞の割合
*4 ITT(intention to treat)集団:無作為化したすべての患者
*5 ASaT(all subjects as treated)集団:無作為化され、治験薬が1回以上投与されたすべての患者
*6 無作為化層別因子:PD-L1発現状況、プラチナ製剤の種類、喫煙歴
*7 FAS(full analysis set)集団:無作為化され、治験薬が1回以上投与されたすべての患者のうち、少なくとも1回以上質問票に完全に回答した患者
*8 咳嗽、胸痛、呼吸困難のいずれかのスコアが初めてベースラインから10ポイント以上増加するまでの期間とし、次の測定で10ポイント以上の増加が再度確認された事象を確定とした。
4. 効能又は効果 (抜粋)
切除不能な進行・再発の非小細胞肺癌
5. 効能又は効果に関連する注意(抜粋)
〈切除不能な進行・再発の非小細胞肺癌〉
5.2 本剤の術後補助療法における有効性及び安全性は確立していない。
5.3 本剤を単独で投与する場合には、PD-L1の発現が確認された患者に投与すること。PD-L1を発現した腫瘍細胞が占める割合(TPS)について、「17. 臨床成績」の項の内容を熟知すること。十分な経験を有する病理医又は検査施設において、承認された体外診断用医薬品又は医療機器を用いること。なお、承認された体外診断用医薬品又は医療機器に関する情報については、以下のウェブサイトから入手可能である:https://www.pmda.go.jp/review-services/drug-reviews/review-information/cd/0001.html[17.1.8-17.1.10参照]
5.4 臨床試験に組み入れられた患者のEGFR遺伝子変異又はALK融合遺伝子の有無等について、「17. 臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。[17.1.6、17.1.8-17.1.10参照]
ペメトレキセドナトリウム水和物の効能又は効果は以下のとおりです。
4. 効能又は効果
悪性胸膜中皮腫、切除不能な進行・再発の非小細胞肺癌
シスプラチンの効能又は効果は以下のとおりです。
4. 効能又は効果(抜粋)シスプラチン通常療法
睾丸腫瘍、膀胱癌、腎盂・尿管腫瘍、前立腺癌、卵巣癌、頭頸部癌、非小細胞肺癌、食道癌、子宮頸癌、神経芽細胞腫、胃癌、小細胞肺癌、骨肉腫、胚細胞腫瘍(精巣腫瘍、卵巣腫瘍、性腺外腫瘍)、悪性胸膜中皮腫、胆道癌
以下の悪性腫瘍に対する他の抗悪性腫瘍剤との併用療法
悪性骨腫瘍、子宮体癌(術後化学療法、転移・再発時化学療法)、再発・難治性悪性リンパ腫、小児悪性固形腫瘍(横紋筋肉腫、神経芽腫、肝芽腫その他肝原発悪性腫瘍、髄芽腫等)
カルボプラチンの効能又は効果、用法及び用量は以下のとおりです。
4. 効能又は効果
○頭頸部癌、肺小細胞癌、睾丸腫瘍、卵巣癌、子宮頸癌、悪性リンパ腫、非小細胞肺癌、乳癌
○以下の悪性腫瘍に対する他の抗悪性腫瘍剤との併用療法
小児悪性固形腫瘍(神経芽腫・網膜芽腫・肝芽腫・中枢神経系胚細胞腫瘍、再発又は難治性のユーイング肉腫ファミリー腫瘍・腎芽腫)
6. 用法及び用量(抜粋)〈非小細胞肺癌〉
通常、成人にはカルボプラチンとして、1日1回300~400mg/m2(体表面積)を投与し、少なくとも4週間休薬する。これを1クールとし、投与を繰り返す。なお、投与量は、年齢、疾患、症状により適宜増減する。
患者背景(ITT集団)
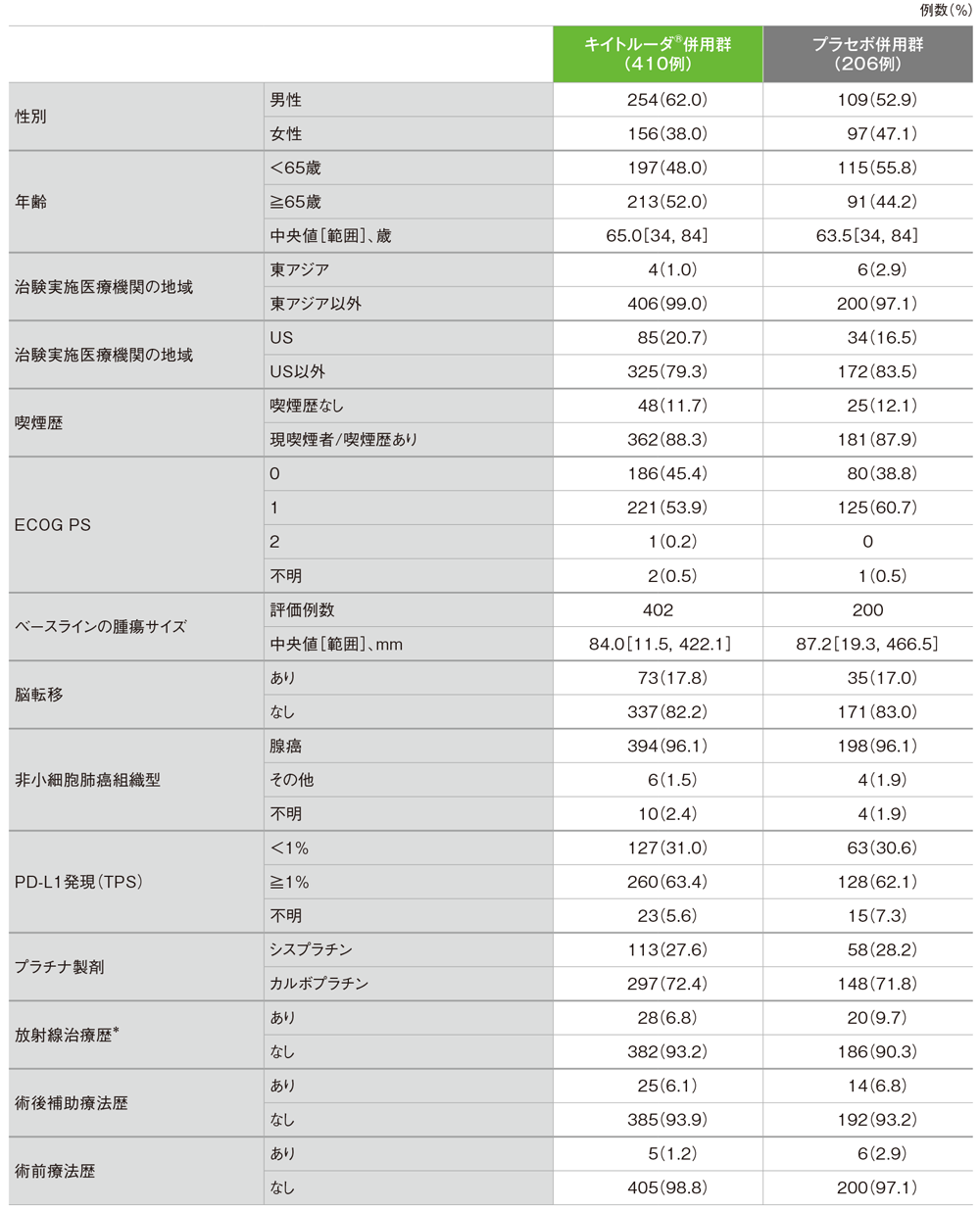
*胸部放射線治療
PD-L1発現(TPS*)の分布
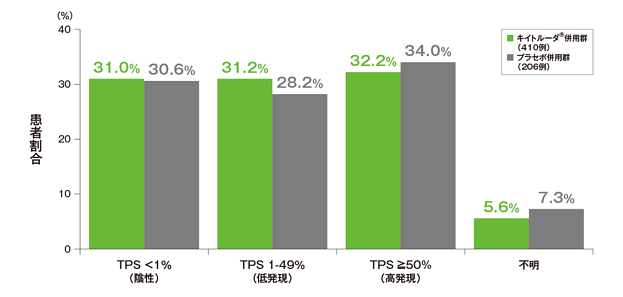
*TPS=tumor proportion score(腫瘍細胞のうちPD-L1発現陽性細胞の割合)
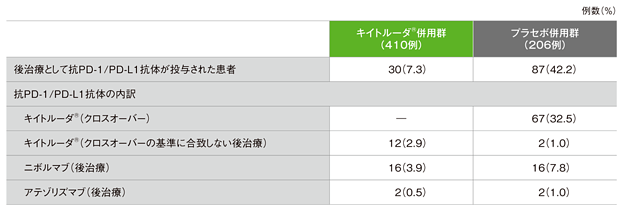
後治療として抗PD-1/PD-L1抗体が投与された患者の内訳(ITT集団)
主要評価項目(優越性試験) 全生存期間:OS
全生存期間(OS)のKaplan-Meier曲線(ITT集団)
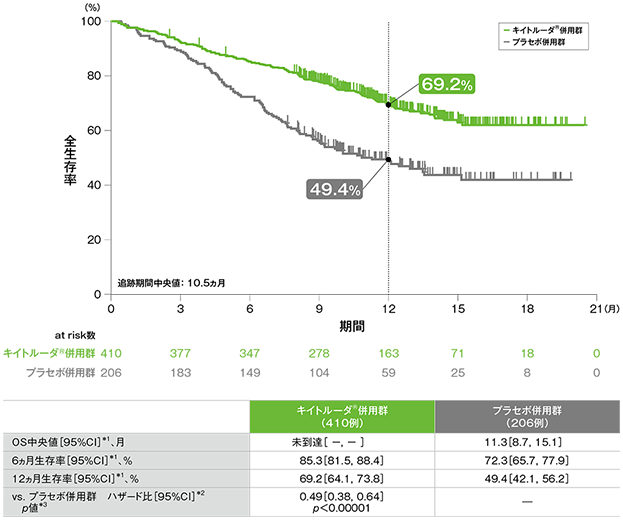
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、PD-L1発現(≧1%、<1%)、プラチナ製剤(シスプラチン、カルボプラチン)、喫煙歴(喫煙歴なし、現喫煙者/喫煙歴あり)を層別因子(無作為化に用いた層別因子)とした層別Cox比例ハザードモデルに基づく
*3 層別ログランク検定[片側](層別因子は無作為化に用いた層別因子)、有意水準α=0.00128
(追跡期間中央値:10.5ヵ月)
探索的評価項目(サブグループ解析) PD-L1発現別にみた全生存期間:OS
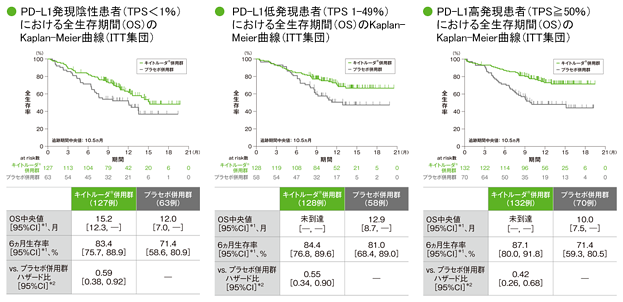
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、PD-L1発現(≧1%、<1%)、プラチナ製剤(シスプラチン、カルボプラチン)、喫煙歴(喫煙歴なし、現喫煙者/喫煙歴あり)を層別因子とした層別Cox比例ハザードモデルに基づく
(追跡期間中央値:10.5ヵ月)
部分集団因子別にみた全生存期間:OS(サブグループ解析)
全生存期間(OS)のハザード比のフォレストプロット(ITT集団)
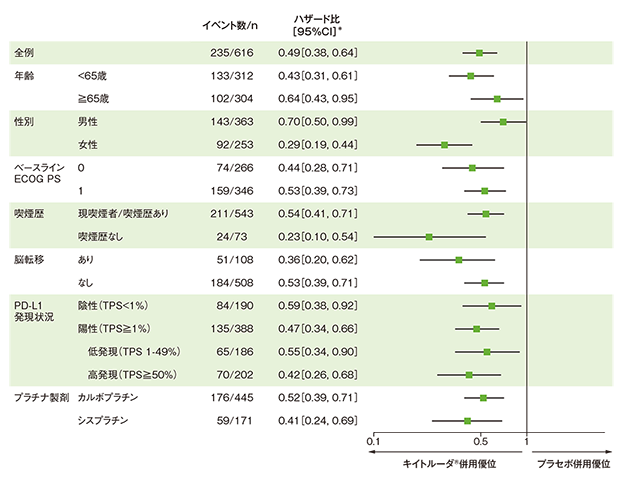
*投与群を共変量とし、PD-L1発現(≧1%、<1%)、プラチナ製剤(シスプラチン、カルボプラチン)、喫煙歴(喫煙歴なし、現喫煙者/喫煙歴あり)を層別因子とした層別Cox比例ハザードモデルに基づく
主要評価項目(優越性試験) 無増悪生存期間:PFS
無増悪生存期間(PFS)のKaplan-Meier曲線(ITT集団)
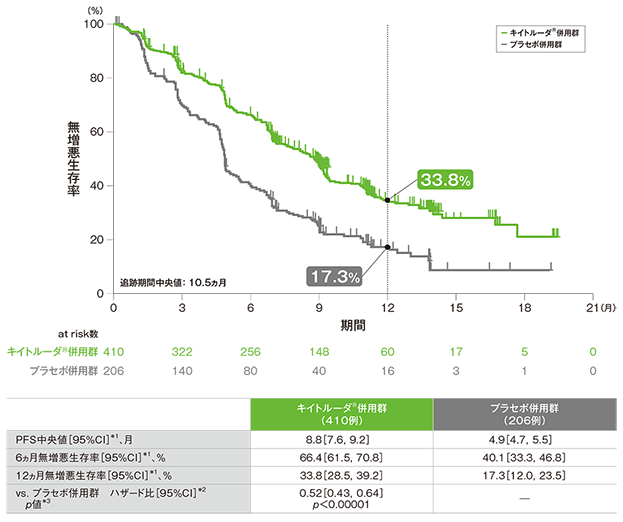
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、PD-L1発現(≧1%、<1%)、プラチナ製剤(シスプラチン、カルボプラチン)、喫煙歴(喫煙歴なし、現喫煙者/喫煙歴あり)を層別因子(無作為化に用いた層別因子)とした層別Cox比例ハザードモデルに基づく
*3 層別ログランク検定[片側](層別因子は無作為化に用いた層別因子)、有意水準α=0.00559
(追跡期間中央値:10.5ヵ月)
探索的評価項目(サブグループ解析) PD-L1発現別にみた無増悪生存期間:PFS
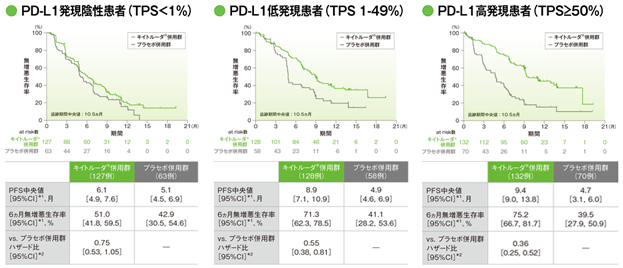
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、PD-L1発現(≧1%、<1%)、プラチナ製剤(シスプラチン、カルボプラチン)、喫煙歴(喫煙歴なし、現喫煙者/喫煙歴あり)を層別因子とした層別Cox比例ハザードモデルに基づく
(追跡期間中央値:10.5ヵ月)
副次評価項目 奏効率:ORR
奏効率(ORR)(ITT集団)
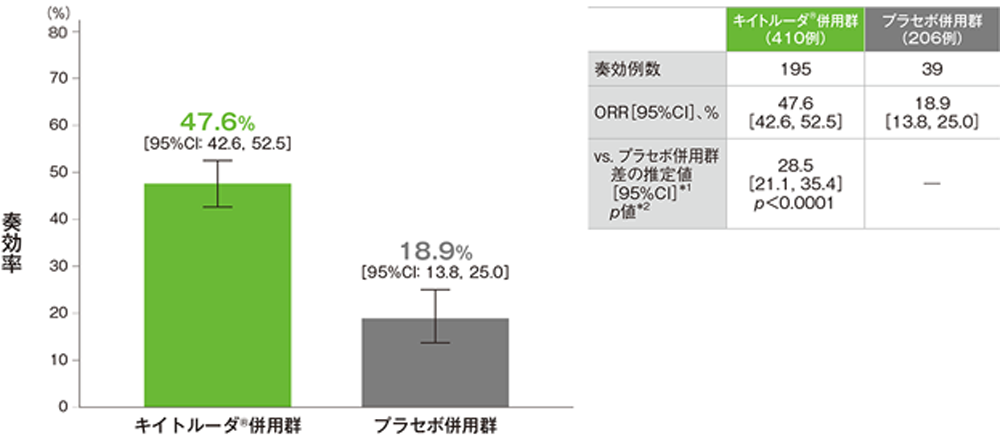
*1 PD-L1発現(≧1%、<1%)、プラチナ製剤(シスプラチン、カルボプラチン)、喫煙歴(喫煙歴なし、現喫煙者/喫煙歴あり)を層別因子(無作為化に用いた層別因子)とした層別Miettinen and Nurminen法に基づく
*2 層別Miettinen and Nurminen法[片側](層別因子は無作為化に用いた層別因子)、有意水準α=0.025
(追跡期間中央値:10.5ヵ月)
探索的評価項目(サブグループ解析) PD-L1発現別にみた奏効率:ORR
PD-L1発現別にみた奏効率(ORR)(ITT集団)
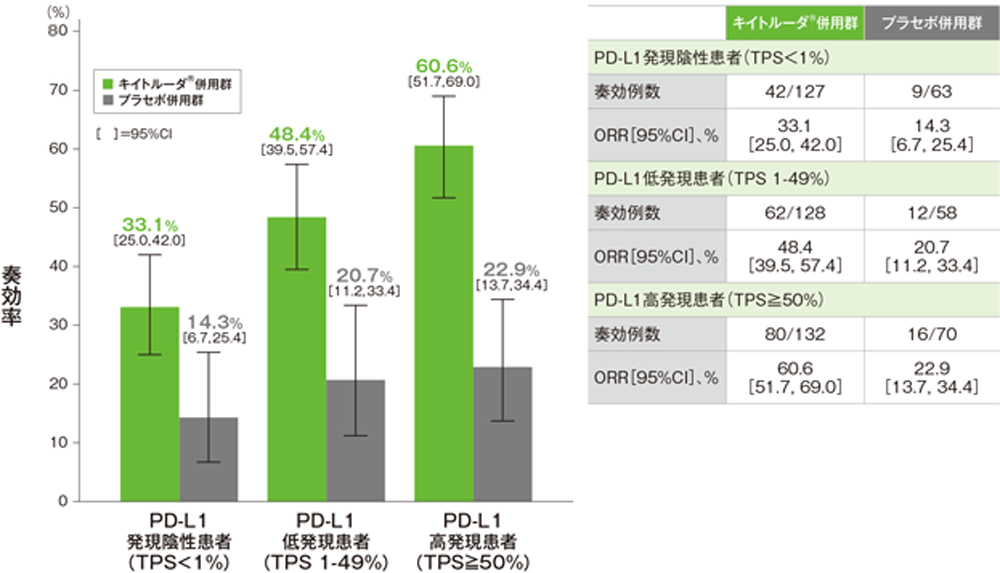
(追跡期間中央値:10.5ヵ月)
安全性
キイトルーダ®併用群で副作用は372/405例(91.9%)に認められました。主な副作用(発現率10%以上)は、悪心187例(46.2%)、貧血154例(38.0%)、疲労134例(33.1%)、好中球減少症101例(24.9%)、食欲減退84例(20.7%)、下痢78例(19.3%)、嘔吐74例(18.3%)、血小板減少症69例(17.0%)、便秘67例(16.5%)、無力症53例(13.1%)、流涙増加、発疹各51例(12.6%)でした。重篤な副作用は106例(26.2%)に認められ、2例以上にみられた重篤な副作用は、発熱性好中球減少症21例(5.2%)、血小板減少症13例(3.2%)、下痢12例(3.0%)、肺臓炎11例(2.7%)、貧血9例(2.2%)、急性腎障害、好中球減少症各7例(1.7%)、嘔吐5例(1.2%)、蜂巣炎、汎血球減少症、肺炎、発熱各4例(1.0%)、無力症、大腸炎、疲労、全身健康状態低下、悪心各3例(0.7%)、血中クレアチニン増加、脱水、肝炎、低マグネシウム血症、腎炎、末梢性浮腫、尿細管間質性腎炎、上気道感染各2例(0.5%)でした。副作用によるキイトルーダ®の中止は59例(14.6%)で、2例以上にみられたキイトルーダ®の中止に至った副作用は肺臓炎11例(2.7%)、急性腎障害7例(1.7%)、大腸炎、疲労、肝炎各3例(0.7%)、血中クレアチニン増加、肝酵素増加、腎炎、尿細管間質性腎炎各2例(0.5%)でした。副作用による化学療法の中止は73例(18.0%)で、2例以上にみられた化学療法の中止に至った副作用は、急性腎障害10例(2.5%)、肺臓炎7例(1.7%)、下痢、疲労、腎不全各4例(1.0%)、血中クレアチニン増加、発熱性好中球減少症、肝炎、汎血球減少症、発疹各3例(0.7%)、無力症、クレアチニン腎クリアランス減少、腎炎、嘔吐各2例(0.5%)でした。副作用による死亡は9例(2.2%)で、その内訳は肺臓炎3例(0.7%)、急性腎障害2例(0.5%)、肺炎、好中球減少性敗血症、脳症、死亡 各1例(0.2%)でした。
プラセボ併用群で副作用は183/202例(90.6%)に認められました。主な副作用(発現率10%以上)は、悪心90例(44.6%)、貧血77例(38.1%)、疲労62例(30.7%)、好中球減少症45例(22.3%)、食欲減退42例(20.8%)、嘔吐39例(19.3%)、無力症31例(15.3%)、血小板減少症27例(13.4%)、便秘24例(11.9%)、下痢22例(10.9%)でした。重篤な副作用は42例(20.8%)に認められ、2例以上にみられた重篤な副作用は、貧血10例(5.0%)、血小板減少症、下痢各5例(2.5%)、発熱性好中球減少症、嘔吐各4例(2.0%)、肺臓炎、悪心各3例(1.5%)、汎血球減少症、アラニンアミノトランスフェラーゼ増加各2例(1.0%)でした。副作用によるプラセボの中止は10例(5.0%)で、2例以上にみられたプラセボの中止に至った副作用は肺臓炎、疲労各3例(1.5%)でした。副作用による化学療法の中止は16例(7.9%)で、2例以上にみられた化学療法の中止に至った副作用は疲労4例(2.0%)、肺臓炎2例(1.0%)でした。副作用による死亡は2例(1.0%)で、その内訳は肺炎、敗血症性ショック各1例(0.5%)でした。
副作用(いずれかの投与群で発現率5%以上)(ASaT集団)
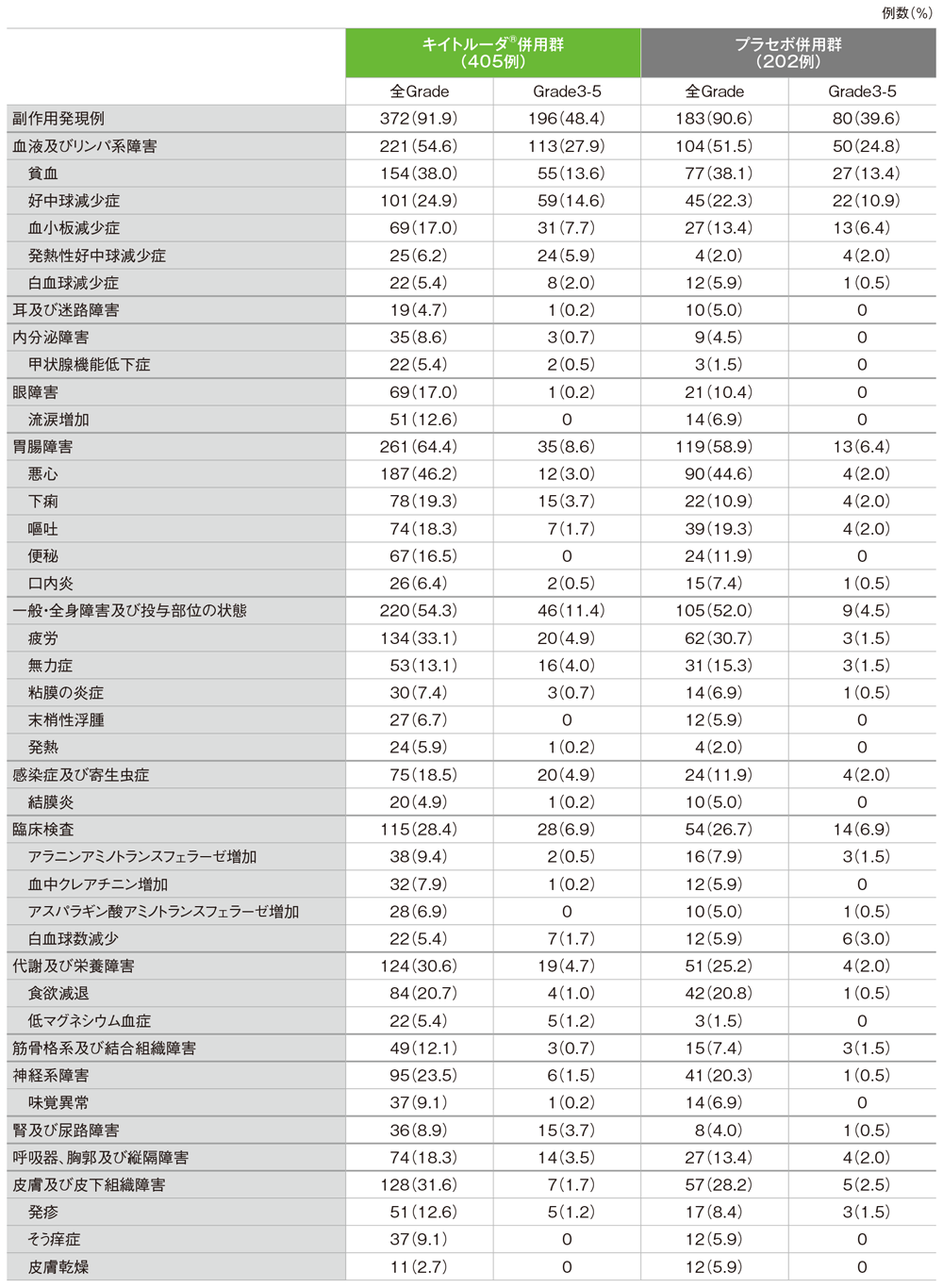
MedDRA/J version 20.1、GradeはCTCAE version 4.03
免疫関連など特に注目すべき有害事象
キイトルーダ®併用群で免疫関連など特に注目すべき有害事象(以下、注目すべき有害事象)は92/405例(22.7%)に認められました。主な注目すべき有害事象(発現率3%以上)は、甲状腺機能低下症27例(6.7%)、肺臓炎18例(4.4%)、甲状腺機能亢進症16例(4.0%)でした。重篤な注目すべき有害事象は27例(6.7%)、起因する中止例は29例(7.2%)、死亡例は肺臓炎による3例(0.7%)でした。
プラセボ併用群で注目すべき有害事象は24/202例(11.9%)に認められました。重篤な注目すべき有害事象は5例(2.5%)、起因する中止例は3例(1.5%)、死亡例は認められませんでした。
免疫関連など特に注目すべき有害事象一覧(ASaT集団)
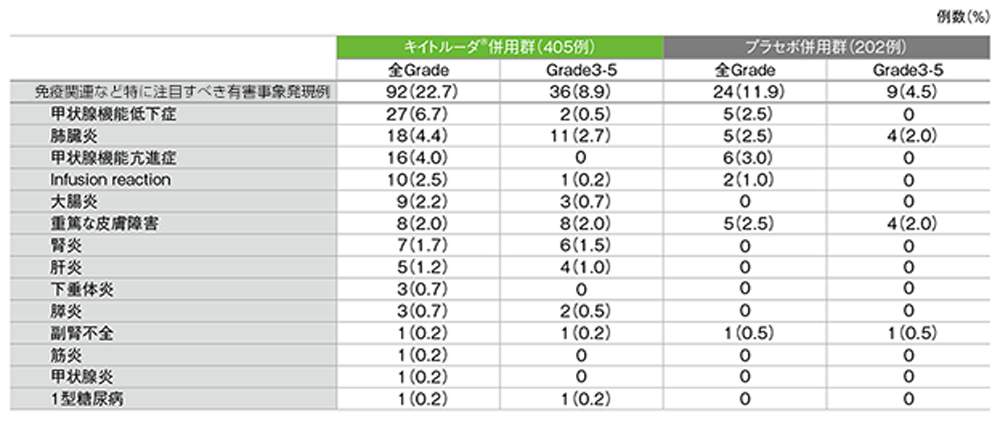
MedDRA/J version 20.1、GradeはCTCAE version 4.03
キイトルーダ®の化学療法併用投与期間中は、以下の検査スケジュールを参考に、患者さんの状態を観察してください。
キイトルーダ®200mgを3週間間隔投与した国際共同第Ⅲ相試験(KEYNOTE-189試験)における検査スケジュール(最大35回投与)
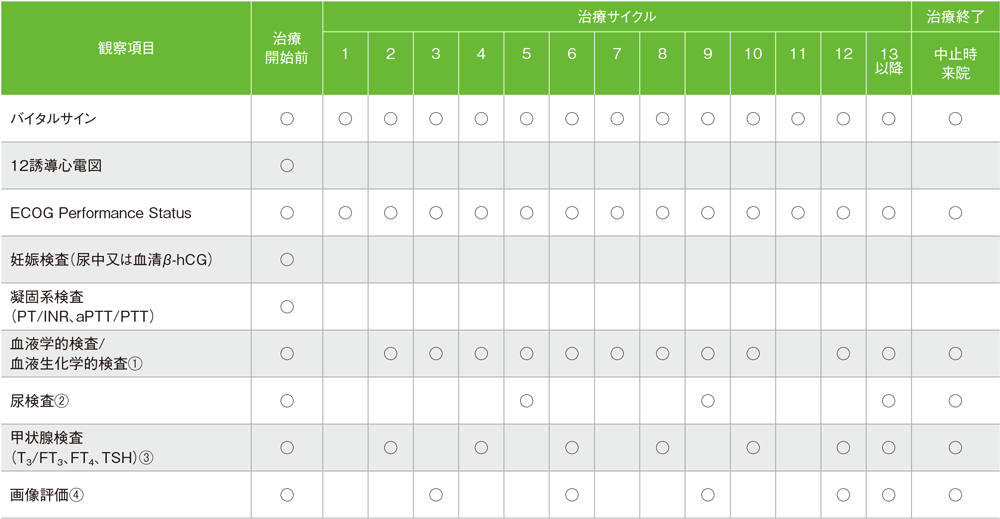
バイタルサイン:体温、脈拍、呼吸数、体重、血圧
妊娠検査:妊娠の可能性がある女性の場合に、治療開始前72時間以内に実施
血液学的検査:ヘマトクリット、ヘモグロビン、血小板数、白血球数、白血球分画、赤血球数、好中球絶対数、リンパ球絶対数
血液生化学的検査:総蛋白、アルブミン、ALT(GPT)、AST(GOT)、ALP、総ビリルビン、直接ビリルビン、BUN、クレアチニン、尿酸、Na、K、Cl、Ca、Mg、P、血糖値、LDH、HCO3–
尿検査:潜血、糖、蛋白、比重、顕微鏡検査(異常値の場合)
①:サイクル毎 ②:6サイクル毎 ③:サイクル13以降2サイクル毎 ④:6週時、12週時、及びその後は9週毎、48週以降は12週毎
キイトルーダ®適正使用ガイド