KEYNOTE-189試験(2年間フォローアップ)
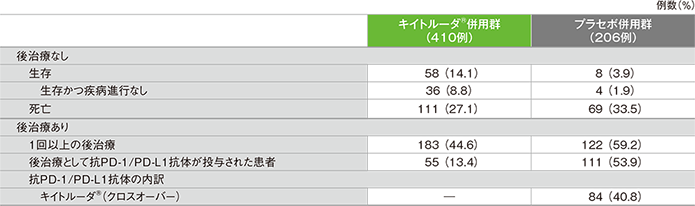
2年間フォローアップでの後治療の実施の有無と患者の内訳(ITT集団)
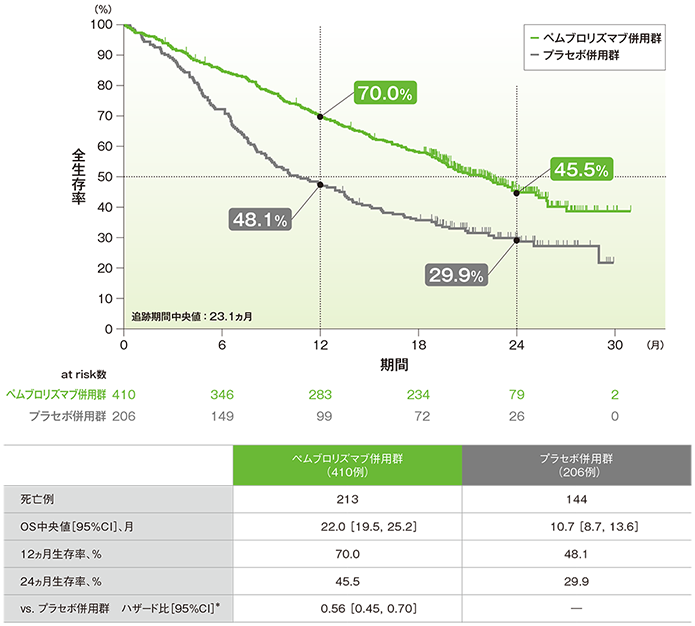
主要評価項目 2年間フォローアップでの全生存期間:OS
全生存期間(OS)のKaplan-Meier曲線(ITT集団)
*PD-L1発現(≥1%、<1%)、プラチナ製剤(シスプラチン、カルボプラチン)、喫煙歴(喫煙歴なし、現喫煙者/喫煙歴あり)を層別因子とした層別Cox比例ハザードモデルに基づく
(追跡期間中央値:23.1ヵ月)
Reprinted with permission. © 2020 American Society of Clinical Oncology. All rights reserved.
Gadgeel S et al. J Clin Oncol 2020; 38(14): 1505-1517.
本試験はMSD社の資金提供により行われた。
- OS中央値は、キイトルーダ®併用群で22.0ヵ月(95%CI:19.5, 25.2)、プラセボ併用群で10.7ヵ月(95%CI:8.7, 13.6)でした。
探索的評価項目(サブグループ解析)
2年間フォローアップでのPD-L1発現別にみた全生存期間:OS
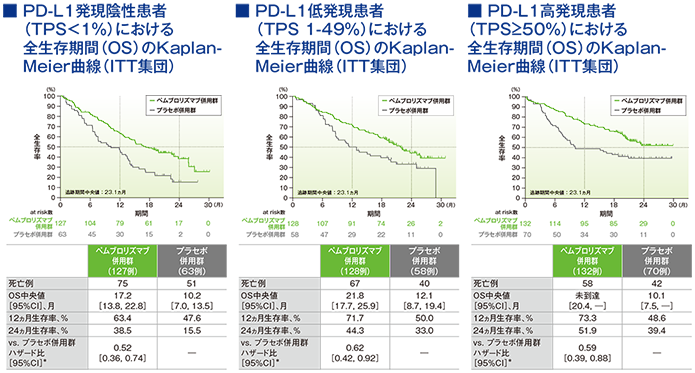
*PD-L1発現(≥1%、<1%)、プラチナ製剤(シスプラチン、カルボプラチン)、喫煙歴(喫煙歴なし、現喫煙者/喫煙歴あり)を層別因子とした層別Cox比例ハザードモデルに基づく
(追跡期間中央値:23.1ヵ月)
Reprinted with permission. © 2020 American Society of Clinical Oncology. All rights reserved.
Gadgeel S et al. J Clin Oncol 2020; 38(14): 1505-1517.
本試験はMSD社の資金提供により行われた。
主要評価項目 2年間フォローアップでの無増悪生存期間:PFS
無増悪生存期間(PFS)のKaplan-Meier曲線(ITT集団)
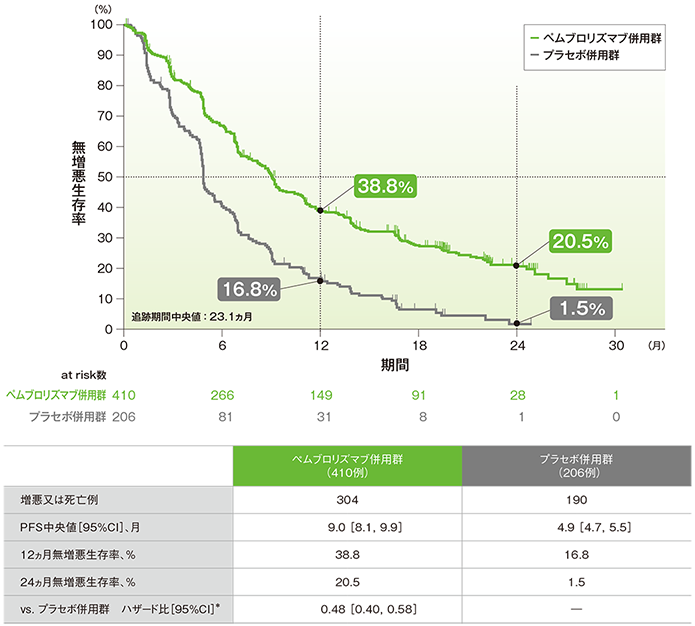
*PD-L1発現(≥1%、<1%)、プラチナ製剤(シスプラチン、カルボプラチン)、喫煙歴(喫煙歴なし、現喫煙者/喫煙歴あり)を層別因子とした層別Cox比例ハザードモデルに基づく
(追跡期間中央値:23.1ヵ月)
Reprinted with permission. © 2020 American Society of Clinical Oncology. All rights reserved.
Gadgeel S et al. J Clin Oncol 2020; 38(14): 1505-1517.
本試験はMSD社の資金提供により行われた。
- PFS中央値は、キイトルーダ®併用群で9.0ヵ月(95%CI:8.1, 9.9)、プラセボ併用群で4.9ヵ月(95%CI:4.7, 5.5)でした。
探索的評価項目(サブグループ解析)
2年間フォローアップでのPD-L1発現別にみた無増悪生存期間(PFS)
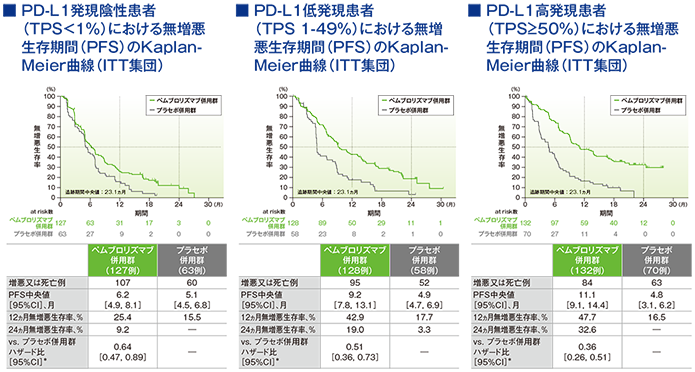
*PD-L1発現(≥1%、<1%)、プラチナ製剤(シスプラチン、カルボプラチン)、喫煙歴(喫煙歴なし、現喫煙者/喫煙歴あり)を層別因子とした層別Cox比例ハザードモデルに基づく
(追跡期間中央値:23.1ヵ月)
Reprinted with permission. © 2020 American Society of Clinical Oncology. All rights reserved.
Gadgeel S et al. J Clin Oncol 2020; 38(14): 1505-1517.
本試験はMSD社の資金提供により行われた。
探索的評価項目
2年間フォローアップでのランダム化割り付けから2次治療での病勢進行、又は死亡のいずれかが先に起こるまでの期間:PFS2
PFS2*1のKaplan-Meier曲線(ITT集団)
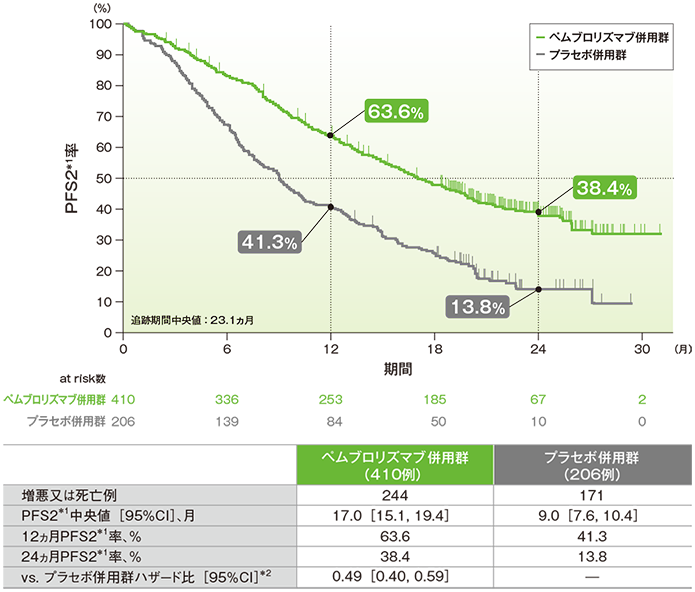
*1 ランダム化割り付けから2次治療での病勢進行、又は死亡のいずれかが先に起こるまでの期間
*2 PD-L1発現(≥1%、<1%)、プラチナ製剤(シスプラチン、カルボプラチン)、喫煙歴(喫煙歴なし、現喫煙者/喫煙歴あり)を層別因子とした層別Cox比例ハザードモデルに基づく
(追跡期間中央値:23.1ヵ月)
Reprinted with permission. © 2020 American Society of Clinical Oncology. All rights reserved.
Gadgeel S et al. J Clin Oncol 2020; 38(14): 1505-1517.
本試験はMSD社の資金提供により行われた。
- PFS2中央値は、キイトルーダ®併用群で17.0ヵ月(95%CI:15.1, 19.4)、プラセボ併用群で9.0ヵ月(95%CI:7.6, 10.4)でした。
2年間フォローアップでの脳転移の有無別にみた全生存期間:OS(サブグループ解析)
脳転移のある患者における全生存期間(OS)のKaplan-Meier曲線(ITT集団)
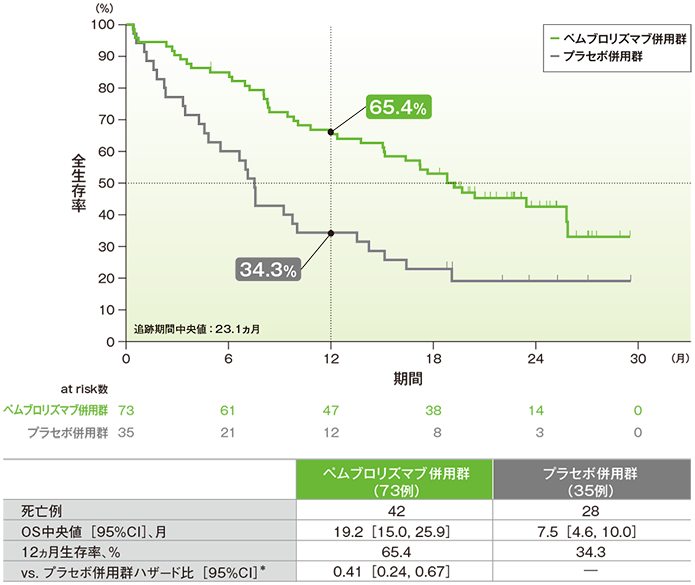
*PD-L1発現(≥1%、<1%)、プラチナ製剤(シスプラチン、カルボプラチン)、喫煙歴(喫煙歴なし、現喫煙者/喫煙歴あり)を層別因子とした層別Cox比例ハザードモデルに基づく
(追跡期間中央値:23.1ヵ月)
Adapted from Gadgeel S et al. J Clin Oncol 2020; 38(14): 1505-1517.
© 2020 American Society of Clinical Oncology. All rights reserved.
Readers are encouraged to read the entire article for the correct context at jco.ascopubs.org.
本試験はMSD社の資金提供により行われた。
- 脳転移のある患者におけるOS中央値は、キイトルーダ®併用群で19.2ヵ月(95%CI:15.0, 25.9)、プラセボ併用群で7.5ヵ月(95%CI:4.6, 10.0)でした。
脳転移のない患者における全生存期間(OS)のKaplan-Meier曲線(ITT集団)
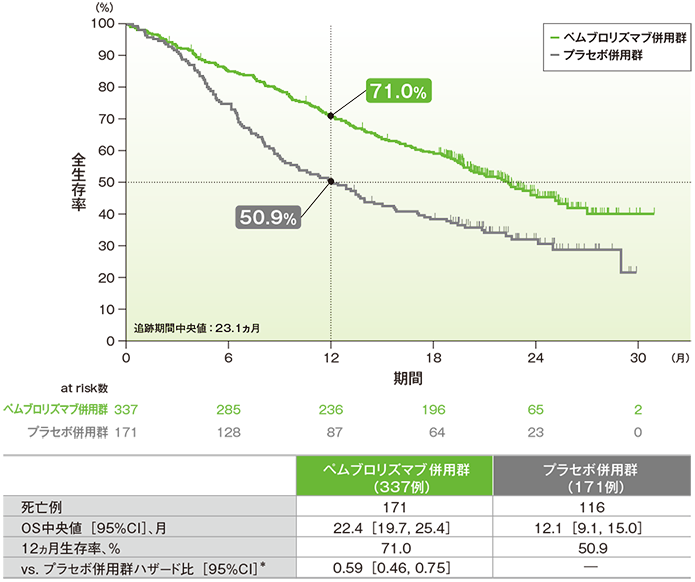
*PD-L1発現(≥1%、<1%)、プラチナ製剤(シスプラチン、カルボプラチン)、喫煙歴(喫煙歴なし、現喫煙者/喫煙歴あり)を層別因子とした層別Cox比例ハザードモデルに基づく
(追跡期間中央値:23.1ヵ月)
Adapted from Gadgeel S et al. J Clin Oncol 2020; 38(14): 1505-1517.
© 2020 American Society of Clinical Oncology. All rights reserved.
Readers are encouraged to read the entire article for the correct context at jco.ascopubs.org.
本試験はMSD社の資金提供により行われた。
- 脳転移のない患者におけるOS中央値は、キイトルーダ®併用群で22.4ヵ月(95%CI:19.7, 25.4)、プラセボ併用群で12.1ヵ月(95%CI:9.1, 15.0)でした。
副次評価項目 2年間フォローアップでの奏効率:ORR
奏効率(ORR)の要約(ITT集団)
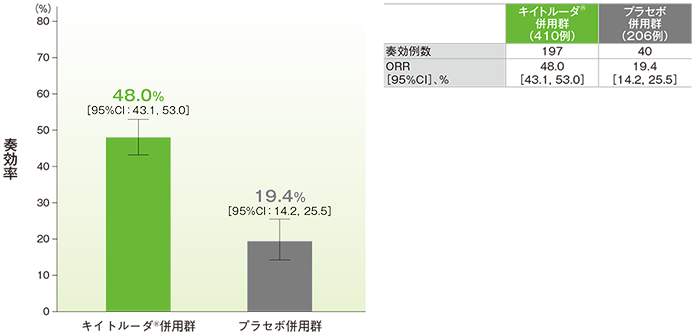
(追跡期間中央値:23.1ヵ月)
Gadgeel S et al. J Clin Oncol 2020; 38: 1505-1517
本試験はMSD社の資金提供により行われた。
- ORRは、キイトルーダ®併用群で48.0%(95%CI:43.1, 53.0)、プラセボ併用群で19.4%(95%CI:14.2, 25.5)でした。
探索的評価項目(サブクループ解析)
2年間フォローアップでのPD-L1発現別にみた奏効率:ORR
PD-L1発現別の奏効率(ORR)の要約(ITT集団)
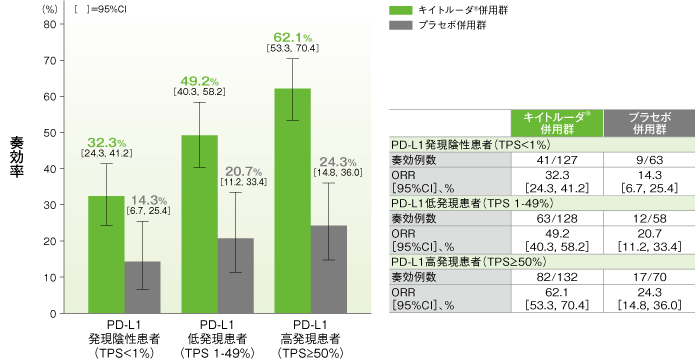
(追跡期間中央値:23.1ヵ月)
Gadgeel S et al. J Clin Oncol 2020; 38: 1505-1517
本試験はMSD社の資金提供により行われた。
副次評価項目 2年間フォローアップでの奏効期間:DOR
奏効期間(DOR)の要約(ITT集団)

*1 product-limi(t Kaplan-Meier)法に基づく
*2 「+」は最後の疾患評価からPDがみられないことを示す
(追跡期間中央値:23.1ヵ月)
Gadgeel S et al. J Clin Oncol 2020; 38: 1505-1517
本試験はMSD社の資金提供により行われた。
- DOR中央値は、キイトルーダ®併用群で12.4ヵ月(範囲:1.1+, 29.0+)、プラセボ併用群で7.1ヵ月(範囲:2.4, 22.0+)でした。
安全性(2年間フォローアップ)
(データカットオフ日:2018年9月21日)
【キイトルーダ®併用群】
【有害事象】
キイトルーダ®併用群:404/405例(99.8%)
プラセボ併用群:200/202例(99.0%)
【いずれか又はすべての試験薬の投与中止に至った有害事象】
キイトルーダ®併用群:136例(33.6%)
プラセボ併用群:33例(16.3%)
【死亡に至った有害事象】
キイトルーダ®併用群:29例(7.2%)
プラセボ併用群:14例(6.9%)
【死亡に至った副作用】
キイトルーダ®併用群:8例(2.0%)
プラセボ併用群:2例
*重篤な有害事象、有害事象による投与中止及び有害事象による死亡の内訳は論文中に記載なし
Gadgeel S et al. J Clin Oncol 2020; 38: 1505-1517
本試験はMSD社の資金提供により行われた。
有害事象及び免疫関連など特に注目すべき有害事象一覧
(データカットオフ日:2018年9月21日)
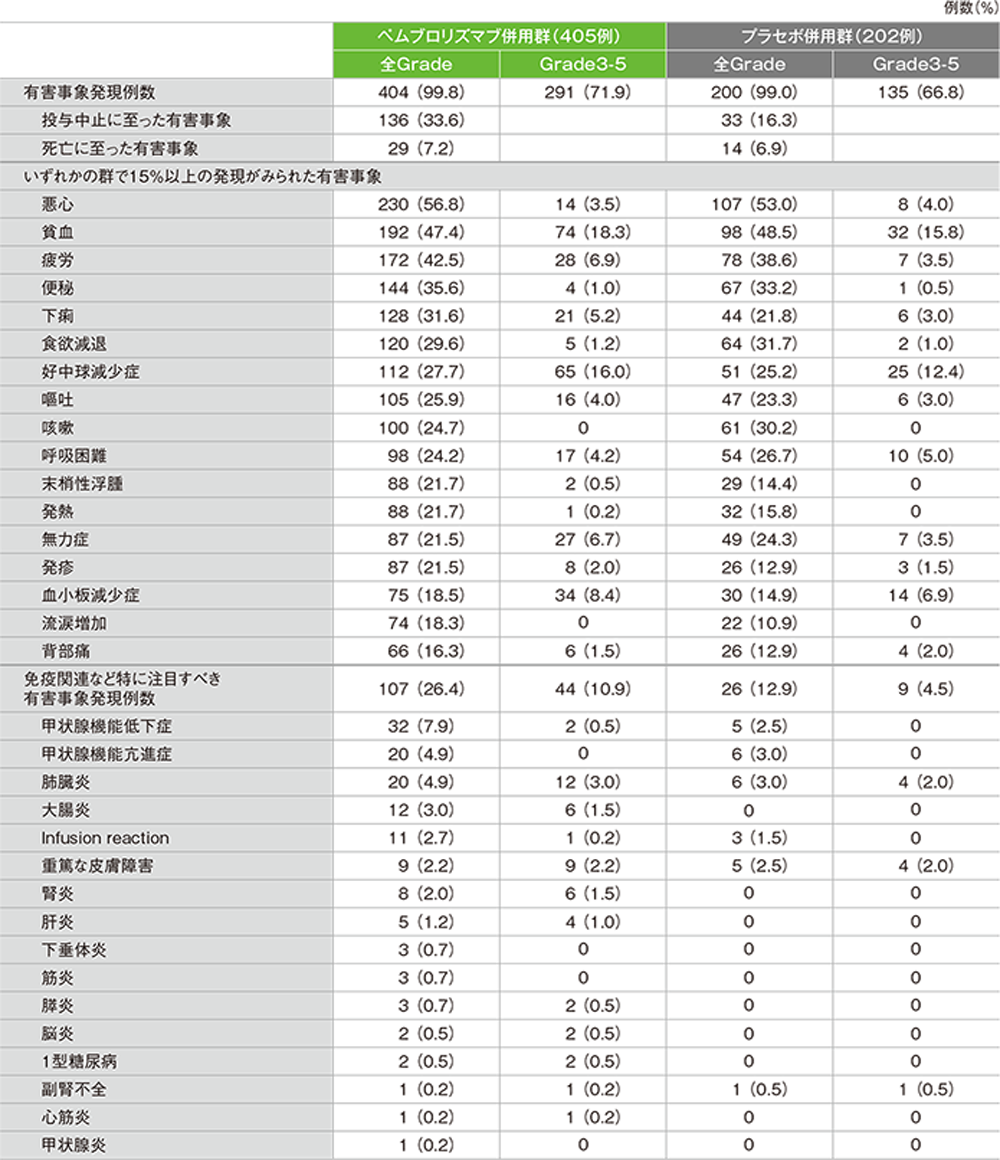
GradeはCTCAE version 4.0
Reprinted with permission. © 2020 American Society of Clinical Oncology. All rights reserved.
Gadgeel S et al. J Clin Oncol 2020; 38(14): 1505-1517.
本試験はMSD社の資金提供により行われた。