KEYNOTE-010試験
本剤は、一部承認外の効能又は効果、用法及び用量による臨床試験の成績も含めた臨床データパッケージで評価され、承認されました。
そのため、国内で承認されている効能又は効果と異なる海外データも紹介しています。
非小細胞肺癌:国際共同臨床試験成績:化学療法既治療患者を対象とした試験:国際共同第Ⅱ/Ⅲ相試験<KEYNOTE-010試験>
承認時評価資料:国際共同第Ⅱ/Ⅲ相試験(KEYNOTE-010試験)
Herbst RS et al. Lancet 2016; 387: 1540-1550
Herbst RS et al. Lancet 2016; 387: 1540-1550 Supplementary appendix
Herbst RS et al. J Clin Oncol 2020; 38: 1580-1590
Herbst RS et al. J Thorac Oncol 2021; 16: 1718-1732
本試験はMSD社の資金提供により行われた。Roy S HerbstはMSD社から顧問料を受領している。また、著者のうち、Gregory M Lubiniecki、Yue Shentu、Ellie Im、Marisa Dolled-Filhartは同社の社員である。その他の著者にMSD社より講演料、顧問料などを受領している者が含まれる。3年間フォローアップ解析報告では、Roy S HerbstはMSD社から顧問料を受領している。また、著者のうち、Ayman Samkari、Erin H. Jensen、Gregory M. Lubinieckiは同社の社員である。その他の著者にMSD社より講演料、顧問料などを受領している者が含まれる。5年間フォローアップ解析報告では、Roy S HerbstはMSD社から顧問料を受領している。また、著者のうち、Erin H. Jensen、Ayman Samkari、Julie Kobie、Bilal Piperdiは同社の社員である。その他の著者にMSD社より講演料、顧問料などを受領している者が含まれる。
試験概要
【目的】PD-L1発現陽性*1の切除不能な進行・再発の非小細胞肺癌患者におけるキイトルーダ®、ドセタキセルの3週間間隔投与による有効性及び安全性を比較検討する。
【デザイン】国際共同無作為化第Ⅱ/Ⅲ相試験[優越性試験][第2回中間解析結果(データカットオフ日:2015年9月30日)][3年間フォローアップ解析結果(データカットオフ日:2018年3月16日)][5年間フォローアップ解析結果(データカットオフ日:2020年4月8日)]
【対象】プラチナ製剤併用化学療法の施行後に病勢進行(PD)が認められたPD-L1発現陽性非小細胞肺癌患者1,033例(日本人91例を含む)
主な組み入れ基準は、プラチナ製剤併用化学療法による治療歴に加え、それぞれEGFR阻害作用又はALK阻害作用を有する抗悪性腫瘍剤による治療歴を有する患者とした。
【方法】キイトルーダ®2mg/kg群、キイトルーダ®10mg/kg群(それぞれキイトルーダ®2mg/kg、10mg/kgを3週間間隔で点滴静注)又はドセタキセル群(ドセタキセル75mg/m2を3週間間隔で点滴静注)に1:1:1の割合で無作為割り付けした。
9週ごとに画像診断により腫瘍縮小効果を判定し、PD、許容できない有害事象の発現等による投与中止まで、最長2年間投与を継続した。
プロトコール改訂により、ドセタキセル群に割り付けられた患者がドセタキセル投与後又は後治療後にPDと判定された場合、キイトルーダ®(200mg 3週間間隔のみ)の投与を受けられることになった。
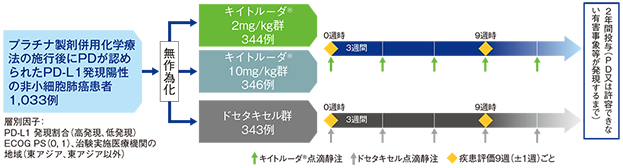
【評価項目】主要評価項目:PD-L1高発現患者*2及びPD-L1発現陽性患者における全生存期間(overall survival;OS)※1及び無増悪生存期間(progression-free survival;PFS)※1、※2、安全性
副次評価項目:PD-L1高発現患者及びPD-L1発現陽性患者における奏効率(overall response rate;ORR)※2、奏効期間(duration of response;DOR)※2
探索的評価項目:PD-L1高発現患者及びPD-L1発現陽性患者におけるキイトルーダ®2mg/kg群とキイトルーダ®10mg/kg群の併合群のOS及びPFS
※1 第2回中間解析の検証的解析項目 ※2 RECISTガイドライン1.1版に基づく評価
【判定基準】PFS、ORR、DORは、独立判定委員会(IRC)がRECISTガイドライン1.1版に基づき盲検下で評価した。また、免疫療法のための治療効果判定基準(irRC)を用いて治験担当医師が評価した。
【解析計画】解析対象集団:PD-L1高発現患者及びPD-L1発現陽性患者の有効性を評価した。有効性の解析はITT集団*3、安全性の解析はAPaT集団*4を対象として実施した。
有効性評価の統計手法:OS、PFSはKaplan-Meier法を用いて推定し、群間比較には層別ログランク検定を用いた。OS、PFSの投与群を共変量とし、ハザード比(HR)及び95%信頼区間(95%CI)を層別Cox比例ハザードモデルを用い算出した。キイトルーダ®併合群のOS、PFSも同じように算出した。ORRの群間比較には、層別Miettinen and Nurminen法を用いた。DORはKaplan-Meier法による中央値と四分位点法を用いて記述的に要約した。
また、サブグループ解析として、PD-L1発現状況(高発現、低発現)、ベースライン ECOG PS(0、1)、治験実施医療機関の地域(東アジア、東アジア以外)の層別因子に加え、性別(男性、女性)、年齢(<65歳、≧65歳)、人種(白人、白人以外)、地域性(東アジア、東アジア以外)、腫瘍組織検体の状態(保存、新規)、EGFR遺伝子(変異型、野生型)、ALK遺伝子(野生型)などの背景因子別に、層別Cox比例ハザードモデルを用いて、キイトルーダ®2mg/kg群とキイトルーダ®10mg/kg群の併合群による解析も含めて、OSとPFSの部分集団解析を実施した。
多重性の調整:本試験は2回の中間解析を事前に計画し、試験全体の有意水準を片側2.5%とした。1回目の中間解析では、ORRを検定することとし、2回目の中間解析及び最終解析では、OS、PFSの解析を検討することとした。
第2回中間解析で、PFS、OSをそれぞれPD-L1高発現患者→PD-L1発現陽性患者の順で検定を実施することとした。最終解析では、PFS(PD-L1高発現患者→PD-L1発現陽性患者の順)→OS(PD-L1高発現患者とPD-L1発現陽性患者の順)で検定を実施することとした。解析時点、評価項目(PFS、OS)、キイトルーダ®の2群、解析集団(PD-L1高発現患者、PD-L1発現陽性患者)間の多重性を、事前に規定した多重性の調整方法(Hochbergのstep-up法、gate-keeping法、Bonferroni法)により調整した。
事前に規定された解析結果とともに、3年間フォローアップ解析(データカットオフ日:2018年3月16日)、5年間フォローアップ解析(データカットオフ日:2020年4月8日)から得られた有効性及び安全性の結果を示す。
*1 腫瘍細胞のうちPD-L1発現陽性細胞の割合が1%以上(TPS: tumor proportion score≧1%)
*2 腫瘍細胞のうちPD-L1発現陽性細胞の割合が50%以上(TPS≧50%)
PD-L1の発現はPD-L1 IHC 22C3 pharmDx「ダコ」の試作キットを用いて検査された。
*3 ITT(intention to treat)集団:無作為化したすべての患者
*4 APaT(all patients as treated)集団:無作為化され、治験薬が1回以上投与されたすべての患者
4. 効能又は効果(抜粋)
切除不能な進行・再発の非小細胞肺癌
5. 効能又は効果に関連する注意(抜粋)
〈切除不能な進行・再発の非小細胞肺癌〉
5.2 本剤の術後補助療法における有効性及び安全性は確立していない。
5.3 本剤を単独で投与する場合には、PD-L1の発現が確認された患者に投与すること。PD-L1を発現した腫瘍細胞が占める割合(TPS)について、「17. 臨床成績」の項の内容を熟知すること。十分な経験を有する病理医又は検査施設において、承認された体外診断用医薬品又は医療機器を用いること。なお、承認された体外診断用医薬品又は医療機器に関する情報については、以下のウェブサイトから入手可能である:
https://www.pmda.go.jp/review-services/drug-reviews/review-information/cd/0001.html[17.1.8-17.1.10参照]
5.4 臨床試験に組み入れられた患者のEGFR遺伝子変異又はALK融合遺伝子の有無等について、「17. 臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。
[17.1.6、17.1.8-17.1.10参照]
6. 用法及び用量(抜粋)
〈切除不能な進行・再発の非小細胞肺癌〉
通常、成人には、ペムブロリズマブ(遺伝子組換え)として、1回200mgを3週間間隔又は1回400mgを6週間間隔で30分間かけて点滴静注する。
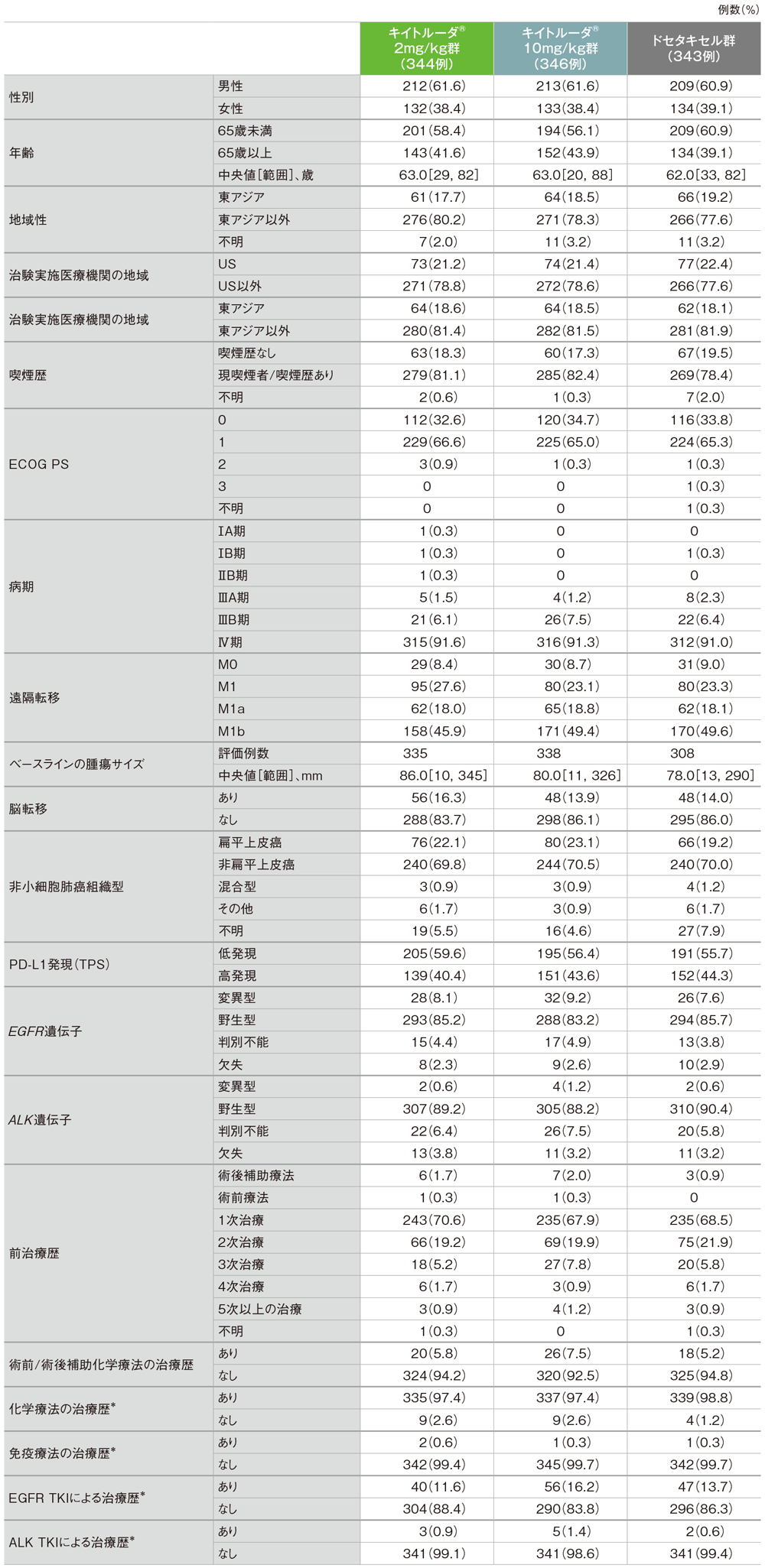
患者背景(ITT集団)
*全身療法として
治験薬中止後の治療
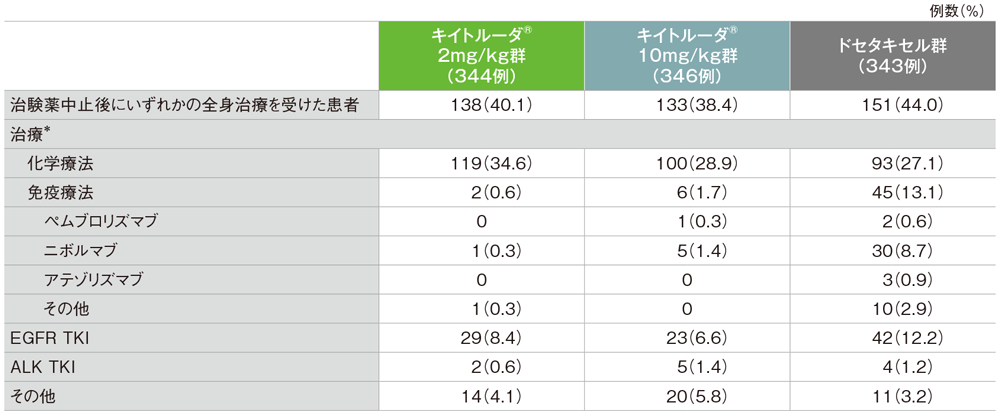
*1つ以上の補助的な治療が行われた可能性がある
Herbst RS et al. Lancet 2016; 387: 1540-1550 Supplementary appendix
本試験はMSD社の資金提供により行われた。
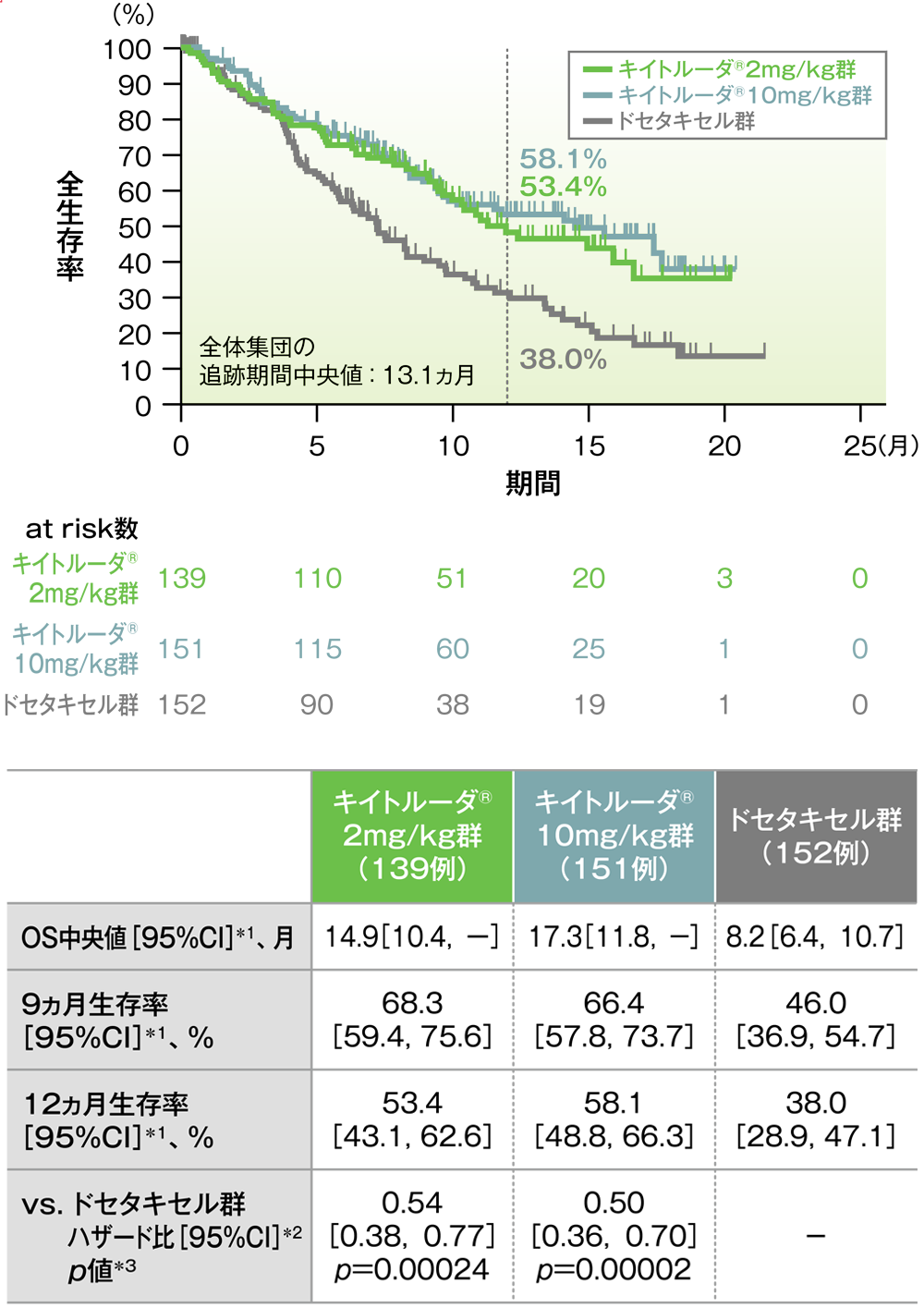
全生存期間:OS
主要評価項目(優越性試験) PD-L1高発現患者(TPS≧50%)における全生存期間:OS
PD-L1高発現患者における全生存期間(OS)のKaplan-Meier曲線(ITT集団)
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、ECOG PS(0, 1)、治験実施医療機関の地域(東アジア、東アジア以外)、PD-L1発現(高発現、低発現、不明)を層別因子(無作為化に用いた層別因子)とした層別Cox比例ハザードモデルに基づく
*3 層別ログランク検定[片側](層別因子は無作為化に用いた層別因子)、有意水準α=0.004125
(追跡期間中央値:13.1ヵ月)(データカットオフ日:2015年9月30日)
- OS中央値は、キイトルーダ®2mg/kg群14.9ヵ月(95%CI:10.4,未到達)、キイトルーダ®10mg/kg群17.3ヵ月(95%CI:11.8,未到達)、ドセタキセル群8.2ヵ月(95%CI:6.4,10.7)でした。ドセタキセル群に対するキイトルーダ®2mg/kg群及び10mg/kg群のハザード比は、0.54(95%CI:0.38,0.77)及び0.50(95%CI:0.36,0.7)で、いずれもOSを有意に延長することが検証されました(p=0.00024及びp=0.00002、層別ログランク検定[片側]、有意水準α=0.004125;検証的解析結果)。
PD-L1高発現患者(TPS≧50%)における部分集団因子別の全生存期間:OS(サブグループ解析)
全生存期間(OS)のハザード比のフォレストプロット
(キイトルーダ®併合群*1とドセタキセル群の比較、ITT集団)
*1 キイトルーダ®2mg/kg群とキイトルーダ®10mg/kg群の併合群
*2 投与群を共変量とし、ECOG PS(0, 1)、治験実施医療機関の地域(東アジア、東アジア以外)、PD-L1発現(高発現、低発現、不明)を層別因子とした層別Cox比例ハザードモデルに基づく
(全体集団の追跡期間中央値:13.1ヵ月)(データカットオフ日:2015年9月30日)
- 事前に規定されたOSの部分集団解析の結果を示します。
主要評価項目(優越性試験) PD-L1発現陽性患者(TPS≧1%)における全生存期間:OS
PD-L1発現陽性患者における全生存期間(OS)のKaplan-Meier曲線(ITT集団)
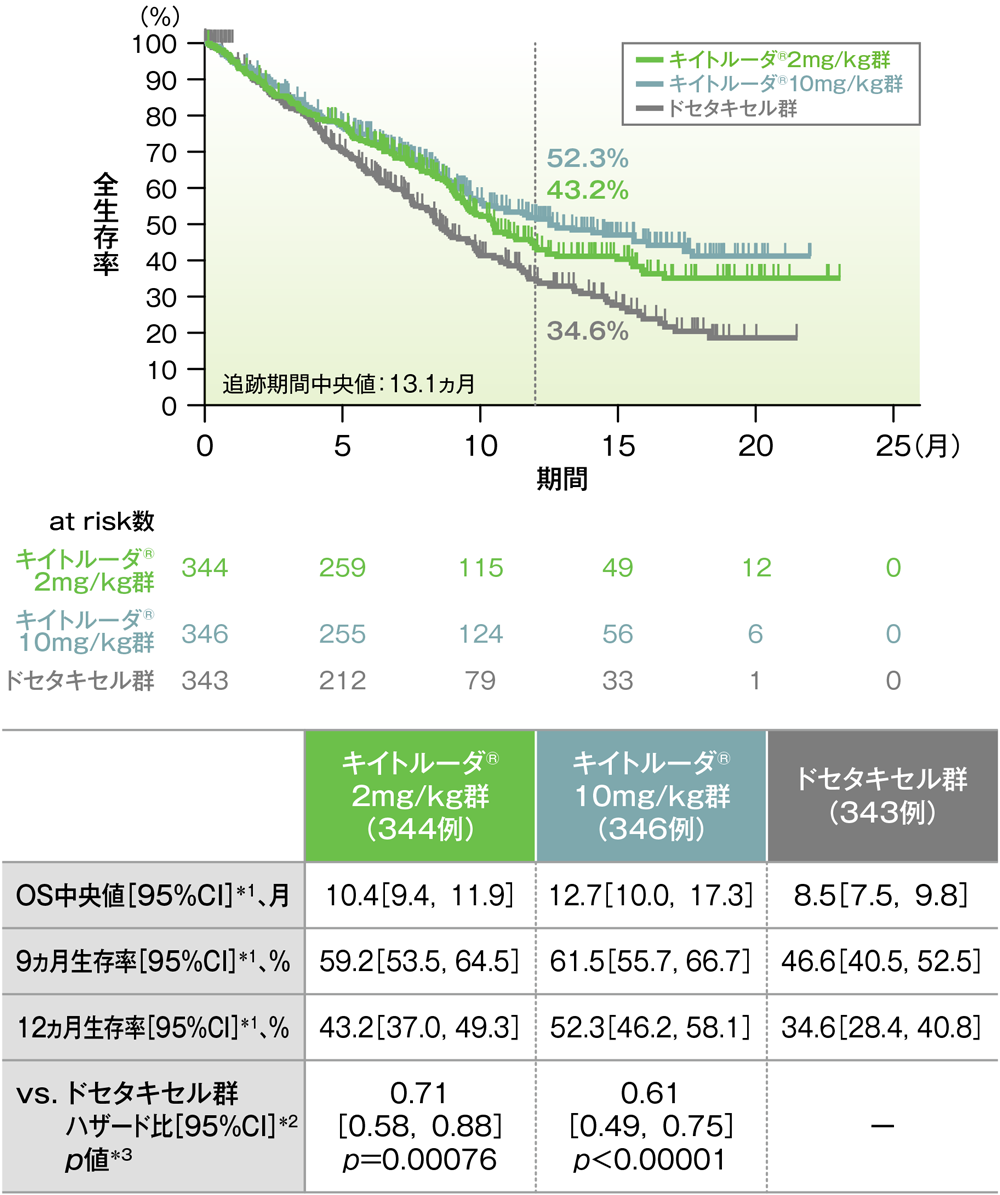
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、ECOG PS(0, 1)、治験実施医療機関の地域(東アジア、東アジア以外)、PD-L1発現(高発現、低発現、不明)を層別因子(無作為化に用いた層別因子)とした層別Cox比例ハザードモデルに基づく
*3 層別ログランク検定[片側](層別因子は無作為化に用いた層別因子)、有意水準α=0.004125
(データカットオフ日:2015年9月30日)
- OS中央値は、キイトルーダ®2mg/kg群10.4ヵ月(95%CI:9.4,11.9)、キイトルーダ®10mg/kg群12.7ヵ月(95%CI:10.0,17.3)、ドセタキセル群8.5ヵ月(95%CI:7.5,9.8)でした。ドセタキセル群に対するキイトルーダ®2mg/kg群及び10mg/kg群のハザード比は0.71(95%CI:0.58,0.88)及び0.61(95%CI:0.49,0.75)で、いずれもOSを有意に延長することが検証されました(p=0.00076及びp<0.00001、層別ログランク検定[片側]、有意水準α=0.004125;検証的解析結果)。
PD-L1発現陽性患者(TPS≧1%)における部分集団因子別の全生存期間:OS(サブグループ解析)
全生存期間(OS)のハザード比のフォレストプロット
(キイトルーダ®併合群*1とドセタキセル群の比較、ITT集団)
*1 キイトルーダ®2mg/kg群とキイトルーダ®10mg/kg群の併合群
*2 投与群を共変量とし、ECOG PS(0, 1)、治験実施医療機関の地域(東アジア、東アジア以外)、PD-L1発現(高発現、低発現、不明)を層別因子とした層別Cox比例ハザードモデルに基づく
(追跡期間中央値:13.1ヵ月)(データカットオフ日:2015年9月30日)
- 事前に規定されたOSの部分集団解析の結果を示します。
主要評価項目(優越性試験)PD-L1高発現患者(TPS≧50%)における無増悪生存率:PFS
PD-L1高発現患者における無増悪生存率(PFS)のKaplan-Meier曲線(ITT集団)
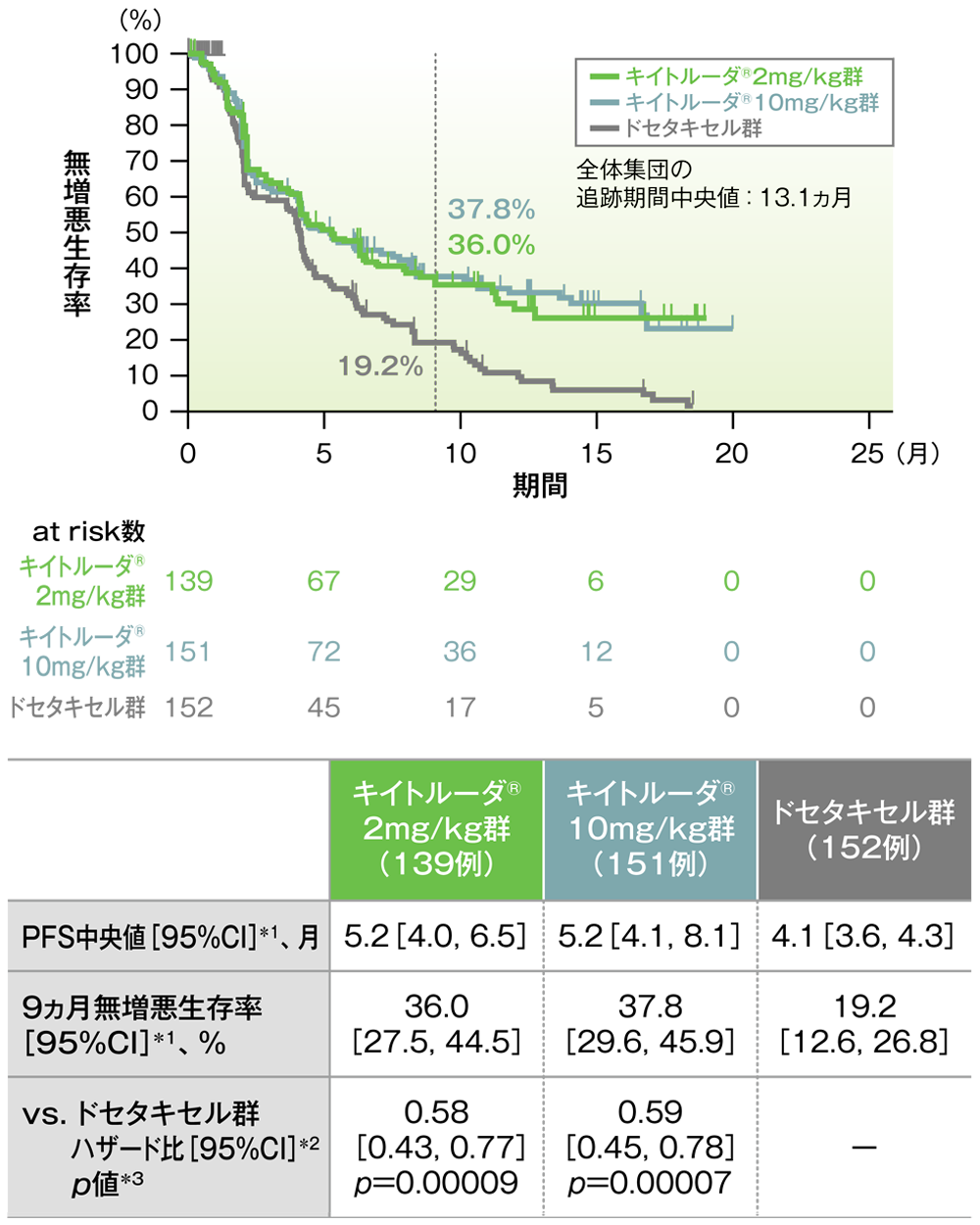
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、ECOG PS(0,1)、治験実施医療機関の地域(東アジア、東アジア以外)、PD-L1発現(高発現、低発現、不明)を層別因子(無作為化に用いた層別因子)とした層別Cox比例ハザードモデルに基づく
*3 層別ログランク検定[片側](層別因子は無作為化に用いた層別因子)、有意水準α=0.0005
(データカットオフ日:2015年9月30日)
- PD-L1高発現患者において、キイトルーダ®2mg/kg群及び10mg/kg群のドセタキセル群に対するハザード比は0.58(95%CI:0.43, 0.77)及び0.59(95%CI:0.45, 0.78)で、いずれもPFSを有意に延長することが検証されました(p=0.00009及びp =0.00007、層別ログランク検定[片側]、有意水準α=0.0005;検証的解析結果)。
主要評価項目(優越性試験)PD-L1発現陽性患者(TPS≧1%)における無増悪生存率:PFS
PD-L1発現陽性患者における無増悪生存率(PFS)のKaplan-Meier曲線(ITT集団)
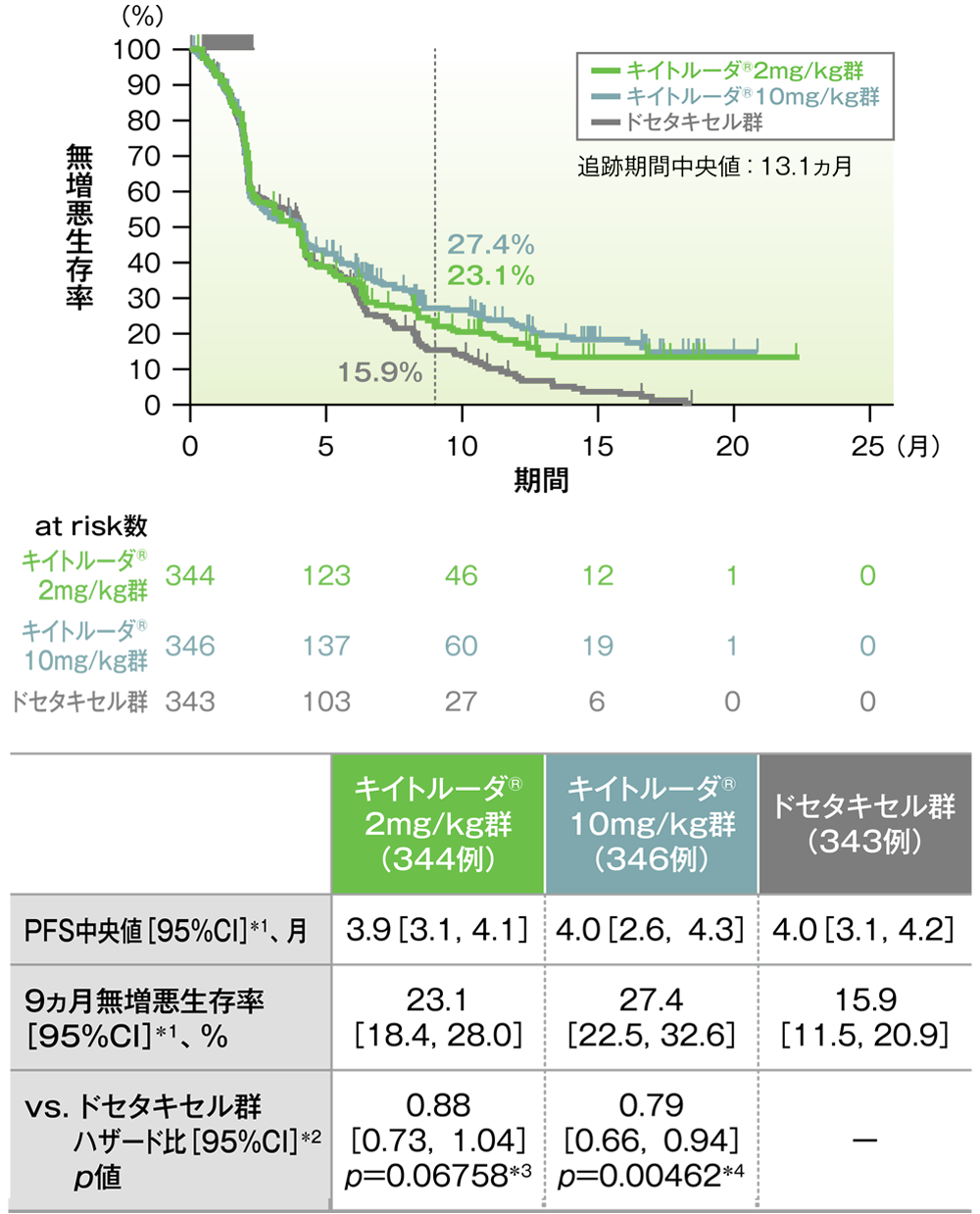
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、ECOG PS(0,1)、治験実施医療機関の地域(東アジア、東アジア以外)、PD-L1発現(高発現、低発現、不明)を層別因子(無作為化に用いた層別因子)とした層別Cox比例ハザードモデルに基づく
*3 層別ログランク検定[片側] (層別因子は無作為化に用いた層別因子)、有意水準α=0.001
*4 層別ログランク検定[片側] (層別因子は無作為化に用いた層別因子)、有意水準α=0.0005
(データカットオフ日:2015年9月30日)
- PD-L1発現陽性患者において、キイトルーダ®2mg/kg群及び10mg/kg群のドセタキセル群に対するハザード比は0.88(95%CI:0.73, 1.04)及び0.79(95%CI:0.66, 0.94)であり、優越性は検証されませんでした(検証的解析結果)。
副次評価項目 奏効率:ORR
PD-L1高発現患者(TPS≧50%)における奏効率(ORR)
PD-L1高発現患者における奏効率(ORR)の要約(ITT集団)
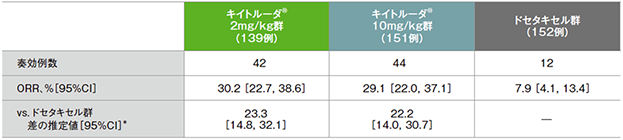
*ECOG PS(0, 1)、治験実施医療機関の地域(東アジア、東アジア以外)、PD-L1発現(高発現、低発現、不明)を層別因子とした層別Miettinen and Nurminen法に基づく
(全体集団の追跡期間中央値:13.1ヵ月)(データカットオフ日:2015年9月30日)
- ORRは、キイトルーダ®2mg/kg群30.2%(95%CI:22.7,38.6)、キイトルーダ®10mg/kg群29.1%(95%CI:22.0,37.1)、ドセタキセル群7.9%(95%CI:4.1,13.4)でした。
PD-L1発現陽性患者(TPS≧1%)における奏効率(ORR)
PD-L1発現陽性患者における奏効率(ORR)の要約(ITT集団)
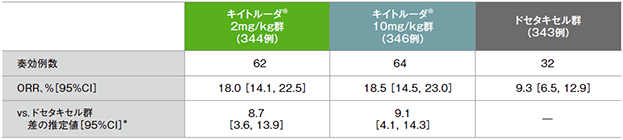
*ECOG PS(0, 1)、治験実施医療機関の地域(東アジア、東アジア以外)、PD-L1発現(高発現、低発現、不明)を層別因子とした層別Miettinen and Nurminen法に基づく
(追跡期間中央値:13.1ヵ月)(データカットオフ日:2015年9月30日)
- ORRは、キイトルーダ®2mg/kg群18.0%(95%CI:14.1,22.5)、キイトルーダ®10mg/kg群18.5%(95%CI:14.5,23.0)、ドセタキセル群9.3%(95%CI:6.5,12.9)でした。
副次評価項目 奏効期間:DOR
PD-L1高発現患者(TPS≧50%)における奏効期間(DOR)
PD-L1高発現患者における奏効期間(DOR)の要約(ITT集団)
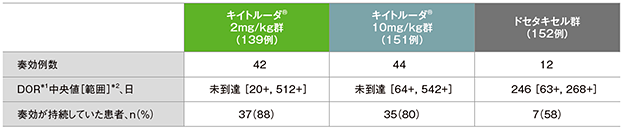
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 「+」は最後の疾患評価までPDがみられないことを示す
(全体集団の追跡期間中央値:13.1ヵ月)(データカットオフ日:2015年9月30日)
- RECISTガイドライン1.1版を用いたIRC評価に基づく奏効が認められた患者におけるDOR中央値は、キイトルーダ®2mg/kg群では未到達(範囲:20+,512+)、キイトルーダ®10mg/kg群では未到達(範囲:64+,542+)、ドセタキセル群では246日(63+, 268+)でした。また、奏効が認められた患者のうち、最終解析時点で奏効が持続していた患者数は、キイトルーダ®2mg/kg群37例(88%)、キイトルーダ®10mg/kg群35例(80%)、ドセタキセル群7例(58%)でした。
PD-L1発現陽性患者(TPS≧1%)における奏効期間(DOR)
PD-L1発現陽性患者における奏効期間(DOR)の要約(ITT集団)
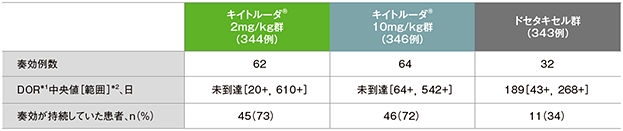
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 「+」は最後の疾患評価までPDがみられないことを示す
(全体集団の追跡期間中央値:13.1ヵ月)(データカットオフ日:2015年9月30日)
- RECISTガイドライン1.1版を用いたIRC評価に基づく奏効が認められた患者におけるDOR中央値は、キイトルーダ®2mg/kg群では未到達(範囲:20+,610+)、キイトルーダ®10mg/kg群では未到達(範囲:64+,542+)、ドセタキセル群では189日(43+,268+)でした。また、奏効が認められた患者のうち、最終解析時点で奏効が持続していた患者数は、キイトルーダ®2mg/kg群45例(73%)、キイトルーダ®10mg/kg群46例(72%)、ドセタキセル群11例(34%)でした。
安全性(主要評価項目)
キイトルーダ®2mg/kg群で副作用は215/339例(63.4%)に認められましたが、主な副作用(発現率10%以上)は、疲労、食欲減退各46例(13.6%)、悪心37例(10.9%)でした。副作用による中止は15例(4.4%)で、その内訳は肺臓炎6例(1.8%)、疲労、肺炎、アスパラギン酸アミノトランスフェラーゼ増加、関節炎、筋壊死、運動失調、脳血管発作、中毒性白質脳症、尿細管間質性腎炎各1例(0.3%)でした。副作用による死亡は肺臓炎2例(0.6%)、肺炎1例(0.3%)でした。
キイトルーダ®10mg/kg群で副作用は226/343例(65.9%)に認められました。主な副作用(発現率10%以上)は、疲労49例(14.3%)、発疹44例(12.8%)でした。副作用による中止は17例(5.0%)で、その内訳は肺臓炎6例(1.7%)、完全房室ブロック、甲状腺機能低下症、胃炎、化学性肺炎、低ナトリウム血症、悪性新生物進行、横断性脊髄炎、失見当識、呼吸困難、低酸素症、扁平苔癬、末梢性虚血各1例(0.3%)でした。副作用による死亡は心筋梗塞、肺炎、肺臓炎各1例(0.3%)でした。
重篤な副作用はキイトルーダ®併合群で71/682例(10.4%)に認められ、2例以上にみられた重篤な副作用は、肺臓炎15例(2.2%)、肺炎6例(0.9%)、大腸炎3例(0.4%)、甲状腺機能亢進症、甲状腺機能低下症、下垂体機能低下症、疲労、自己免疫性肝炎、化学性肺炎、低ナトリウム血症、1型糖尿病、呼吸困難、胸水各2例(0.3%)でした。
ドセタキセル群で副作用は251/309例(81.2%)に認められました。主な副作用(発現率10%以上)は、脱毛症101例(32.7%)、疲労76例(24.6%)、下痢56例(18.1%)、食欲減退49例(15.9%)、悪心45例(14.6%)、好中球減少症44例(14.2%)、口内炎43例(13.9%)、貧血40例(12.9%)、無力症35例(11.3%)でした。重篤な副作用は42例(13.6%)に認められ、2例以上にみられた重篤な副作用は、発熱性好中球減少症10例(3.2%)、好中球減少症、肺炎各4例(1.3%)、上気道感染、脱水、呼吸困難各3例(1.0%)、下痢、胸水、肺臓炎各2例(0.6%)でした。副作用による中止は31例(10.0%)で、その内訳は無力症、肺臓炎各3例(1.0%)、多発ニューロパチー、間質性肺疾患各2例(0.6%)、血小板減少症、動脈硬化冠動脈、流涙増加、大腸炎虚血、胃腸炎、口内炎、医薬品副作用、疲労、浮腫、帯状疱疹、肺炎、気道感染、敗血症ショック、種々の薬剤に対する毒性、筋肉痛、認知障害、末梢性ニューロパチー、末梢性感覚ニューロパチー、胸水、脱毛症、爪甲離床症、発疹各1例(0.3%)でした。副作用による死亡は脱水、気道感染、発熱性好中球減少症、間質性肺疾患、急性心不全各1例(0.3%)でした。
副作用(いずれかの投与群で発現率5%以上)(APaT集団)
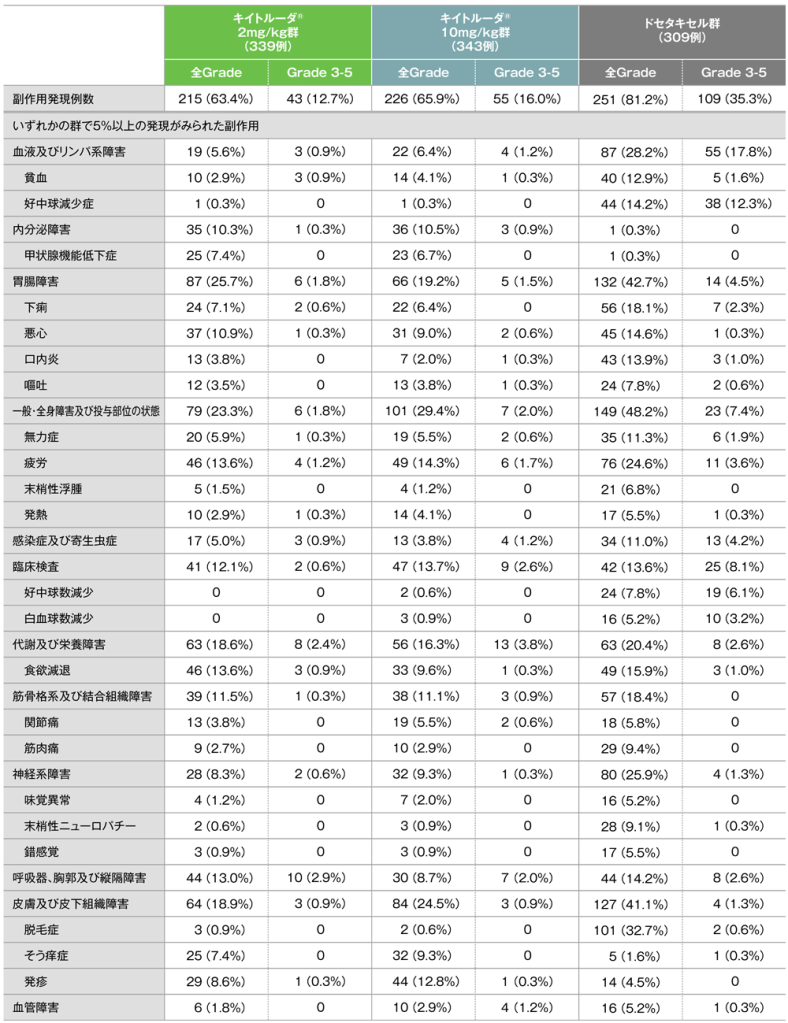
MedDRA/J version 18.0、Grade はCTCAE version 4.0(データカットオフ日:2015年9月30日)
免疫関連など特に注目すべき有害事象
免疫関連など特に注目すべき有害事象一覧(キイトルーダ®投与群で発現2例以上)†(APaT集団)
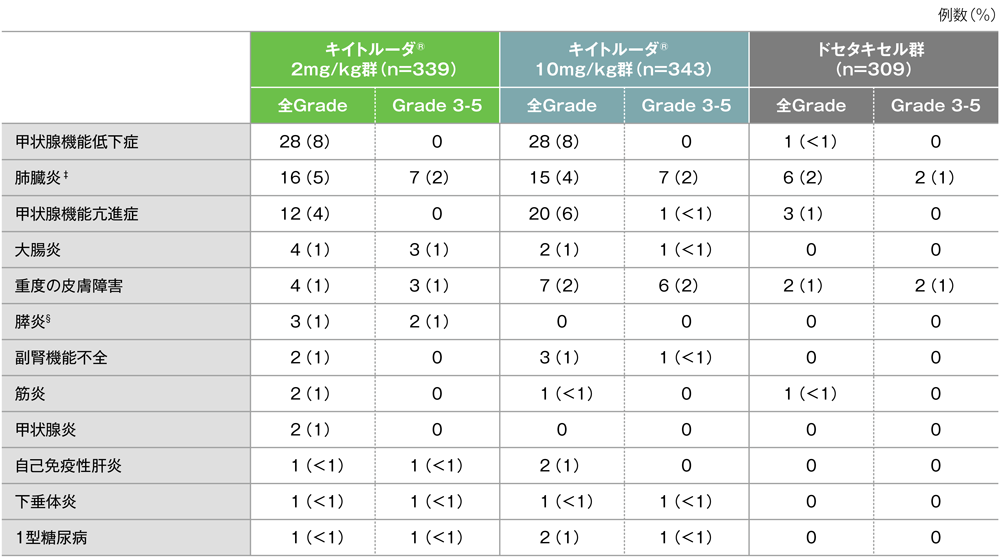
MedDRA/J version 18.0、Grade はCTCAE version 4.0(データカットオフ日:2015年9月30日)
担当医師による評価
†被験薬との因果関係によらない。事象は、キイトルーダ®2mg/kg Q3W群の発現頻度順に表示
‡間質性肺疾患の患者を含む(キイトルーダ®2mg/kg Q3W群:1例、キイトルーダ®10mg/kg Q3W群:2例、ドセタキセル群:2例)
§ 急性膵炎の1例を含む