KEYNOTE-024試験
非小細胞肺癌:国際共同臨床試験成績:化学療法未治療患者を対象とした単剤試験: 国際共同第Ⅲ相試験<KEYNOTE-024試験>
承認時評価資料:国際共同第Ⅲ相試験(KEYNOTE-024試験)
Reck M et al. N Engl J Med 2016; 375: 1823-1833
Reck M et al. N Engl J Med 2016; 375: 1823-1833 Supplementary Data(Protocol)
Reck M et al. J Clin Oncol 2019; 37: 537-546
Brahmer JR et al. Lancet Oncol 2017; 18: 1600-1609
Reck M et al. J Clin Oncol 2021; 39: 2339-2349
Satouchi M et al. Cancer Sci 2021; 112: 5000-5010
本試験はMSD社の資金提供により行われた。Martin ReckはMSD社から顧問料などを受領している。また、著者のうち、Melanie A Leiby、Gregory M Lubiniecki、Yue Shentu、Reshma Rangwalaは同社の社員である。その他の著者にMSD社より講演料、顧問料などを受領している者が含まれる。2年間フォローアップ解析報告の著者のうち、Delvys Rodríguez-Abreu、Andrea Fülöp、Nir Peled、Sinead Cuffe、Mary O’Brien、Suman Rao、Katsuyuki Hotta、Julie R. Brahmerは同社から顧問料、講演料などを受領している。Kristel Vandormael、Antonio Riccio、Jing Yang、M. Catherine Pietanzaは同社の社員である。5年間フォローアップ解析報告の著者のうち、Martin Reck、Delvys Rodríguez-Abreu、Andrew G Robinson、Rina Hui、Andrea Fülöp、Nir Peled、Sinead Cuffe、Mary O’Brien、Suman Rao、Katsuyuki Hotta、Ticiana A Leal、Jonathan W Riess、Julie R Brahmerは同社から顧問料、講演料などを受領している。Erin Jensen、Bin Zhao、M Catherine Pietanzaは同社の社員である。Julie R BrahmerはMSD社から顧問料などを受領している。著者のうち、Jin Zhang、Gregory M Lubiniecki、Anne C Deitz、Reshma Rangwalaは同社の社員である。その他の著者にMSD社より講演料、顧問料などを受領している者が含まれる。日本人集団の解析報告の著者のうち、Miyako SatouchiはMSD社より講演料などを受領している。Shi Rong Han及びKazuo Noguchiは同社の社員である。その他の著者にMSD社より講演料、顧問料などを受領している者が含まれる。
試験概要
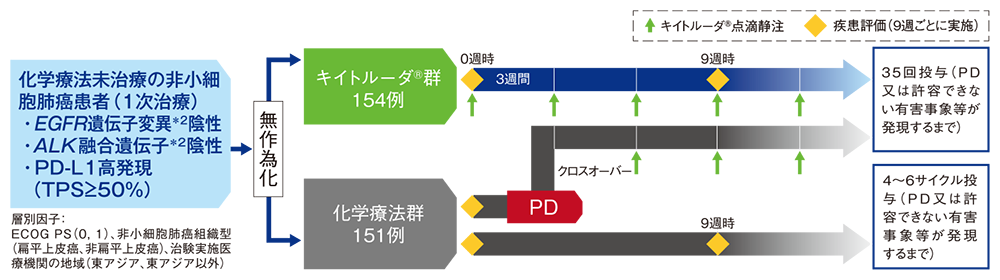
【目的】化学療法未治療の、EGFR遺伝子変異*1陰性 、ALK融合遺伝子*1陰性かつPD-L1高発現(TPS≧50%*2)の進行・再発の非小細胞肺癌患者におけるキイトルーダ®とプラチナ製剤を含む化学療法(以下、化学療法)の有効性及び安全性を比較検討する。
【デザイン】国際共同無作為化非盲検第Ⅲ相試験[優越性試験][第2回中間解析結果(データカットオフ日:2016年5月9日)][2年間フォローアップ解析結果(データカットオフ日:2017年7月10日)][5年間フォローアップ解析結果(データカットオフ日:2020年6月1日)]
【対象】化学療法未治療の、EGFR遺伝子変異陰性、ALK融合遺伝子陰性かつPD-L1高発現(TPS≧50%)の進行・再発の非小細胞肺癌患者305例(日本人40例を含む)
【方法】キイトルーダ®群(キイトルーダ®200mgを3週間間隔で点滴静注)又は化学療法#1群に1:1の割合で無作為割り付けした。9週ごとに画像診断により腫瘍縮小効果を判定し、病勢進行(PD)、許容できない有害事象の発現等による投与中止、又は投与完了(キイトルーダ®は35回、化学療法は4~6サイクル)まで継続した。また、化学療法群に割り付けられた患者はPDと判定され、クロスオーバーに関する基準#2をすべて満たした場合は、キイトルーダ®の投与を受けられることとした。
♯1 化学療法群では治験医師が無作為割り付け前に選択した以下の治療法のいずれかが施行された
- カルボプラチン・ペメトレキセド併用療法及びペメトレキセド維持療法(非扁平上皮癌患者のみ)
- シスプラチン・ペメトレキセド併用療法及びペメトレキセド維持療法(非扁平上皮癌患者のみ)
- シスプラチン・ゲムシタビン併用療法
- カルボプラチン・ゲムシタビン併用療法
- カルボプラチン・パクリタキセル併用療法及びペメトレキセド維持療法(維持療法は非扁平上皮癌患者のみ)
♯2 クロスオーバーに関する基準
- 化学療法による有害事象(脱毛を除く)がある場合は、Grade 1(CTCAE v4.0に基づく)以下に回復している
- 新規又は進行した脳転移により状態が安定していない患者のクロスオーバーは不適とする
- ECOG PS 0-1
- 盲検下独立判定委員会(BICR)によるRECISTガイドライン1.1版に基づくPDが認められる(プロトコール改訂後、PDは必要条件ではなくなった)
- 本試験において施行された化学療法以外の化学療法を施行していない
- 投与開始から7日以内に30Gy以下の緩和的放射線療法を施行していない
【評価項目】主要評価項目:無増悪生存期間(progression-free survival;PFS)※
副次評価項目:全生存期間(overall survival;OS)※、奏効率(overall response rate;ORR)、安全性
探索的評価項目:奏効期間(duration of response;DOR)、ランダム化割り付けから2次治療での病勢進行、又は死亡のいずれかが先に起こるまでの期間(PFS2)、クロスオーバー後のORR・奏効期間・病勢コントロール率・PFS・OS、健康関連QOLに関する患者報告アウトカム(patient-reported outcome;PRO)など
※PFS及びOSは検証的解析項目
【判定基準】PFS、ORR、DORは、盲検下独立判定委員会(BICR)がRECISTガイドライン1.1版に基づき評価した。
PFS、ORR、DORは第2回中間解析以降は、プロトコールの改訂で画像のBICRへの提出が不要となり、担当医師による評価に変更となった。PFS2は担当医師により評価した。
健康関連QOLに関するPROは、EORTC QLQ-C30、QLQ-LC13及びEQ-5D-3Lの質問票を用いて評価した。
【解析計画】解析対象集団:有効性の解析はITT集団*3、安全性の解析はASaT集団*4を対象として実施した。
有効性評価の統計手法:PFS、OS、PFS2はKaplan-Meier法を用いて推定し、PFS、OSの群間比較には、層別ログランク検定を用いた。OS、PFS、PFS2の投与群を共変量とし、ハザード比(HR)及び95%信頼区間(95%CI)を層別Cox比例ハザードモデルを用い算出した。ORRの群間比較には、層別Miettinen and Nurminen法を用いた。 DORはKaplan-Meier法による中央値と四分位点を用いて記述的に要約した。PFS、OSのサブグループ解析を、ECOG PS(0、1)、非小細胞肺癌組織型(扁平上皮癌、非扁平上皮癌)、治験実施医療機関の地域(東アジア、東アジア以外)の層別因子*5に加え、年齢(<65歳、≥65歳)、性別(男性、女性)、喫煙歴(現喫煙者、喫煙歴あり、喫煙歴なし)、脳転移(あり、なし)、治験医師により選択された化学療法(ペメトレキセドを含むレジメン、ペメトレキセドを含まないレジメン)などのベースライン時の背景因子別の部分集団を対象に、層別Cox比例ハザードモデルを用いて実施した。なお、日本人集団については治験実施計画書に記載されていないが、PFS、OS、ORR、DOR、奏効までの期間についても算出し、評価資料として承認時に評価された(データカットオフ日:2016年5月9日)。また、補足的にTwo-stageモデルを用いてクロスオーバーの影響を調整したOSの解析を行った。
健康関連QOLに関するPRO評価の統計手法:健康関連QOLに関するPROは、FAS集団*6を解析対象とした。QLQ-C30 GHS/QOLスコア、機能尺度及び症状尺度、並びにQLQ-LC13の症状尺度のベースラインからの変化量と群間差(15週時の最小二乗平均)は、患者報告アウトカム(PRO)スコアを応答変数とし、投与群、時点、投与群と時点の交互作用項を説明変数、無作為化層別因子*5を共変量に含めたcLDAモデルで評価した。加えて、病勢進行とQLQ-C30 GHS/QOLスコアの関連性について患者報告アウトカム(PRO)スコアを応答変数とし、投与群と時点の交互作用項を説明変数、病勢進行及び無作為化層別因子*5を共変量に含めたcLDAモデルで評価した。また、QLQ-LC13 咳嗽、胸痛及び呼吸困難複合スコア悪化までの期間*7はKaplan-Meier法を用いて推定し、HR及び95%CIはCox比例ハザードモデルを用いて算出した。欠測値はMARに基づいて補完した。
多重性の調整:本試験は1回のORR及びPFSの解析、2回のOSの解析を事前に計画し、試験全体の有意水準を片側2.5%とした。1回目の中間解析では、無作為化された最初のORRのみを検定することとした。2回目の中間解析では、PFSの解析を実施し、PFSの検定が有意であった場合にのみ、同じ有意水準でOSを検定することとした。PFSの優越性が証明され、かつOSの中間解析で治験を中止しない場合は最終解析でOSを検討することとした。なお、プロトコール改訂によりOSは1回に変更された。PFS及びOSの多重性はstep-down法により調整した。事前に規定された解析結果とともに、2年間フォローアップ解析(データカットオフ日:2017年7月10日)、5年間フォローアップ解析(データカットオフ日:2020年6月1日)から得られた有効性及び安全性の結果を示す。
*1 治験において、扁平上皮癌に対しては、EGFR遺伝子変異、ALK融合遺伝子の検査は必須とされなかった
*2 腫瘍細胞のうちPD-L1発現陽性細胞の割合が50%以上(TPS:tumor proportion score≥50%)
PD-L1の発現は、コンパニオン診断薬として製造販売承認されているPD-L1 IHC 22C3 pharmDx「ダコ」を用いて検査された
*3 ITT(intention to treat)集団:無作為化したすべての患者
*4 ASaT(all subjects as treated)集団:無作為化され、治験薬が1回以上投与されたすべての患者
*5 無作為化層別因子:ECOG PS(0、1)、非小細胞肺癌組織型(扁平上皮癌、非扁平上皮癌)、治験実施医療機関の地域(東アジア、東アジア以外)
*6 FAS(full analysis set)集団:ASaT集団のうち、少なくとも1回以上質問票に完全に回答した患者
*7 咳嗽、胸痛、呼吸困難のいずれかのスコアが初めてベースラインから10ポイント以上減少するまでの期間とし、次の測定で10ポイント以上減少が再度確認された事象を確定とした
4. 効能又は効果(抜粋)
切除不能な進行・再発の非小細胞肺癌
5. 効能又は効果に関連する注意(抜粋)
〈切除不能な進行・再発の非小細胞肺癌〉
5.2 本剤を単独で投与する場合には、PD-L1の発現が確認された患者に投与すること。PD-L1を発現した腫瘍細胞が占める割合(TPS)について、「17. 臨床成績」の項の内容を熟知すること。十分な経験を有する病理医又は検査施設において、承認された体外診断用医薬品又は医療機器を用いること。なお、承認された体外診断用医薬品又は医療機器に関する情報については、以下のウェブサイトから入手可能である:https://www.pmda.go.jp/review-services/drug-reviews/review-information/cd/0001.html[17.1.8-17.10参照]
5.3 臨床試験に組み入れられた患者のEGFR遺伝子変異又はALK融合遺伝子の有無等について、「17. 臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。[17.1.6、17.1.8-17.10参照]
8. 重要な基本的注意
8.1 本剤のT細胞活性化作用による、過度の免疫反応に起因すると考えられる様々な疾患、8.2 間質性肺疾患、8.3 甲状腺機能障害、下垂体機能障害及び副腎機能障害、8.4 劇症肝炎、肝不全、肝機能障害、肝炎、硬化性胆管炎、8.5 1型糖尿病、8.6 腎障害、8.7 筋炎、横紋筋融解症、8.8 重症筋無力症、8.9 心筋炎、8.10 ぶどう膜炎等の重篤な眼障害があらわれることがあるので注意が必要です。詳細は「製品情報:基本情報>「警告・禁忌」等その他の注意」をご参照ください。
患者背景(ITT集団)
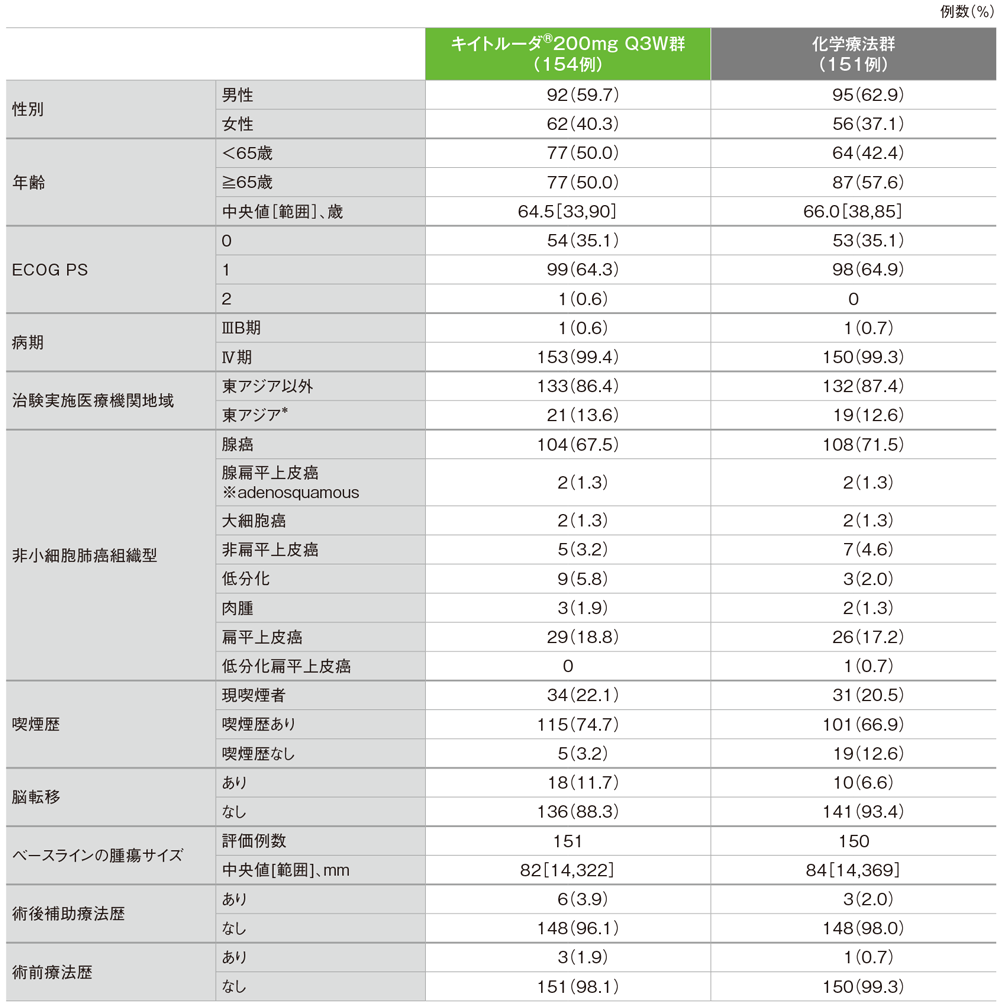
*東アジア人40例はすべて日本人症例
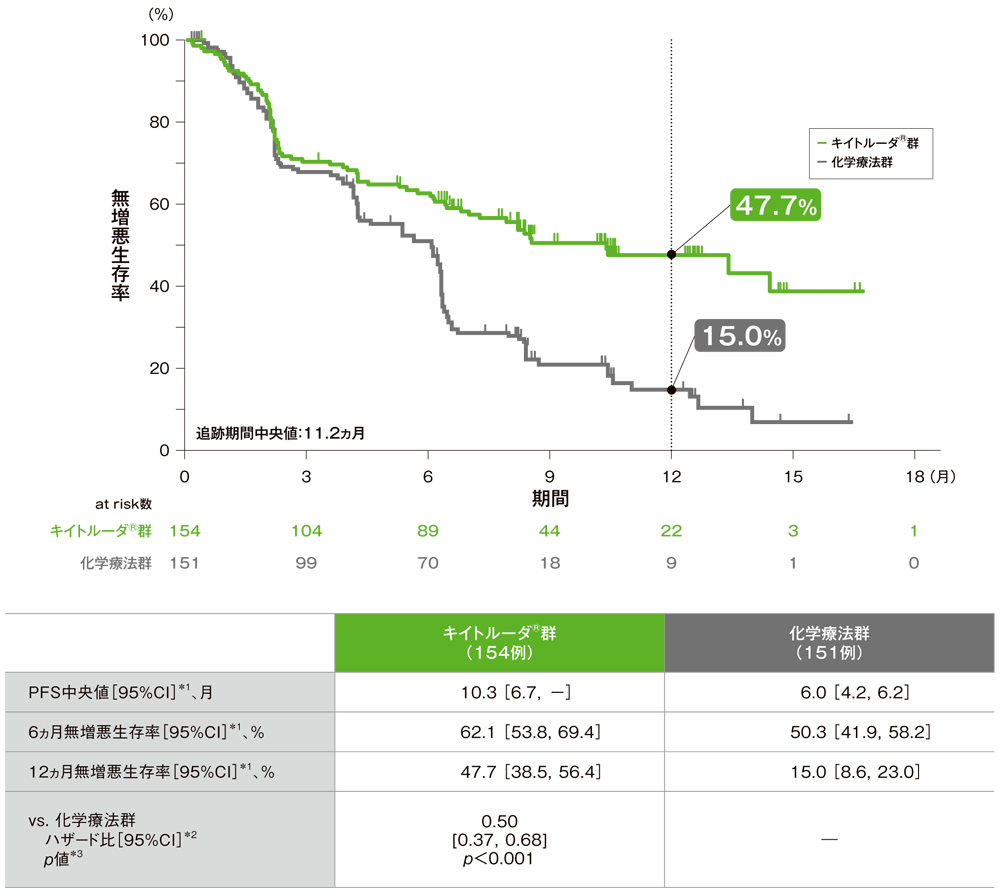
主要評価項目(優越性試験) 無増悪生存期間:PFS(検証的解析結果)
無増悪生存期間(PFS)のKaplan-Meier曲線(ITT集団)
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、治験実施医療機関の地域(東アジア、東アジア以外)、ECOG PS(0, 1)、非小細胞肺癌組織型(扁平上皮癌、非扁平上皮癌)を層別因子(無作為化に用いた層別因子)とした層別Cox比例ハザードモデルに基づく
*3 層別ログランク検定[片側](層別因子は無作為化に用いた層別因子)、有意水準α=0.02
(追跡期間中央値:11.2ヵ月)
- PFS中央値は、キイトルーダ®群10.3ヵ月(95%CI:6.7,未到達)、化学療法群6.0ヵ月(95%CI:4.2,6.2)でした。化学療法群に対するキイトルーダ®群のハザード比は0.50(95%CI:0.37,0.68)で、有意にPFSを改善しました(p<0.001、層別ログランク検定[片側]、有意水準α=0.02;検証的解析結果)。
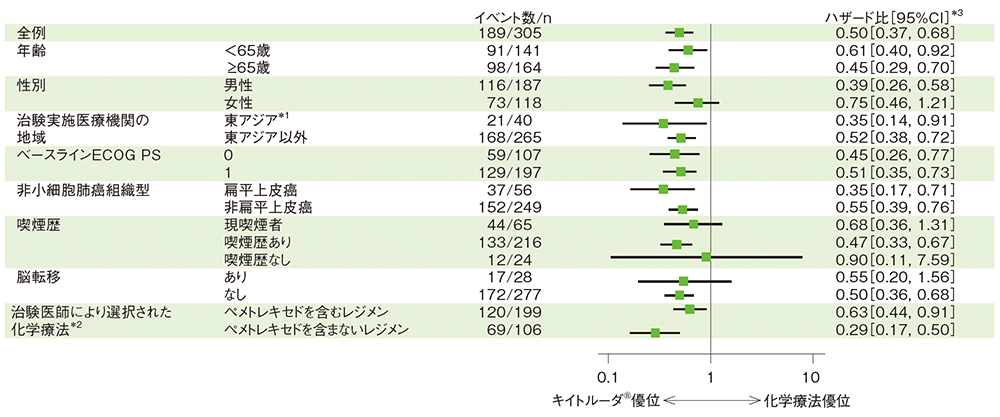
部分集団因子別にみた無増悪生存期間:PFS(サブグループ解析)
無増悪生存期間(PFS)のハザード比のフォレストプロット(ITT集団)
*1 東アジア人40例はすべて日本人症例
*2 患者を無作為化割り付け前に選択した治療法
*3 投与群を共変量とし、治験実施医療機関の地域(東アジア、東アジア以外)、ECOG PS(0, 1)、非小細胞肺癌組織型(扁平上皮癌、非扁平上皮癌)を層別因子とした層別Cox比例ハザードモデルに基づく
- 事前に規定されたPFSの部分集団解析の結果を示します。
副次評価項目(優越性試験) 全生存期間:OS(検証的解析結果)
全生存期間(OS)のKaplan-Meier曲線(ITT集団)
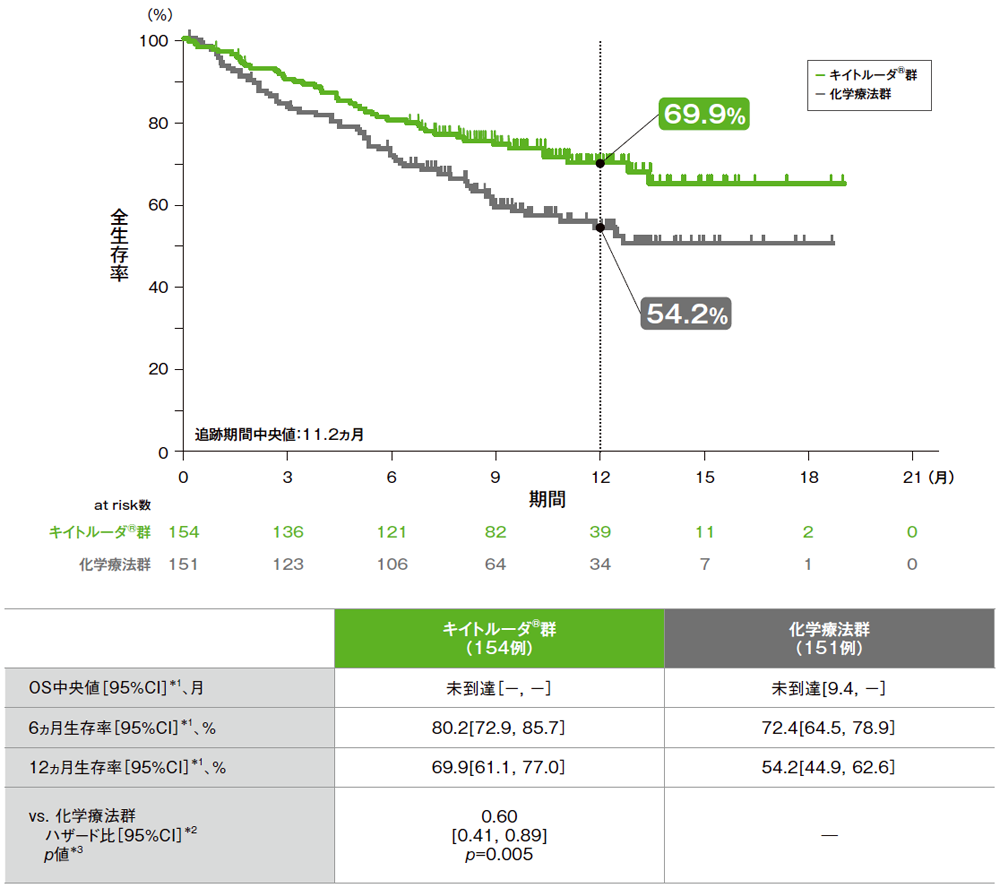
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、治験実施医療機関の地域(東アジア、東アジア以外)、ECOG PS(0, 1)、非小細胞肺癌組織型(扁平上皮癌、非扁平上皮癌)を層別因子(無作為化に用いた層別因子)とした層別Cox比例ハザードモデルに基づく
*3 層別ログランク検定[片側](層別因子は無作為化に用いた層別因子)、有意水準α=0.0118
(追跡期間中央値:11.2ヵ月)
- OS中央値は、キイトルーダ®群が未到達(95%CI:未到達,未到達)、化学療法群も未到達(95%CI:9.4,未到達)でした。化学療法群に対するキイトルーダ®群のハザード比は0.60(95%CI:0.41,0.89)で、有意にOSを改善しました(p=0.005、層別ログランク検定[片側]、有意水準α=0.0118;検証的解析結果)。なお、データカットオフ時点で、化学療法群の患者の43.7%(66例)がPD後にクロスオーバーを行いました。
副次評価項目 奏効率:ORR
独立判定評価に基づく奏効率(ORR)の要約(ITT集団)

(追跡期間中央値:11.2ヵ月)
- キイトルーダ®群のORRは44.8%(95%CI:36.8,53.0)、化学療法群では27.8%(95%CI:20.8,35.7)でした。
探索的評価項目 奏効期間:DOR
独立判定評価に基づく奏効までの期間及び奏効期間(DOR)の要約(ITT集団)
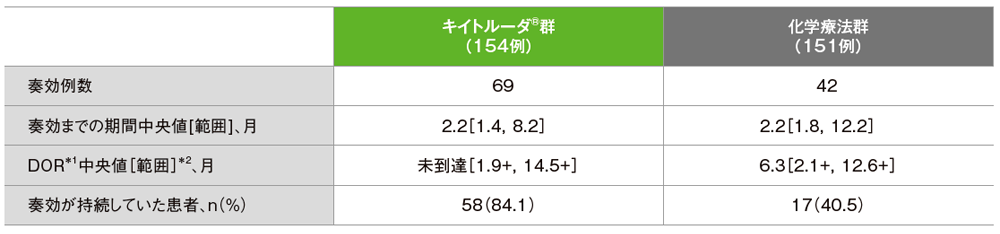
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 「+」は最後の疾患評価までPDがみられなかったことを示す
(追跡期間中央値:11.2ヵ月)
- 奏効が認められた患者における奏効までの期間中央値は、キイトルーダ®群2.2ヵ月(範囲:1.4,8.2)、化学療法群2.2ヵ月(範囲:1.8,12.2)、DOR中央値は、キイトルーダ®群未到達(範囲:1.9+,14.5+)、化学療法群6.3ヵ月(範囲:2.1+,12.6+)でした。また、奏効が認められた患者のうち、最終解析時点で奏効が持続していた患者数は、キイトルーダ®群58例(84.1%)、化学療法群17例(40.5%)でした。
安全性
キイトルーダ®群で副作用は113/154例(73.4%)に認められました。主な副作用(発現率10%以上)は、下痢22例(14.3%)、疲労、発熱各16例(10.4%)でした。重篤な副作用は33例(21.4%)に認められ、2例以上にみられた重篤な副作用は、肺臓炎7例(4.5%)、下痢3例(1.9%)、ALT(GPT)上昇、大腸炎、糖尿病、下気道感染各2例(1.3%)でした。副作用による中止は11例(7.1%)で、その内訳は肺臓炎6例(3.9%)、疲労、嘔吐、ALT(GPT)上昇、突然死、トランスアミナーゼ上昇各1例(0.6%)でした。副作用による死亡は突然死1例(0.6%)でした。
化学療法群で副作用は135/150例(90.0%)に認められました。主な副作用(発現率10%以上)は、貧血66例(44.0%)、悪心65例(43.3%)、疲労43例(28.7%)、食欲減退39例(26.0%)、好中球減少症34例(22.7%)、嘔吐30例(20.0%)、下痢、好中球数減少各20例(13.3%)、口内炎、血小板数減少各18例(12.0%)、血小板減少症、便秘各17例(11.3%)、白血球数減少16例(10.7%)、血中クレアチニン増加、味覚異常各15例(10.0%)でした。重篤な副作用は31例(20.7%)に認められ、2例以上にみられた重篤な副作用は、貧血4例(2.7%)、発熱性好中球減少症、汎血球減少症、肺炎、血小板減少症各3例(2.0%)、急性腎障害、鼻出血、肺感染各2例(1.3%)でした。副作用による中止は16例(10.7%)で、その内訳は疲労、血中クレアチニン増加各2例(1.3%)、嘔吐、急性腎障害、血中クレアチン増加、クレアチニン腎クリアランス減少、食欲減退、粘膜疹、発熱性好中球減少症、歩行障害、聴力低下、低酸素症、嗜眠、白血球増加症、悪心、末梢性感覚ニューロパチー、血小板数減少、肺胞出血、肺敗血症、気道感染各1例(0.7%)でした。副作用による死亡は3例(2.0%)で、その内訳は肺敗血症、肺胞出血、死亡各1例(0.7%)でした。
副作用(いずれかの投与群で発現率5%以上)(ASaT集団)
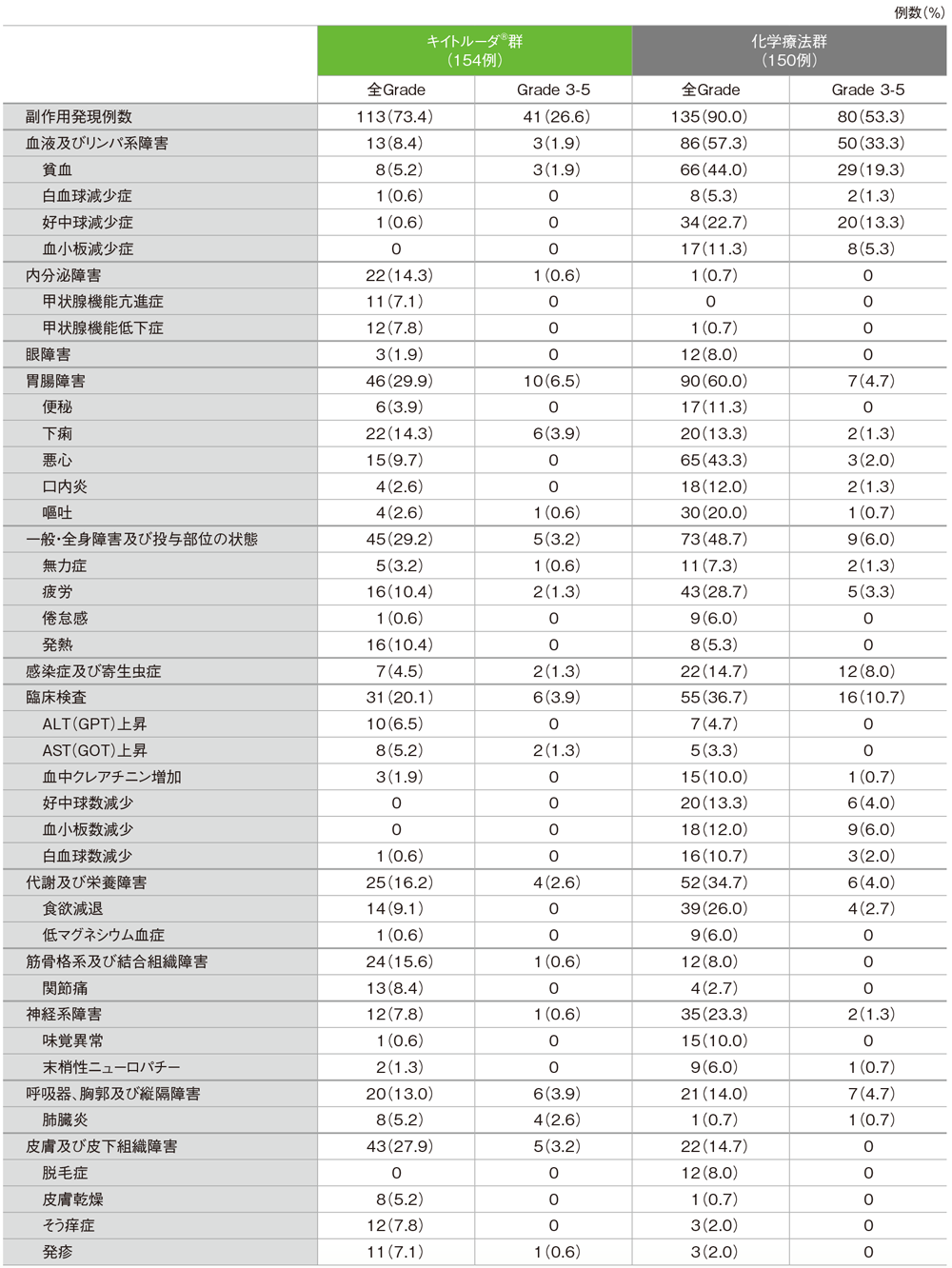
MedDRA/J version 19.0、GradeはCTCAE version 4.0
免疫関連など特に注目すべき有害事象
キイトルーダ®群で免疫関連など特に注目すべき有害事象(以下、注目すべき有害事象)は45/154例(29.2%)に認められました。主な注目すべき有害事象(発現率3%以上)は、甲状腺機能低下症14例(9.1%)、甲状腺機能亢進症12例(7.8%)、肺臓炎9例(5.8%)、Infusion reaction7例(4.5%)、重篤な皮膚障害6例(3.9%)でした。重篤な注目すべき有害事象は17例(11.0%)、起因する中止例は肺炎による6例(3.9%)、死亡例は認められませんでした。
化学療法群で注目すべき有害事象は7/150例(4.7%)に認められました。重篤な注目すべき有害事象、起因する中止例、死亡例は認められませんでした。
免疫関連など特に注目すべき有害事象一覧(ASaT集団)
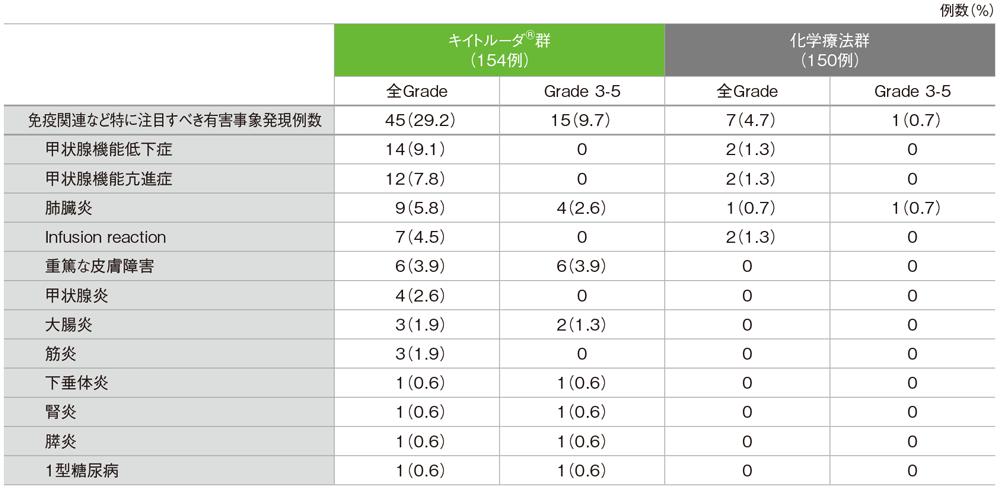
MedDRA/J version 19.0、GradeはCTCAE version 4.0
キイトルーダ®の投与期間中は、以下の検査スケジュールを参考に患者さんの状態を観察してください。
キイトルーダ®200mgを3週間間隔投与した国際共同第Ⅲ相試験(KEYNOTE-024試験)における検査スケジュール(最大35回投与)
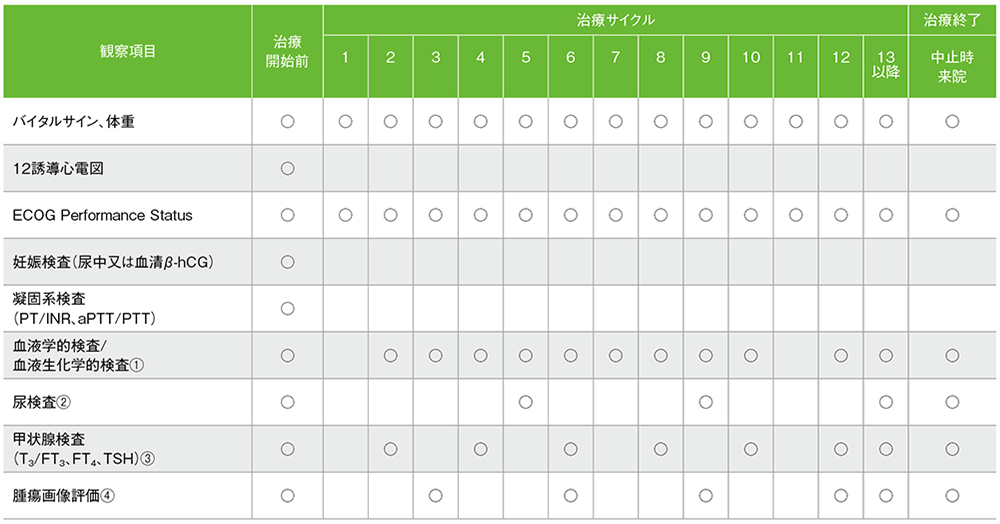
バイタルサイン:体温、脈拍、呼吸数、血圧
妊娠検査:妊娠の可能性がある女性の場合に、治療開始前72時間以内に実施
血液学的検査:ヘマトクリット、ヘモグロビン、血小板数、白血球数、白血球分画、赤血球数、好中球絶対数、リンパ球絶対数
血液生化学的検査:総蛋白、アルブミン、ALT(GPT)、AST(GOT)、ALP、総ビリルビン、直接ビリルビン、BUN、クレアチニン、尿酸、Na、K、Cl、Ca、Mg、P、血糖値
尿検査:潜血、糖、蛋白、比重、顕微鏡検査(異常値の場合)
①:サイクル10までサイクル毎、以降2サイクル毎 ②:サイクル13以降4サイクル毎 ③:サイクル13以降2サイクル毎 ④:9週毎
キイトルーダ®適正使用ガイド

