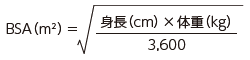禁忌を含む使用上の注意
禁忌を含む使用上の注意
2. 禁忌
2. 禁忌(次の患者には投与しないこと)
- 本剤の成分に対し過敏症の既往歴のある患者
8. 重要な基本的注意
- 8.1 本剤の投与期間は患者の臨床症状、効果等に基づき決定し、治療上必要な最小限の期間の投与にとどめること。[17.1.1、17.1.2 参照]
- 8.2 肝機能障害があらわれることがあるので、定期的に肝機能検査を行うなど、患者の状態を十分観察すること。[11.1.2参照]
9. 特定の背景を有する患者に関する注意
- 9.1 合併症・既往歴等のある患者
- 9.1.1 薬物過敏症の既往歴のある患者(本剤の成分に対し過敏症の既往歴のある患者を除く)
特に他のキャンディン系抗真菌剤に対し過敏症の既往歴のある患者には注意すること。 - 9.5 妊婦
妊婦又は妊娠している可能性のある女性には治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。ラットでは母動物に毒性があらわれる用量(5mg/kg/日)で、胎児体重の減少並びに頭蓋及び体躯の不完全骨化発現率の増加が認められている。さらに、同用量で頸肋の発現率増加がみられている。動物試験(ラット、ウサギ)で、胎盤通過が認められている。 - 9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。ヒトの母乳中に移行するか否かは不明である。ラットでは乳汁移行が認められている。 - 9.7 小児等
投与に際しては観察を十分に行うこと。小児の臨床試験では、成人と比べALT増加、AST増加、肝機能異常の発現頻度が高いことが報告されている。低出生体重児、新生児及び3ヵ月未満の乳児を対象とした国内臨床試験は実施していない。
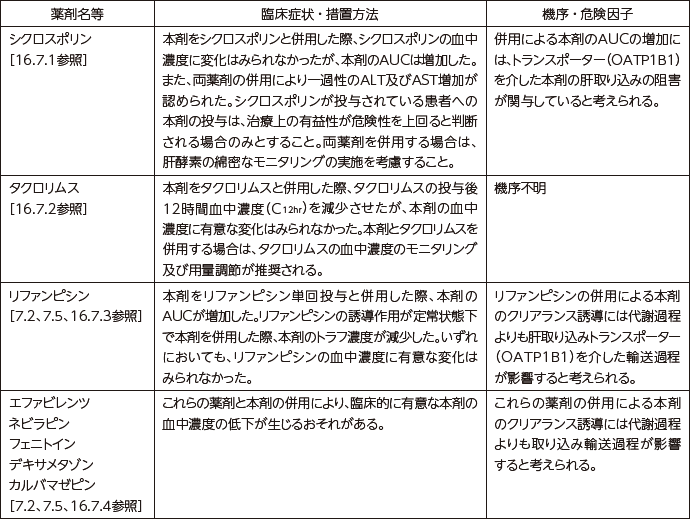
10. 相互作用
- 10.2 併用注意(併用に注意すること)
11. 副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
- 11.1 重大な副作用
- 11.1.1 アナフィラキシー(頻度不明)
発疹、顔面腫脹、血管浮腫、そう痒症、熱感、気管支痙攣、呼吸困難、潮紅等の異常があらわれることがある。 - 11.1.2 肝機能障害(頻度不明)
AST、ALT、Al-Pの上昇や肝機能障害があらわれることがある。[8.2 参照] - 11.1.3 中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)、皮膚粘膜眼症候群(Stevens-Johnson症候群)(頻度不明)
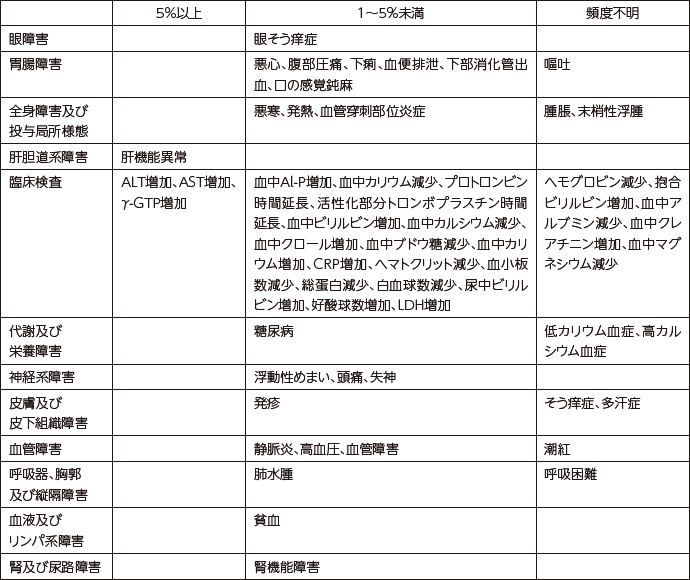
- 11.2 その他の副作用
14. 適用上の注意
- 14.1 薬剤調製時の注意
〈成人〉
- 14.1.1 バイアル中の本剤の溶解
バイアルを常温に戻し、本品1バイアル(70mgバイアル又は50mgバイアル)に、生理食塩液あるいは注射用水10.5mLを注入し、ゆっくりと振り混ぜて粉末状の本剤を完全に溶解させる。バイアル中に溶解した本剤の溶液が混濁又は沈殿している場合はその溶液を使用しないこと。本剤の溶解後の濃度は、7.2mg/mL(70mgバイアル)又は5.2mg/mL(50mgバイアル)とそれぞれ異なるので希釈する時は注意すること。 - 14.1.2 本剤投与時の調製方法
希釈液は、生理食塩液又は乳酸リンゲル液を用いる。通常、バイアル中で溶解した本剤の溶液の必要量(下表参照)を、250mLの希釈液の入った点滴静注用バッグ又はボトルに添加して希釈し、点滴静注液とする。調製後の点滴静注液が混濁又は沈殿している場合はその静注液を使用しないこと。1日1回用量が50mg又は35mgの場合には、必要に応じて希釈液を100mLに減じて用いることができる。
点滴静注液の調製法

- † 70mgバイアル、50mgバイアルのいずれを用いる際も、バイアル中の本剤の溶解には生理食塩液あるいは注射用水を10.5mL用いること。
- ‡ 70mgバイアルが利用できない場合には、50mgバイアル2本を用いて1日1回用量70mgの点滴静注液を調製することができる。
- § 50mgバイアルが利用できない場合には、70mgバイアル1本を用いて1日1回用量50mgの点滴静注液を調製することができる。
- ‖ 100mLの希釈液を用いた調製法は推奨しない。調製後の最終濃度が0.5mg/mLを超えないこと。
〈小児〉
- 14.1.3 患者の体表面積(BSA)に基づく1日1回の用量の計算
本剤投与前に患者の体表面積(BSA)注)に基づいて用量を計算する。
投与初日の用量(mg)は、BSA(m2)×70mg/m2で計算し、投与2日目以降の用量(mg)は、BSA(m2)×50mg/m2で計算する。
ただし、投与初日及び投与2日目以降の1日用量は、患者毎に計算された用量に関わらず、70mgを超えないこと。 - 14.1.4 バイアル中の本剤の溶解
バイアルを常温に戻し、本品1バイアル(70mgバイアル又は50mgバイアル)に、生理食塩液あるいは注射用水10.5mLを注入し、ゆっくりと振り混ぜて粉末状の本剤を完全に溶解させる。バイアル中に溶解した本剤の溶液が混濁又は沈殿している場合はその溶液を使用しないこと。本剤の溶解後の濃度は、7.2mg/mL(70mgバイアル)又は5.2mg/mL(50mgバイアル)とそれぞれ異なるので希釈する時は注意すること。 - 14.1.5 本剤投与時の調製方法
希釈液は、生理食塩液又は乳酸リンゲル液を用いる。バイアル中で溶解した本剤の溶液から計算した用量に相当する必要量を、点滴静注用バッグ又はボトルに添加して希釈し、点滴静注液とする。調製後の点滴静注液が混濁又は沈殿している場合はその静注液を使用しないこと。調製後の最終濃度が0.5mg/mLを超えないこと。
〈共通〉
- 14.1.6 本剤の調製に際しては、ブドウ糖を含む希釈液を使用しないこと。本剤はブドウ糖を含む希釈液中では不安定である。
- 14.1.7 調製後は速やかに使用すること。やむを得ず保存を必要とする場合でも、バイアル中で溶解した本剤の溶液は、25℃以下で24時間以内に使用すること。また、希釈した点滴静注液は、25℃以下では24時間以内、冷所(2~8℃)では48時間以内に使用すること。
- 14.2 薬剤投与時の注意
本剤の投与に際しては、他の薬物と混合しないこと。また、他剤と同じラインで同時に点滴静注を行わないこと。他剤と連続注入する場合には、本剤の投与前後にラインを生理食塩水又は乳酸リンゲル液でフラッシュすること。他の薬物と混合した場合及び他剤と同じラインで同時に点滴静注を行った場合のデータはない。 - 注)患者の体表面積(BSA)は以下に示すMosteller式により算出する。