有効性:持続性発熱性好中球減少症患者
有効性:持続性発熱性好中球減少症患者
海外第Ⅲ相臨床試験成績〈成人〉
持続性発熱性好中球減少症患者を対象とした海外臨床試験(非劣性試験)1)、2)(海外データ)
1)Walsh TJ, et al., N Engl J Med, 2004;351:1391-1402. ©Massachusetts Medical Society
(利益相反:MSD社は本試験に資金提供。Baden、Cornely、Donowitz、Walshは研究助成金を、Cornely、dePauw、Maertensはコンサルタント料又は講演料をMSD社から受領。Teppler、Bourque、Lupinacci、SableはMSD社米国研究所員。)
2)承認時評価資料(持続性発熱性好中球減少症を対象とした海外臨床試験:026試験)
試験方法

MITT:治験薬の投与を1回以上受け、悪性腫瘍に対して化学療法又は造血幹細胞移植の既往があり、かつ組み入れ時に発熱及び好中球減少症が選択基準を満たした患者
注)本邦において「真菌感染が疑われる発熱性好中球減少症」に対して承認されている用法及び用量は「体重1kg当たりアムホテリシンBとして2.5mg(力価)を1日1回、1~2時間以上かけて点滴静注する。」である。海外での初期投与量は、3.0mg/kg/日である。
有効性
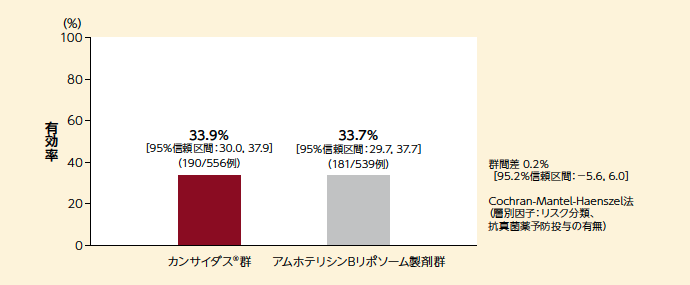
MITT解析による総合効果の有効率(リスク分類と抗真菌薬予防投与の有無で調整)は、カンサイダス®群が33.9%[95%信頼区間:30.0, 37.9]、アムホテリシンBリポソーム製剤群が33.7%[95%信頼区間:29.7, 37.7]であった。有効率の差の推定値は0.2%[95.2%信頼区間:−5.6, 6.0]で、あらかじめ設定した非劣性マージン(95.2%信頼区間が0を含み、下限が−10%を下回らない)を満たしたことから、カンサイダス®のアムホテリシンBリポソーム製剤に対する非劣性が検証された。
■ 総合効果の有効率(MITT、主要評価項目)
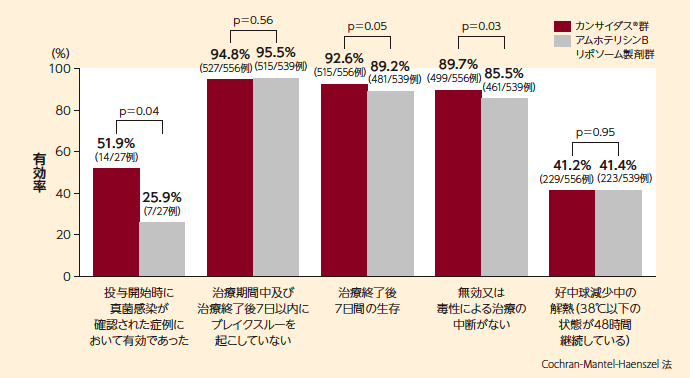
■ 各評価項目の有効率(MITT、副次評価項目)
安全性
カンサイダス®群の臨床症状の副作用発現率は47.0%(265/564例)であり、主なものは発熱96例(17.0%)、悪寒78例(13.8%)、発疹35例(6.2%)、臨床検査値の副作用発現率は22.5%(127/564例)であり、主なものはALT増加49/561例(8.7%)、血中カリウム減少41/563例(7.3%)、AST増加39/561例(7.0%)、Al-P増加39/559例(7.0%)であった。アムホテリシンBリポソーム製剤群の臨床症状の副作用発現率は59.6%(326/547例)であり、主なものは悪寒135例(24.7%)、発熱106例(19.4%)、悪心62例(11.3%)、臨床検査値の副作用発現率は32.0%(175/547例)であり、主なものはAl-P増加65/540例(12.0%)、血中カリウム減少64/544例(11.8%)、ALT増加48/542例(8.9%)であった。
臨床症状の重篤な副作用はカンサイダス®群で9例(急性腎不全、発疹各2例等)、アムホテリシンBリポソーム製剤群で16例(呼吸窮迫、過敏症反応各3例、呼吸困難、急性腎不全、潮紅各2例等)にみられた。臨床検査値の重篤な副作用はカンサイダス®群で発現せず、アムホテリシンBリポソーム製剤群で1例(血中総ビリルビン増加)にみられた。臨床症状の投与中止に至った副作用はカンサイダス®群で25例[発疹(Rash)7例、発熱4例等]、アムホテリシンBリポソーム製剤群で35例(発熱、過敏症反応、急性腎不全各4例等)にみられた。臨床検査値の投与中止に至った副作用はカンサイダス®群で3例(ALT増加、Al-P増加及びAST増加1例、ALT増加1例、血中総ビリルビン増加及び血中直接ビリルビン増加1例)、アムホテリシンBリポソーム製剤群で13例(Al-P増加、血中総ビリルビン増加、血清クレアチニン増加各4例等)にみられた。副作用による死亡例は、カンサイダス®群で1例(腎機能不全)、アムホテリシンBリポソーム製剤群で2例(心停止、呼吸窮迫各1例)であった。
8. 重要な基本的注意 −抜粋−
8.1 本剤の投与期間は患者の臨床症状、効果等に基づき決定し、治療上必要な最小限の期間の投与にとどめること。[ 17.1.1、17.1.2参照]