有効性:侵襲性アスペルギルス症患者
有効性:侵襲性アスペルギルス症患者
海外第Ⅱ相臨床試験成績〈成人〉
侵襲性アスペルギルス症患者を対象とした海外臨床試験1)、2)(海外データ)
1)Maertens J, et al., Clin Infect Dis, 2004;39:1563-1571.
(利益相反:MSD社は本試験に資金提供。Raad、Patterson、DenningはMSD社から研究助成金を受領。Maertens、Raad、Boogaerts、Patterson、DenningはMSD社のコンサルタント又はスピーカー。WalthはMSD社のアワードを受賞。Sable、Kartsonis、Ngai、TaylorはMSD社研究所員。)
2)承認時評価資料(侵襲性アスペルギルス症を対象とした海外臨床試験:019試験)
試験方法

MITT:侵襲性アスペルギルス症と診断(確定診断例又は臨床診断例)され、治験薬が1回以上投与された患者
※最初に組み入れられた90例が有効性評価委員会により評価され、診断基準が不適格の5例及び評価データのない2例を除外した83例を評価対象とした
有効性
カンサイダス®50mg(投与初日のみ70mg)投与により臨床症状における「改善」又は「ほぼ改善」と判定された患者の割合は44.6%(37/83例)であった。
■ 総合効果の有効率(MITT、主要評価項目)
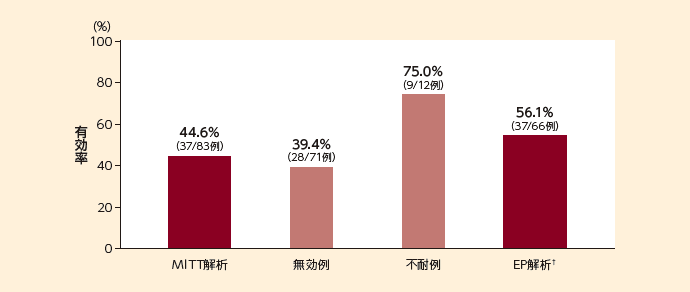
†EP解析:MITT解析対象のうち、他の抗真菌薬の併用なし、有効性の評価に影響を及ぼしうるプロトコールからの逸脱なし、治療終了後に適切な臨床評価を実施、カンサイダス®を7日以上投与の条件を満たした患者を対象とした。
安全性
カンサイダス®50mg(投与初日のみ70mg)投与による臨床症状の副作用発現率は13.7%(14/102例)であり、主なものは無力症/疲労、発熱、注入静脈合併症、悪心、嘔吐、潮紅、発疹各2例(2.0%)であった。臨床検査値の副作用発現率は14.1%(14/99例)であり、主なものは尿蛋白増加3/87例(3.4%)、血清Al-P増加、血清クレアチニン増加各2/98例(2.0%)、好酸球数増加2/91例(2.2%)であった。
臨床症状の重篤な副作用は1例(肺浸潤)、臨床検査値の重篤な副作用は1例(高カルシウム血症)にみられた。臨床症状の投与中止に至った副作用は1例(肺浸潤)、臨床検査値の投与中止に至った副作用は1例(血清クレアチニン増加)にみられた。副作用による死亡例は認められなかった。
8. 重要な基本的注意 −抜粋−
8.1 本剤の投与期間は患者の臨床症状、効果等に基づき決定し、治療上必要な最小限の期間の投与にとどめること。[ 17.1.1、17.1.2参照]