〈小児〉有効性:持続性発熱性好中球減少症患者
〈小児〉有効性:持続性発熱性好中球減少症患者
海外第Ⅱ相臨床試験成績〈小児〉
持続性発熱性好中球減少症患者を対象とした海外臨床試験(無作為化二重盲検試験)1)、2)(海外データ)
1)Maertens JA, et al., Pediatr Infect Dis, 2010;29:415-420.(承認時評価資料)
(利益相反:MSD社は本試験に資金提供。Bourque、Wise、Strohmaier、Kartsonis、ChowはMSD社米国研究所員。)
2)承認時評価資料(持続性発熱性好中球減少症(小児)を対象とした海外臨床試験:044試験)
試験方法

MITT:化学療法/造血幹細胞移植の施行歴があり、実施計画書に定めた持続性発熱性好中球減少症の基準を満たし、治験薬が1回以上投与された患者
注)本邦において「真菌感染が疑われる発熱性好中球減少症」に対して承認されている用法・用量は「体重1kg当たりアムホテリシンBとして2.5mg(力価)を1日1回、1~2時間以上かけて点滴静注する。」である。海外での初期投与量は、3.0mg/kg/日である。
有効性
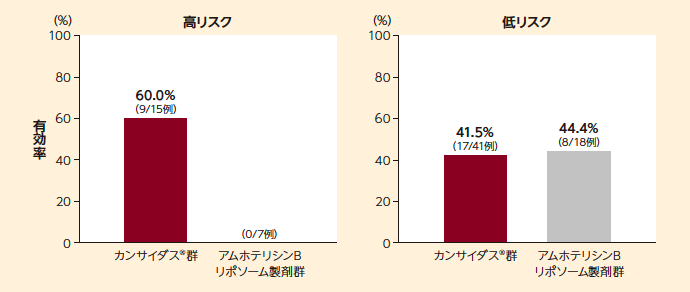
発熱性好中球減少症患者に対する有効率は、カンサイダス®群では46.4%(26/56例)、アムホテリシンBリポソーム製剤群では32.0%(8/25例)でした。リスク分類別に解析したところ、カンサイダス®群では高リスク集団で60.0%(9/15例)、低リスク集団で41.5%(17/41例)であった。
■ 総合効果の有効率[MITT、主要評価項目]
![総合効果の有効率[MITT、主要評価項目]](https://www.msdconnect.jp/wp-content/uploads/2021/02/cancidas_report07_fig02.png)
■ リスク分類別の有効率(サブグループ解析)
安全性
カンサイダス®群の臨床症状の副作用発現率は48.2%(27/56例)であり、主なものは発熱16例(28.6%)、頭痛、発疹各5例(8.9%)、臨床検査値の副作用発現率は10.7%(6/56例)であり、主なものはALT増加、血中カリウム減少各2例(3.6%)であった。アムホテリシンBリポソーム製剤群の臨床症状の副作用発現率は46.2%(12/26例)であり、主なものは頻脈3例(11.5%)、嘔吐、悪寒各2例(7.7%)、臨床検査値の副作用発現率は19.2%(5/26例)であり、主なものは血中カリウム減少3例(11.5%)であった。
臨床症状の重篤な副作用はカンサイダス®群で1例(低血圧)、アムホテリシンBリポソーム製剤群で3例(高ビリルビン血症、口周囲浮腫各1例、喉頭痙攣、血管神経性浮腫、頻脈及び呼吸困難1例)にみられた。臨床検査値の重篤な副作用はカンサイダス®群及びアムホテリシンBリポソーム製剤群ともに発現しなかった。臨床症状の投与中止に至った副作用はカンサイダス®群で2例(低血圧、発疹各1例)、アムホテリシンBリポソーム製剤群で3例(高ビリルビン血症、口周囲浮腫各1例、喉頭痙攣、血管神経性浮腫、頻脈及び呼吸困難1例)にみられた。臨床検査値の投与中止に至った副作用はカンサイダス®群及びアムホテリシンBリポソーム製剤群ともに発現しなかった。副作用による死亡例は認められなかった。
5. 効能又は効果に関連する注意 −抜粋−
〈真菌感染が疑われる発熱性好中球減少症〉
5.1 本剤は以下の3条件を満たす症例に投与すること。
・1回の検温で38℃以上の発熱、又は1時間以上持続する37.5℃以上の発熱
・好中球数が500/mm3未満の場合、又は1,000/mm3未満で500/mm3未満に減少することが予測される場合
・適切な抗菌薬投与を行っても解熱せず、抗真菌薬の投与が必要と考えられる場合
5.2 発熱性好中球減少症の患者への投与は、発熱性好中球減少症の治療に十分な経験を持つ医師のもとで、本剤の投与が適切と判断される症例についてのみ実施すること。
5.3 発熱性好中球減少症に投与する場合には、投与前に適切な培養検査等を行い、起炎菌を明らかにする努力を行うこと。起炎菌が判明した際には、本剤投与継続の必要性を検討すること。
8. 重要な基本的注意 −抜粋−
8.1 本剤の投与期間は患者の臨床症状、効果等に基づき決定し、治療上必要な最小限の期間の投与にとどめること。[ 17.1.1、17.1.2参照]