日本のHPVワクチン安全性報告
日本のHPVワクチン安全性報告
HPVワクチンの積極的接種勧奨の差し控え以降、 HPVワクチンの安全性について、様々な調査・研究が行われてきました。
2021年11月12日に開催された予防接種・ワクチン分科会副反応検討部会において、 HPVワクチンの安全性について特段の懸念が認められないことが確認され、接種による有効性が副反応のリスクを明らかに上回ると認められました。また、引き続きHPVワクチンの安全性の評価を行っていくこと、接種後に生じた症状の診療体制を充実させていくことなどを進めることにより、積極的な接種勧奨を差し控えている状態を終了させることが妥当であると判断され、2021年11月26日、厚生労働省健康局長通知により、ヒトパピローマウイルス感染症に係る定期の予防接種の積極的な勧奨が再開しました。
ここでは、日本におけるHPVワクチンの安全性を評価した主な調査・研究について紹介します。
積極的接種勧奨の差し控え期間に報告された調査・研究
- HPVワクチン販売開始から平成26年11月までの副反応疑い報告の追跡調査
- 「多様な症状」の発生状況を調査した厚生労働省研究班の報告
- 24項目の「多様な症状」の発生頻度について約7万人を対象に調査したNagoya study
積極的接種勧奨の再開後の安全性に関する調査・研究
副反応疑い報告 追跡調査結果
副反応疑い報告 追跡調査結果
HPVワクチン販売開始から平成26年11月までの被接種者における副反応疑い報告の追跡調査結果です。副反応追跡調査では、HPVワクチンを接種した約338万人を対象としました。発症日および転帰等が把握できた1,739人のうち、回復した方、または通院不要である方は1,550人の89.1%、未回復の方は186人の10.7%(被接種者の0.005%)でした。未回復の186人の症状は、多い順に、頭痛66人、倦怠感58人、関節痛49人、接種部位以外の疼痛42人、筋肉痛35人、筋力低下34人でした。
副反応追跡調査結果
- 子宮頸がん予防ワクチンを販売開始から平成26年11月まで接種した約338万人(約890万回接種)のうち、副反応疑い報告があったのは2,584人(被接種者約338万人の0.08%【のべ接種回数約890万回の0.03%】)
- 発症日・転帰等が把握できた1,739人のうち、回復した方又は軽快し通院不要である方は1,550人(89.1%)、未回復の方は186人(10.7%、被接種者の0.005%、【のべ接種回数の約0.002%】)
- 発症日・転帰等が把握できた1,739人のうち、発症から7日以内に回復した方は1,297人(74.6%)
- 発症から7日を超えて症状が継続した方のうち、接種日から発症日の期間別の人数割合は、当日・翌日発症が47.7%、1月までの発症が80.1%
- 未回復の186人の症状は、多い順に、頭痛66人、倦怠感58人、関節痛49人、接種部位以外の疼痛42人、筋肉痛35人、筋力低下34人
- 未回復の186人は、1症状の方68人、2症状の方39人、3症状の方19人、4症状の方19人、5症状以上の方41人
- 未回復の186人の生活状況は、入院した期間あり87人、日常生活に介助を要した期間あり63人、通学・通勤に支障を生じた期間あり135人
厚生労働省 2015年9月17日 第15回厚生科学審議会予防接種・ワクチン分科会副反応検討部会 資料4-1
https://www.mhlw.go.jp/stf/shingi2/0000097690.html (Accessed Mar. 14, 2023)
全国疫学調査(祖父江班)
全国疫学調査(祖父江班)結論
厚生労働省は、HPVワクチンの積極的な接種勧奨の一時差し控え後、研究班を立ち上げ、大阪大学の祖父江先生を班長として、全国疫学調査を実施しました。その結果、HPVワクチン接種歴のない者においても、HPVワクチン接種後に報告されている症状と同様の「多様な症状」が一定数存在したことが報告されました。これらの結果により、HPVワクチン接種と接種後に生じた症状との因果関係は言及できないと結論づけられました。
全国疫学調査(祖父江班)結論
①HPVワクチン接種歴のない者においても、HPVワクチン接種後に報告されている症状と同様の「多様な症状」を呈する者が、一定数存在した。
②本調査によって、HPVワクチン接種と接種後に生じた症状との因果関係は言及できない。
Fukushima W et al. J Epidemiol. 2022; 32: 34-43
厚生労働省 2016年12月26日 第23回厚生科学審議会予防接種・ワクチン分科会副反応検討部会 資料4
https://www.mhlw.go.jp/file/05-Shingikai-10601000-Daijinkanboukouseikagakuka-Kouseikagakuka/0000147016.pdf (Accessed Mar. 14, 2023)
全国疫学調査(祖父江班)概要
祖父江班の全国疫学調査では、青少年における「疼痛または運動障害を中心とする多様な症状」について、その頻度と特性を調査しました。調査対象診療科は18,302診療科、調査対象症例基準は、①12~18歳、②疼痛および光や音、においの感覚の障害、または運動障害、または自律神経症状または認知機能の障害の少なくとも1つ以上の症状がある、③②の症状が、3ヵ月以上持続している、④②および③のため、通学や就労に影響がある、以上①から④のすべてを満たすこととしました(図1)。
図1:全国疫学調査概要
(青少年における「疼痛又は運動障害を中心とする多様な症状」について、頻度と特性を調査)

Fukushima W et al. J Epidemiol. 2022; 32: 34-43
厚生労働省 2016年12月26日 第23回厚生科学審議会予防接種・ワクチン分科会副反応検討部会 資料4
https://www.mhlw.go.jp/file/05-Shingikai-10601000-Daijinkanboukouseikagakuka-Kouseikagakuka/0000147016.pdf (Accessed Mar. 14, 2023)
全国疫学調査(祖父江班)まとめ
HPVワクチン接種後に報告されている症状と同様の「多様な症状」を呈する者は、12〜18歳の女子全体では人口10万人あたり40.1人と推計されました。また、HPVワクチンの接種歴がなく、「多様な症状」を呈する女子は人口10万人あたり20.2人、接種歴があり、「多様な症状」を呈する女子は人口10万人あたり27.8人と推計されました。「多様な症状」を具体的な症状別にみると、接種、非接種にかかわらずみられる症状と、「接種歴あり」で割合が高い症状がありましたが、頻度と同様、多数のバイアスが存在するため、比較ができないとされています。しかし、すべての症状は「接種歴あり」と「接種歴なし」の両群に存在し、一方の群だけに特異的な症状はありませんでした(図2)。
図2:全国疫学調査(祖父江班)結果のまとめ

Fukushima W et al. J Epidemiol. 2022; 32: 34-43.
厚生労働省 2016年12月26日 第23回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、平成28年度第9回薬事・食品衛生審議会医薬品等安全対策部会安全対策調査会
資料4 全国疫学調査(子宮頸がんワクチンの有効性と安全性の評価に関する疫学研究) より一部改変
https://www.mhlw.go.jp/file/05-Shingikai-10601000-Daijinkanboukouseikagakuka-Kouseikagakuka/0000147016.pdf (Accessed Mar. 14, 2023)
Nagoya study
Nagoya study 調査概要
名古屋市では、HPVワクチン接種に関する被害者団体の要請を受け、独自に大規模な疫学調査を実施しました。本調査では、2015年8月12日時点で名古屋市に住民票のある、1994年4月2日〜2001年4月1日生まれの女性71,177人を対象として、接種の有無による24項目の「多様な症状」の割合を比較しました(表1)。
表1:HPVワクチン接種と「多様な症状」に関する疫学調査(日本:名古屋)
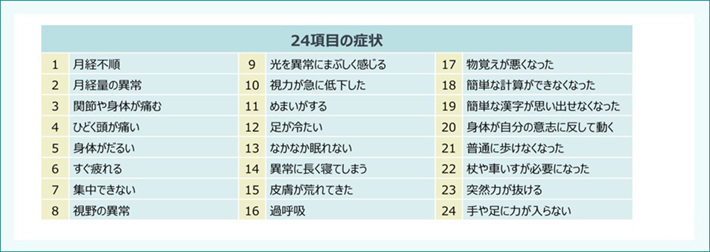
【目的】HPVワクチン接種、非接種を含めた約7万人を対象とした調査において、接種の有無による24項目の症状の割合を比較する
【対象】2015年8月12日時点で名古屋市に住民票のある、1994年4月2日~2001年4月1日生まれの女性71,177人
【方法】名古屋市で1994年4月2日~2001年4月1日に生まれた女性(2010年4月1日時点9~15歳)71,177人に対して、2015年9月に郵便による匿名のアンケート調査を実施し、回答が得られた29,846人を対象に24の症状発生とHPVワクチン接種の有無について検討した。年齢調整オッズ比(OR)及び95%CIはロジスティック回帰分析を用いて解析した。
【主要評価項目】HPVワクチン接種と24症状の発生
Suzuki S et al. Papillomavirus Res. 2018; 5: 96-103.
Nagoya study 症状とHPVワクチンの関連
年齢調整された分析では、HPVワクチン接種と24項目の「多様な症状」との間に有意な関連性は見出されませんでした(表2)。いくつかの症状による病院受診の増加がみられましたが、生物学的関連性に起因するものとは考えにくいと結論づけられました(図3)。
表2:24の症状発生と、HPVワクチン接種との関連性についてのアンケート調査(名古屋市 2015年)
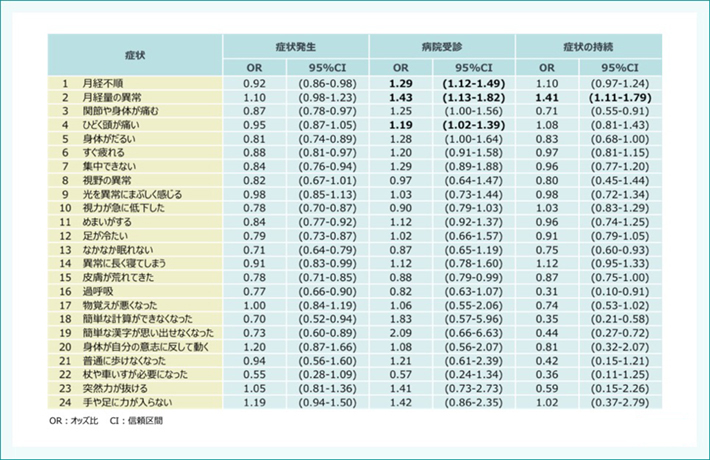
Suzuki S et al. Papillomavirus Res. 2018; 5: 96-103.
図3:Nagoya studyの結果

Suzuki S et al. Papillomavirus Res. 2018; 5: 96-103.
積極的接種勧奨再開後のHPVワクチンの安全性評価
厚生科学審議会予防接種・ワクチン分科会副反応検討部会副反応疑い報告
HPVワクチンの積極的接種勧奨の再開については、2021年10月1日、11月12日に開催された予防接種・ワクチン分科会副反応検討部会において審議され、11月12日の審議において、HPVワクチンの安全性については、積極的勧奨再開(2022年4月)後の当面は、以下のとおり頻度を上げて評価を行うこととされました。
- 本合同部会におけるHPVワクチンの安全性については、積極的勧奨再開直後の6ヵ月間(4月~10月)は、通常3ヵ月に1回の評価スケジュールを、概ね1ヵ月に1回とし、頻度を上げて評価を行う。
| 合同部会開催予定月 | 各開催日における副反応疑い事例の集計対象期間 |
|---|---|
| 2022年4月 | ~2021年12月 |
| 2022年6月※ | ~2022年4月 |
| 2022年7月 | ~2022年5月 |
| 2022年8月 | ~2022年6月 |
| 2022年9月 | ~2022年7月 |
| 2022年10月 | ~2022年8月 |
| 2023年1月 | ~2022年9月 |
- 当該期間においては、各開催日における副反応疑い事例の集計対象期間も2ヵ月延長する。また、評価の迅速性を重視し、新型コロナワクチンの副反応疑い事例の評価同様、医療機関報告と製造販売業者報告との症例の名寄せ作業は実施せず、両報告を組み合わせて評価する。
※:2022年4月以降に報告された副反応疑い事例の最初の評価日
厚生労働省 2022年1月21日 第75回厚生科学審議会予防接種・ワクチン分科会副反応検討部会
令和3年度第26回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会 資料2-30 より作成
https://www.mhlw.go.jp/stf/shingi2/0000208910_00037.html (Accessed Mar. 14, 2023)
4価HPVワクチン 副反応疑い報告数及び重篤例の転帰
4価HPVワクチンの副反応疑い報告数(表3)及び重篤例の転帰(表4)は以下のとおりでした。
表3:4価HPVワクチン 副反応疑い報告数
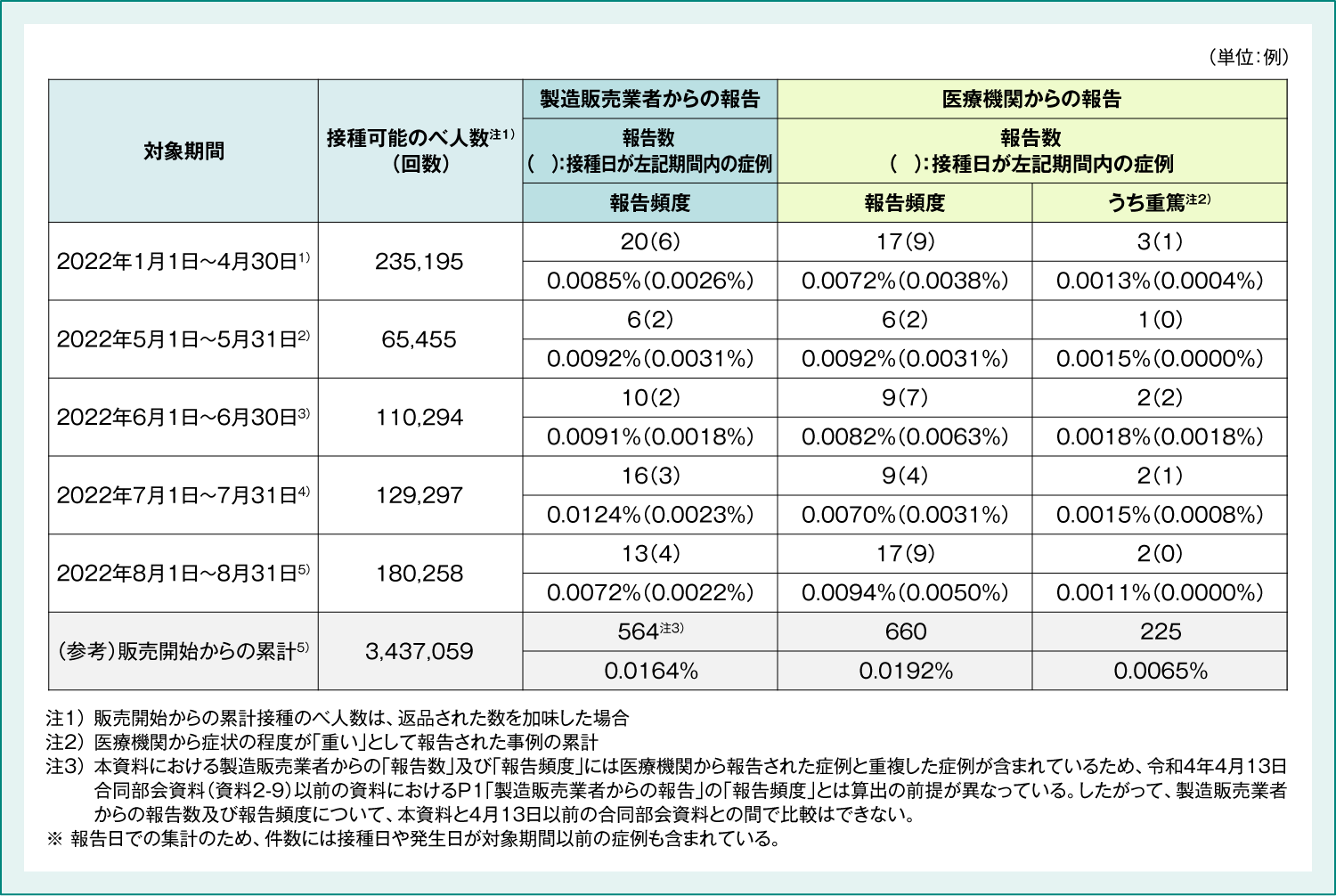
1) 厚生労働省 2022年6月10日 第80回厚生科学審議会予防接種・ワクチン分科会副反応検討部会 資料2-2
2) 厚生労働省 2022年7月8日 第81回厚生科学審議会予防接種・ワクチン分科会副反応検討部会 資料3-2
3) 厚生労働省 2022年8月5日 第82回厚生科学審議会予防接種・ワクチン分科会副反応検討部会 資料2-2
4) 厚生労働省 2022年9月2日 第83回厚生科学審議会予防接種・ワクチン分科会副反応検討部会 資料2-2
5) 厚生労働省 2022年10月7日 第85回厚生科学審議会予防接種・ワクチン分科会副反応検討部会 資料3-2
(Accessed Mar. 14, 2023)
表4:4価HPVワクチン 重篤例の転帰
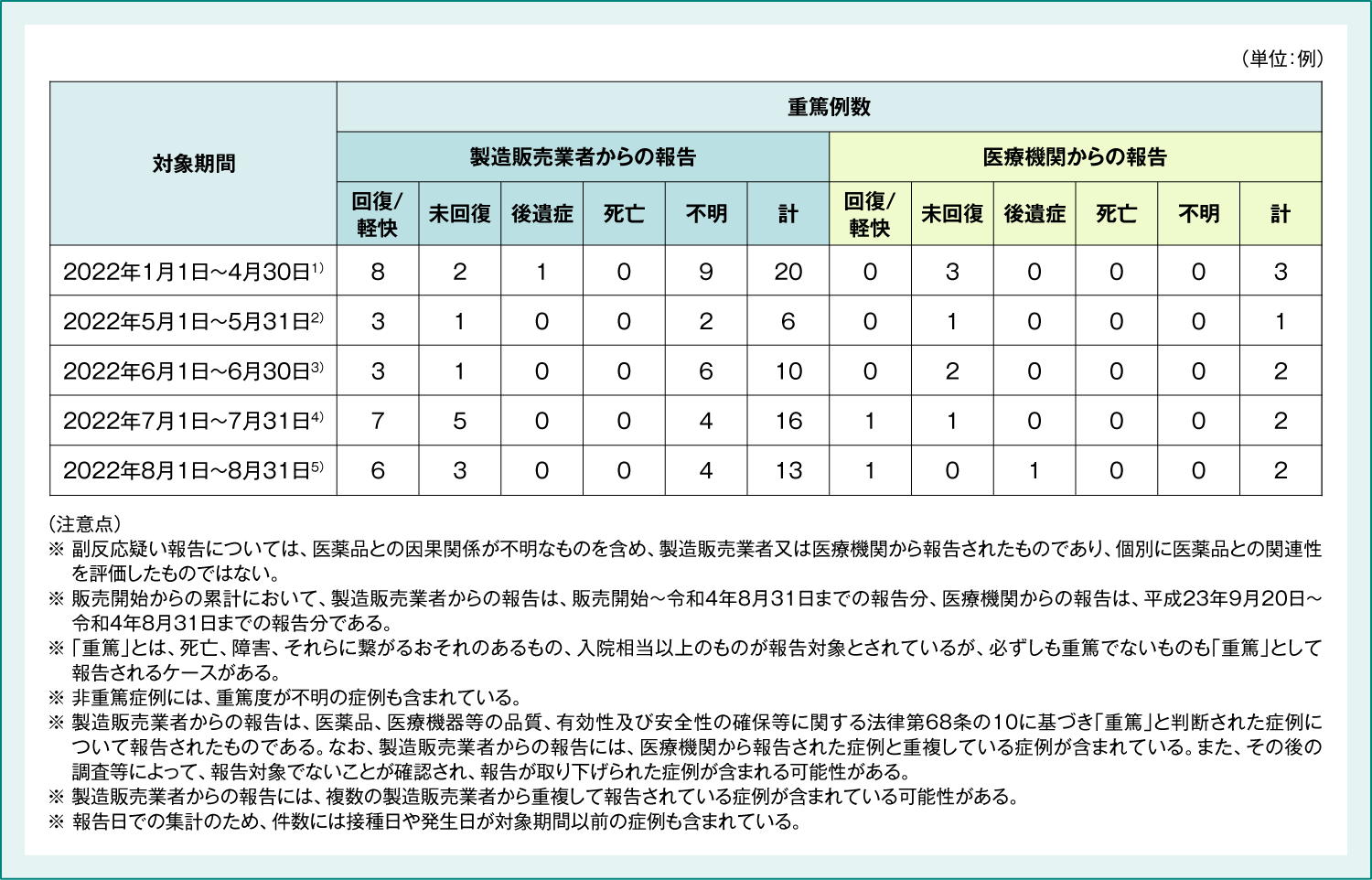
1) 厚生労働省 2022年6月10日 第80回厚生科学審議会予防接種・ワクチン分科会副反応検討部会 資料2-2
2) 厚生労働省 2022年7月8日 第81回厚生科学審議会予防接種・ワクチン分科会副反応検討部会 資料3-2
3) 厚生労働省 2022年8月5日 第82回厚生科学審議会予防接種・ワクチン分科会副反応検討部会 資料2-2
4) 厚生労働省 2022年9月2日 第83回厚生科学審議会予防接種・ワクチン分科会副反応検討部会 資料2-2
5) 厚生労働省 2022年10月7日 第85回厚生科学審議会予防接種・ワクチン分科会副反応検討部会 資料3-2
(Accessed Mar. 14, 2023)
9価HPVワクチン 副反応疑い報告数及び重篤例の転帰
9価HPVワクチンの副反応疑い報告数(表5)及び重篤例の転帰(表6)は以下のとおりでした。
表5:9価HPVワクチン 副反応疑い報告数
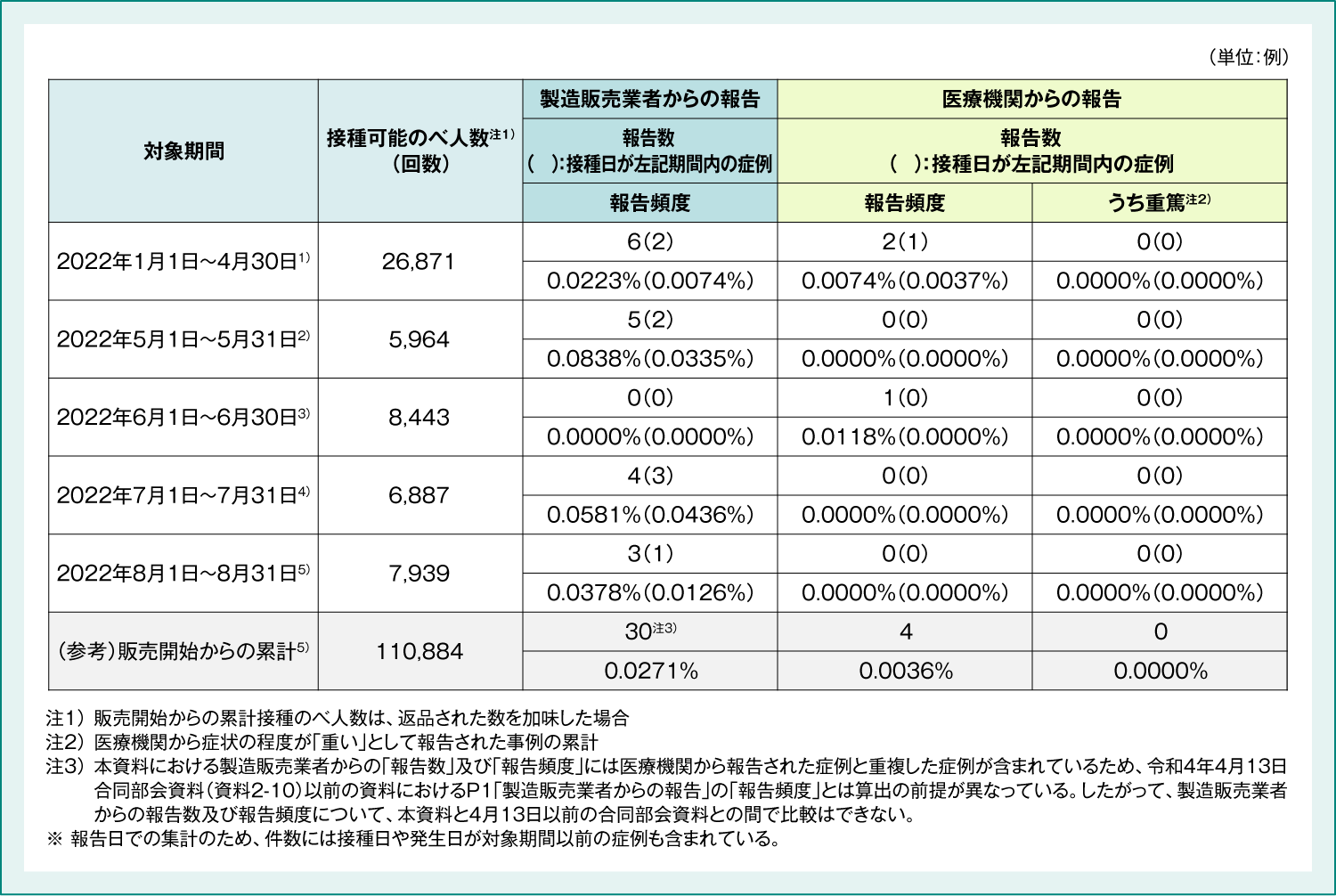
1) 厚生労働省 2022年6月10日 第80回厚生科学審議会予防接種・ワクチン分科会副反応検討部会 資料2-3
2) 厚生労働省 2022年7月8日 第81回厚生科学審議会予防接種・ワクチン分科会副反応検討部会 資料3-3
3) 厚生労働省 2022年8月5日 第82回厚生科学審議会予防接種・ワクチン分科会副反応検討部会 資料2-3
4) 厚生労働省 2022年9月2日 第83回厚生科学審議会予防接種・ワクチン分科会副反応検討部会 資料2-3
5) 厚生労働省 2022年10月7日 第85回厚生科学審議会予防接種・ワクチン分科会副反応検討部会 資料3-3
(Accessed Mar. 14, 2023)
表6:9価HPVワクチン 重篤例の転帰
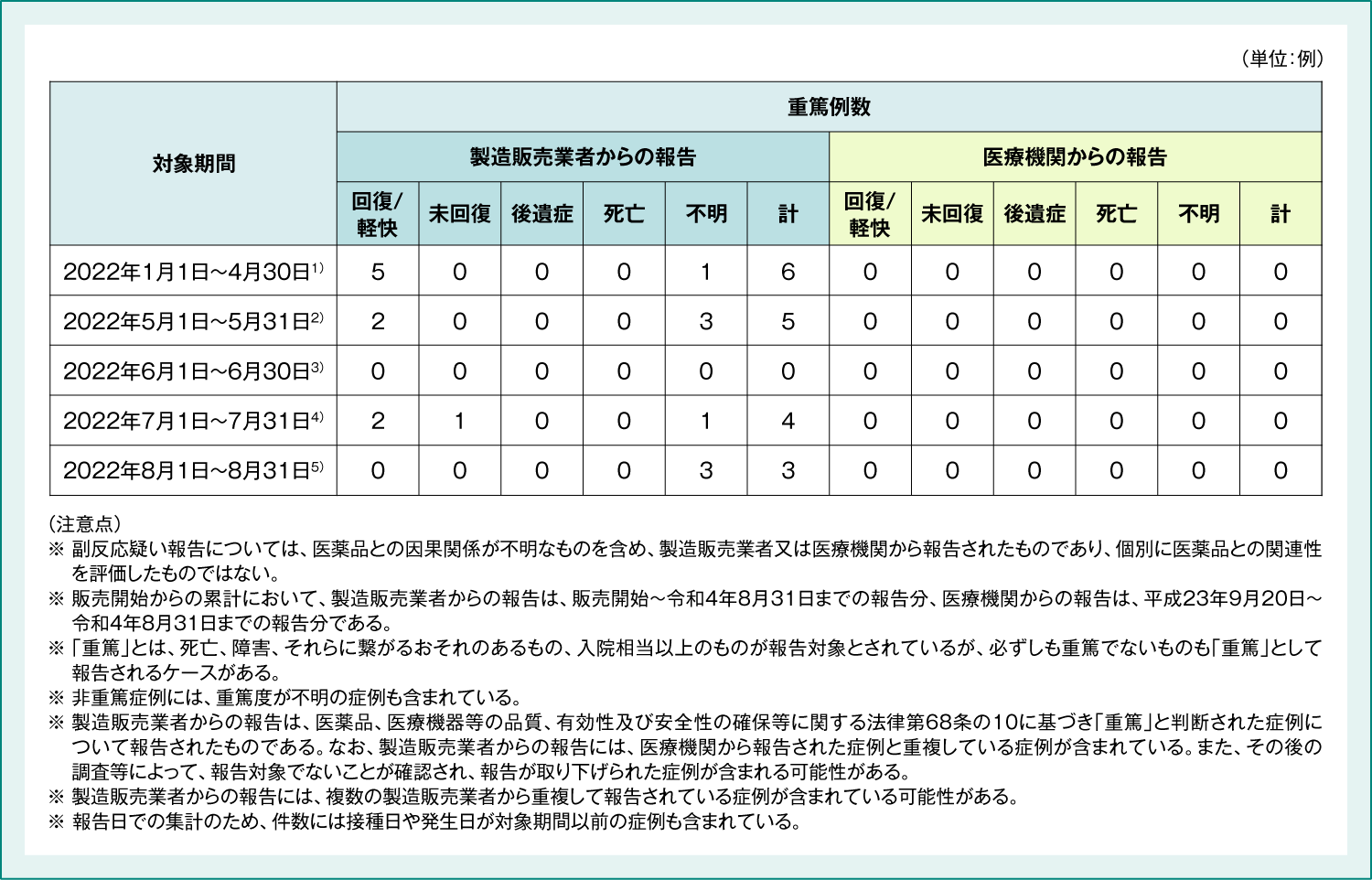
1) 厚生労働省 2022年6月10日 第80回厚生科学審議会予防接種・ワクチン分科会副反応検討部会 資料2-3
2) 厚生労働省 2022年7月8日 第81回厚生科学審議会予防接種・ワクチン分科会副反応検討部会 資料3-3
3) 厚生労働省 2022年8月5日 第82回厚生科学審議会予防接種・ワクチン分科会副反応検討部会 資料2-3
4) 厚生労働省 2022年9月2日 第83回厚生科学審議会予防接種・ワクチン分科会副反応検討部会 資料2-3
5) 厚生労働省 2022年10月7日 第85回厚生科学審議会予防接種・ワクチン分科会副反応検討部会 資料3-3
(Accessed Mar. 14, 2023)
HPVワクチン接種後に症状を呈した患者のサーベイランス
2022年10月の合同部会において、接種後に症状を呈した方の診療実態について、全国の協力医療機関に対してWebアンケートによる診療実態調査を行い(表7)、頻回かつ長期的フォローにより、受療実態を迅速に把握するとともに、患者の臨床像を丁寧に解析した結果が報告されました(表8)。
表7:HPVワクチン接種後に症状を呈した患者のサーベイランス 調査概要
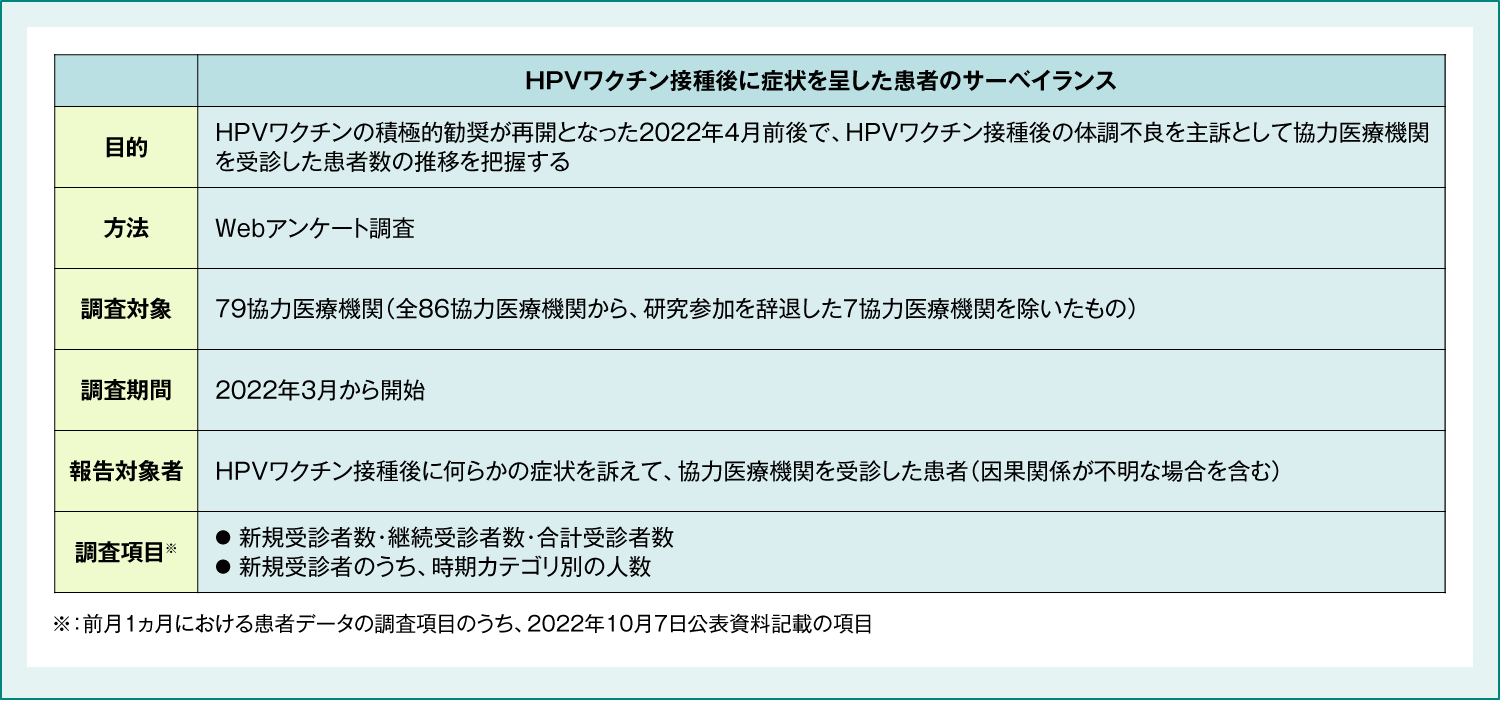
厚生労働省 2022年10月7日 第85回厚生科学審議会予防接種・ワクチン分科会副反応検討部会 資料3-8
https://www.mhlw.go.jp/stf/shingi2/0000208910_00052.html (Accessed Mar. 14, 2023)
表8:HPVワクチン接種後に症状を呈した患者のサーベイランス受診患者数 速報値(2022年9月23日時点)
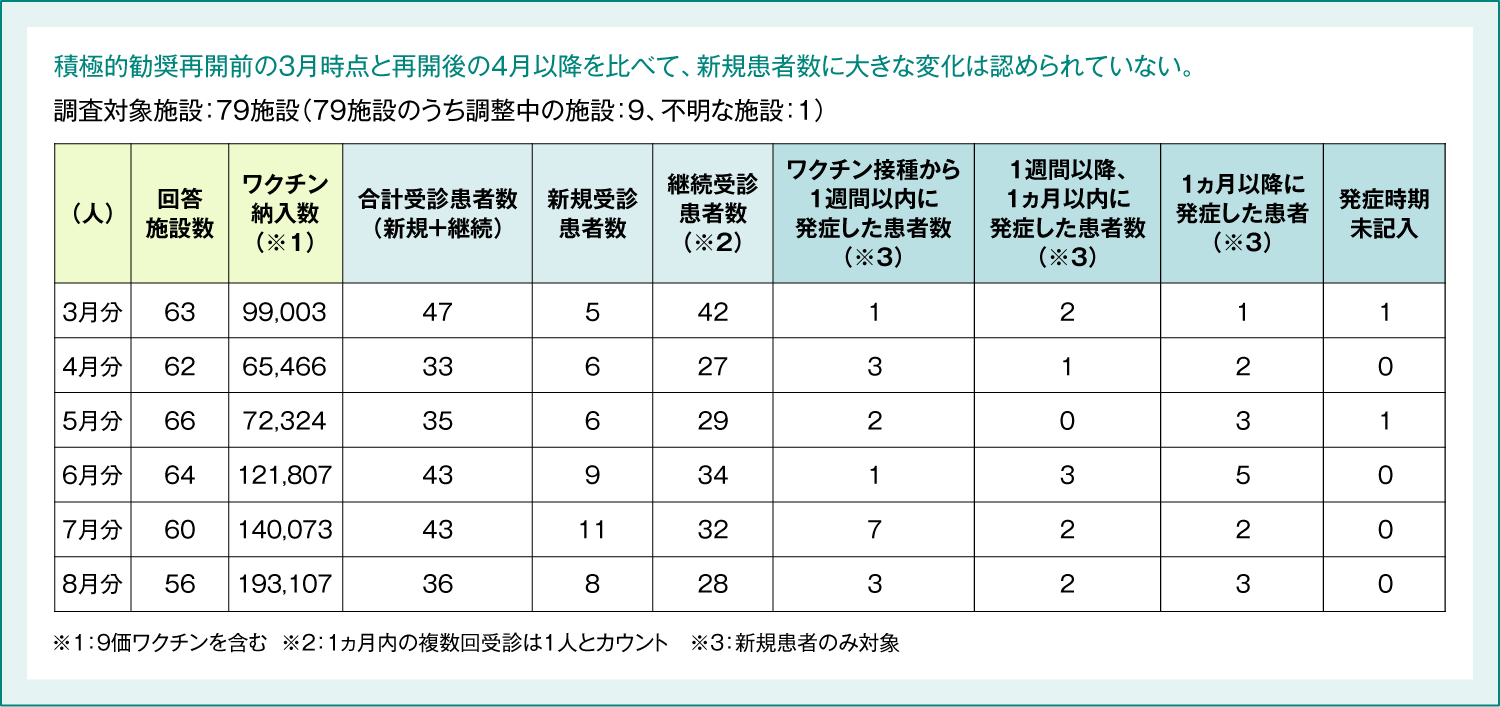
厚生労働省 2022年10月7日 第85回厚生科学審議会予防接種・ワクチン分科会副反応検討部会 資料3-8
https://www.mhlw.go.jp/stf/shingi2/0000208910_00052.html (Accessed Mar. 14, 2023)