シルガード®9
臨床試験成績
HPV関連疾患予防効果
●後期第Ⅱ相/第Ⅲ相無作為化4価HPVワクチン対照二重盲検試験(国際共同試験/検証的)の概要
承認時評価資料 国際共同試験(V503-001試験)(社内資料)
| 【目 的】 | シルガード®9群の免疫原性の非劣性※1および有効性※2、安全性をガーダシル®群と比較して検討する |
| 【試験デザイン】 | 無作為化、国際共同、二重盲検、ガーダシル®対照、用量反応、安全性/忍容性、免疫原性、有効性評価試験 |
| 【対 象】 | 16~26歳の女性14,204例(日本人女性254例を含む) |
| 【方 法】 | シルガード®9またはガーダシル®を0、2、6ヵ月の3回接種し、最長54ヵ月まで観察した。 |
| 【評 価 項 目】 | 主要評価項目: ●免疫原性(検証項目):3回目接種後4週時のHPV6/11/16/18型に対する抗体価の幾何平均(GMT) ●有効性※2(検証項目):HPV31/33/45/52/58型に関連したCIN 2/3、AIS、浸潤性子宮頸がん、VIN 2/3、VaIN 2/3、外陰がんまたは腟がんの複合発生率 ●安全性:有害事象 副次評価項目: ●HPV31/33/45/52/58型に関連した6ヵ月以上の持続感染の複合発生率 ●HPV31/33/45/52/58型に関連した子宮頸部、外陰および腟の疾患の複合発生率 ●Papテスト異常の発生率[ASC-US(高リスク型HPVに対して陽性)以上] 探索的評価項目: ●HPV31/33/45/52/58型に関連した12ヵ月以上の持続感染の複合発生率 ●HPV31/33/45/52/58型に関連したPapテスト異常の発生率 ●HPV31/33/45/52/58型に関連した子宮頸部生検および子宮頸部根治治療の実施率 その他の評価項目: HPV31/33/45/52/58型に関連したCIN1、CIN2/3またはAIS、VIN1/2/3、VaIN1/2/3、尖圭コンジローマの発生例数、HPV6/11/16/18型に関連した生殖器疾患または持続感染の複合発生率、HPV6/11/16/18/31/33/45/52/58型のGMT など |
| 【解 析 計 画】 | HPV6/11/16/18型については、シルガード®9の接種を受けた被験者における抗体価の幾何平均(GMT)がガーダシル®に対して非劣性※1であることを示すことにより、ガーダシル®の有効性データをシルガード®9に外挿した。非劣性について、有意水準片側2.5%を用いて各HPV型に対応する4つのANOVAモデルにより検定した。 有効性の主たる解析はPer-Protocol Efficacy(PPE)解析対象集団で実施した。PPE解析対象集団は、有効性の評価に影響を与えるような治験実施計画書からの重要な逸脱がなく、3回のワクチン接種を1年以内にすべて受け、該当するHPV型に対して1日目に血清抗体反応陰性かつ1日目から7ヵ月目までPCR陰性を示した被験者で構成された。 HPV31/33/45/52/58型については、シルガード®9の有効性を確認するために、ガーダシル®の臨床開発プログラムと同様の疾患、持続感染、細胞診断に関する項目を使用した。主要評価項目となる有効性について、統計的な成功基準は予防効果の95%信頼区間の下限が25%を超えることとし、有意水準片側2.5%を用いて正確な両側信頼区間により検定した。 予防効果、リスク減少率=[1-(シルガード®9群のイベント発生数/シルガード®9群の観察人年)/(ガーダシル®群のイベント発生数/ガーダシル®群の観察人年)]×100(%)とした。免疫原性は、抗体価の幾何平均値の95%信頼区間を算出した。 また、日本人部分集団を対象に、有効性、免疫原性および安全性について検討した。 |
※1:非劣性の定義は、各HPV型におけるGMTの群間比の95%信頼区間の下限が0.67より大きい(1.5倍以上減少しない)こととする
※2:有効性の主要解析は、主要評価項目であるイベントが30例以上に到達した時点で実施された
CIN:cervical intraepithelial neoplasia (子宮頸部上皮内腫瘍) AIS:adenocarcinoma in situ (上皮内腺がん)
VIN:vulvar intraepithelial neoplasia (外陰上皮内腫瘍) VaIN:vaginal intraepithelial neoplasia (腟上皮内腫瘍)
ASC-US:atypical squamous cells of undetermined significance (意義不明な異型扁平上皮細胞)
図1:国際共同後期第Ⅱ相/第Ⅲ相臨床試験(001試験)の試験デザイン
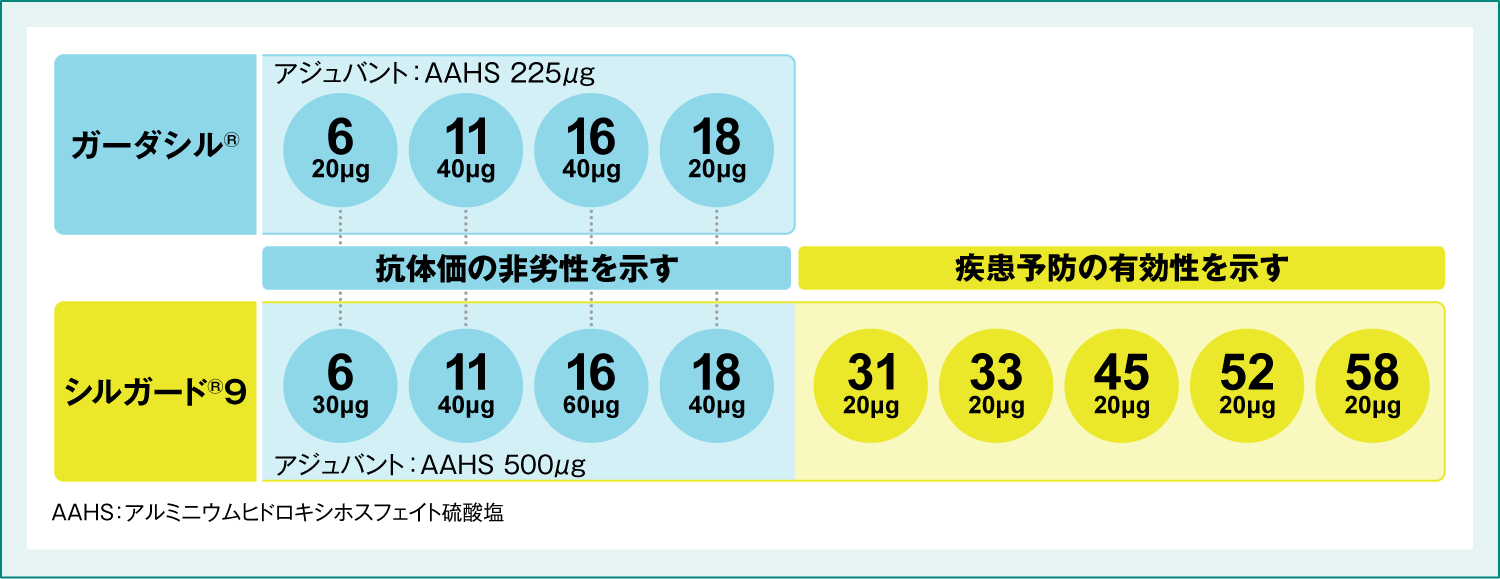
●国際共同後期第Ⅱ相/第Ⅲ相臨床試験(001試験)におけるシルガード®9の予防効果(主要評価項目ほか)
国際共同後期第Ⅱ相/第Ⅲ相臨床試験(001試験)において、主要評価項目であるHPV31、33、45、52、58型に関連したグレード2以上の子宮頸部上皮内腫瘍(CIN2/3)、上皮内腺がん(AIS)、外陰上皮内腫瘍(VIN2/3)および腟上皮内腫瘍(VaIN2/3)の発生率に対するシルガード®9の予防効果は96.7%(95%信頼区間:80.9、99.8)であり、ガーダシル®に対する優越性が検証されました※。また、HPV31、33、45、52、58型に関連した12ヵ月以上の持続感染に対する有効性は96.3%、CIN2/3、またはAISに対する有効性は96.3%、VIN1/2/3、VaIN1/2/3、または尖圭コンジローマに対する有効性は93.8%でした(表1)。
さらに、シルガード®9群のHPV6/11/16/18型の抗体価はガーダシル®群と比較して、非劣性であることが検証されました(図2)。
※:優越性の評価基準は95%信頼区間の下限値が25%より大きいこととする。p<0.0001(正確な両側信頼区間による検定、有意水準片側α=0.025)
表1:国際共同後期第Ⅱ相/第Ⅲ相臨床試験(001試験)におけるシルガード®9の予防効果
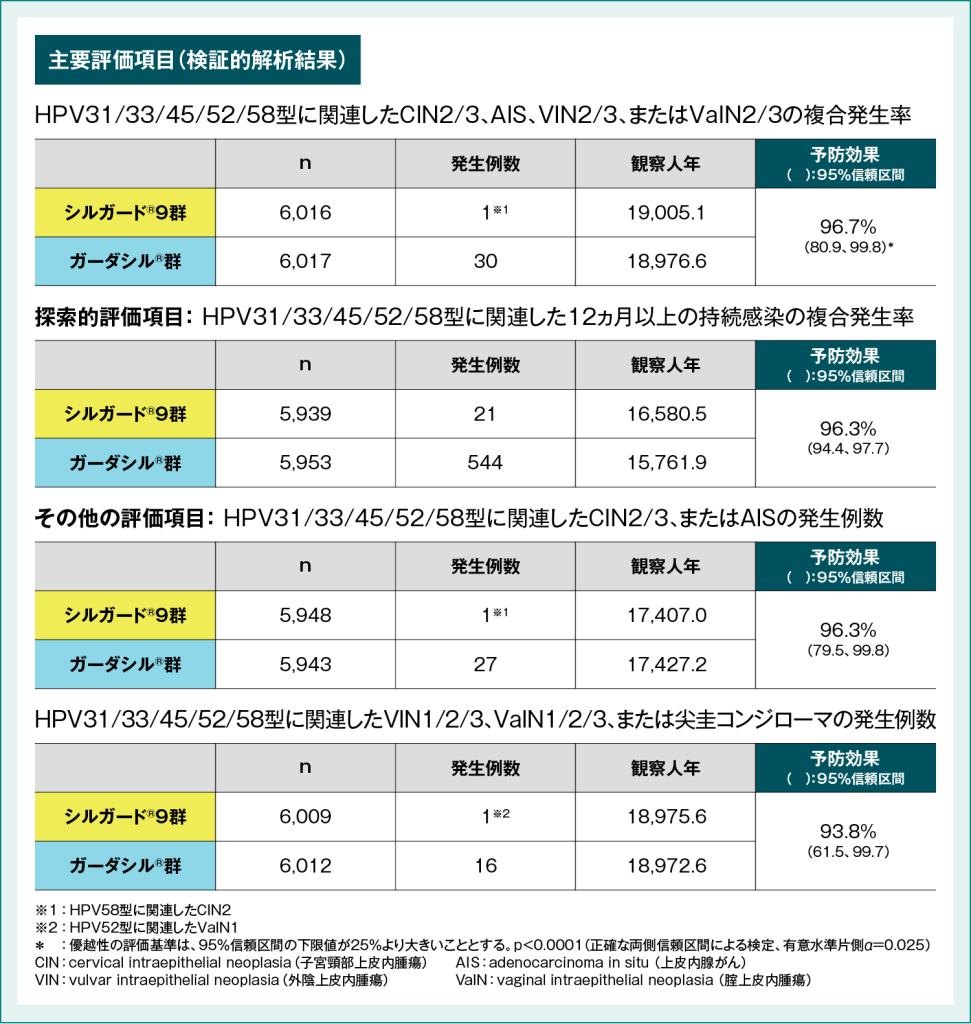
図2:国際共同後期第Ⅱ相/第Ⅲ相臨床試験(001試験)におけるシルガード®9の免疫原性

シルガード®9の安全性(主要評価項目)
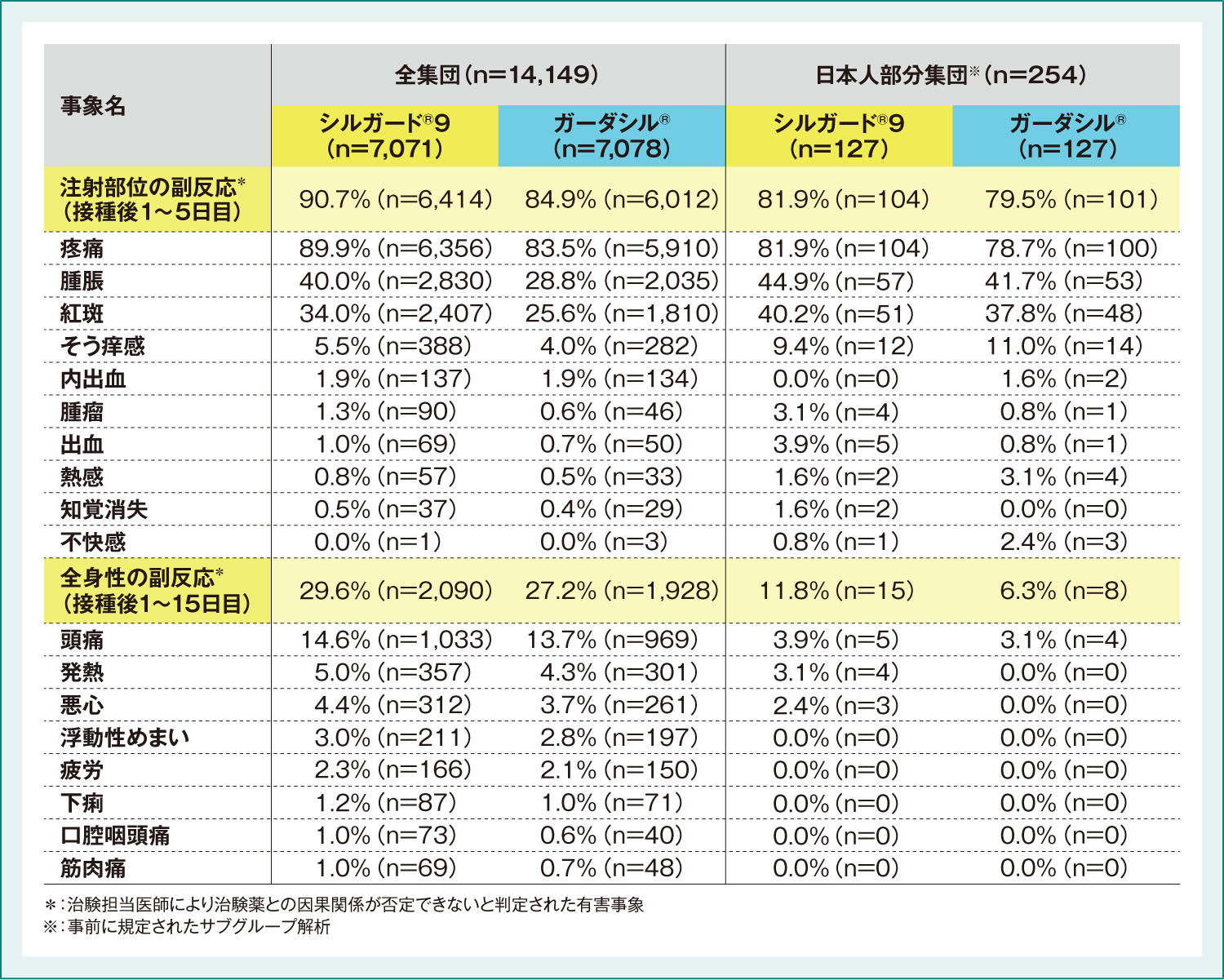
●国際共同後期第Ⅱ相/第Ⅲ相臨床試験(001試験)における有害事象
注射部位の副反応※は、シルガード®9接種後5日間に7,071例中6,414例(90.7%)に認められ、主なものは疼痛6, 356例(89. 9%)、腫脹2, 830例(40. 0%)、紅斑2, 407例(34. 0%)、そう痒感388例(5. 5%)、内出血137例(1.9%)、腫瘤90例(1.3%)、出血69例(1.0%)でした。また、ガーダシル®接種後5日間に7,078例中6,012例(84.9%)に認められ、主なものは疼痛5,910例(83.5%)、腫脹2,035例(28.8%)、紅斑1,810例(25.6%)、そう痒感282例(4.0%)、内出血134例(1.9%)でした。全身性の副反応※は、シルガード®9接種後15日間に7,071例中2,090例(29.6%)に認められ、主なものは頭痛1,033例(14.6%)、発熱357例(5.0%)、悪心312例(4.4%)、浮動性めまい211例(3.0%)、疲労166例(2.3%)、下痢87例(1.2%)、口腔咽頭痛73例(1.0%)、筋肉痛69例(1.0%)でした。また、ガーダシル®接種後15日間に7,078例中1,928例(27.2%)に認められ、主なものは頭痛969例(13.7%)、発熱301例(4.3%)、悪心261例(3.7%)、浮動性めまい197例(2.8%)、疲労150例(2.1%)、下痢71例(1.0%)でした。
また、日本人においては、注射部位の副反応※はシルガード®9接種後5日間に127例中104例(81.9%)に認められ、主なものは疼痛104例(81.9%)、腫脹57例(44.9%)、紅斑51例(40.2%)、そう痒感12例(9.4%)、出血5例(3.9%)、腫瘤4例(3.1%)、熱感2例(1.6%)、知覚消失2例(1.6%)でした。また、ガーダシル®接種後5日間に127例中101例(79.5%)に認められ、主なものは疼痛100例(78.7%)、腫脹53例(41.7%)、紅斑48例(37.8%)、そう痒感14例(11.0%)、熱感4例(3.1%)、不快感3例(2.4%)、内出血2例(1.6%)でした。全身性の副反応※はシルガード®9接種後15日間に127例中15例(11.8%)に認められ、主なものは頭痛5例(3.9%)、発熱4例(3.1%)、悪心3例(2.4%)でした。また、ガーダシル®接種後15日間に127例中8例(6.3%)に認められ、主なものは頭痛4例(3.1%)でした。
薬剤との関連性が否定されない死亡例はいずれの群においても認められませんでした。
接種後15日間の重篤な副反応※は、シルガード®9群で2例2件(発熱、アレルギー反応)に、ガーダシル®群で1例1件(頭痛)に認められました。
中止に至った副反応※は、シルガード®9群で5例11件(無力症、浮動性めまい、疲労、多汗症、注射部位疼痛、悪心、疼痛、発熱、頭痛、注射部位腫脹、ワクチンアレルギー)に、ガーダシル®群で3例3件(丘疹、舌腫脹、蕁麻疹)に認められました。
※:治験担当医師により治験薬との因果関係が否定できないと判定された有害事象
表2:国際共同後期第Ⅱ相/第Ⅲ相臨床試験(001試験)における主な副反応*発現頻度(いずれかの接種群で発現率1%以上)
5. 効能又は効果に関連する注意
5.1 HPV6、11、16、18、31、33、45、52及び58型以外のHPV感染に起因する子宮頸癌又はその前駆病変等の予防効果は確認されていない。
5.2 接種時に感染が成立しているHPVの排除及び既に生じているHPV関連の病変の進行予防効果は期待できない。
5.3 本剤の接種は定期的な子宮頸癌検診の代わりとなるものではない。本剤接種に加え、子宮頸癌検診の受診やHPV への曝露、性感染症に対し注意することが重要である。
5.4 本剤の予防効果の持続期間は確立していない。
シルガード®9の2回接種における免疫原性および安全性
本試験は、9~15歳の日本人健康男女を対象とした試験ですが、9~14歳女性のシルガード®9の2回接種の結果について記載しています。
●国内第Ⅲ相試験(066試験)の概要
承認時評価資料 国内第Ⅲ相試験(066試験)(社内資料)
| 【目 的】 | シルガード®9の2回接種における免疫原性および安全性/忍容性を検討する |
| 【試験デザイン】 | 非盲検、多施設共同試験 |
| 【対 象】 | 9~14歳の日本人女性105例 |
| 【方 法】 | シルガード®9を初回および6ヵ月の2回接種し、最終接種1ヵ月後(7ヵ月目)までの免疫原性および安全性/忍容性を検討した |
| 【主要評価項目】 | ● 免疫原性:各HPV型(6、11、16、18、31、33、45、52および58型)の抗体陽転率 ● 安全性:有害事象 |
| 【解 析 計 画】 | ● 免疫原性の主要解析は、Per Protocol Immunogenicity(PPI)解析対象集団で実施した。PPI解析対象集団は、事前に規定した期間内にシルガード®9の接種を2回とも受け、6ヵ月時と7ヵ月時の来院の間隔が事前に規定した基準を満たし、2回目の接種から21~49日以内に評価可能な血清検体の検査結果が得られ、治験実施計画書からの重大な逸脱がなく、また該当する各HPV型に対して、初回接種前に未感染(血清反応陰性)であった被験者で構成された。抗体陽転率の推定では、最終接種1ヵ月後に抗体陽転した被験者の割合を計算し、抗体陽転率の点推定値を計算した。対応する95%信頼区間の計算には、Clopper and Pearson(1934)による二項分布に基づく正確法を用いた。 ● 安全性は、シルガード®9の接種を1回以上受け、追跡調査データが得られたすべての被験者を解析対象集団とし、事前に規定した注射部位の有害事象や最高体温等を記録するワクチン日誌を用いて安全性調査を実施した。 |
図3:国内第Ⅲ相試験(066試験)の試験方法
●国内第Ⅲ相試験(066試験)における免疫原性(主要評価項目)
シルガード®9の2回目接種1ヵ月後(7ヵ月目)の抗体陽転率はいずれも100%でした(表3)。
表3:国内第Ⅲ相試験(066試験)における各HPV型(6、11、16、18、31、33、45、52および58型)の抗体陽転率※
●国内第Ⅲ相試験(066試験)における安全性(主要評価項目)
注射部位の副反応*は、シルガード®9接種後5日間に104例中92例(88.5%)に認められ、主なものは疼痛91例(87.5%)、腫脹29例(27.9%)、紅斑20例(19.2%)、そう痒感18例(17.3%)でした。
また、全身性の副反応*は、シルガード®9接種後15日間に104例中16例(15.4%)に認められ、主なものは発熱7例(6.7%)、頭痛3例(2.9%)でした。
重篤な副反応*、接種中止に至った副反応*および死亡例は認められませんでした。
表4:国内第Ⅲ相試験(066試験)における副反応*発現率
*:治験担当医師により治験薬との因果関係が否定できないと判定された有害事象