侵襲性真菌症の予防投与:化学療法患者
ノクサフィル®の侵襲性真菌症の予防効果に関するエビデンスは、日本人患者を対象とした予防投与の臨床試験を新たに実施することなく、承認時評価資料である海外臨床試験データに基づいて承認されており、国内の承認内容とは異なる製剤(経口懸濁液)を用いた成績が含まれています。
臨床成績
侵襲性真菌症の予防投与:化学療法患者
海外第Ⅲ相試験(P01899試験)1), 2)
血液悪性腫瘍疾患に対する化学療法に伴う好中球減少症が確認/予測される患者における侵襲性真菌症に対する予防効果(検証試験、海外データ)
1)承認時評価資料(侵襲性真菌症予防に対する海外第Ⅲ相試験:P01899試験)
2)Cornely OA et al. N Engl J Med. 2007;356(4):348-359
利益相反:本研究はSchering-Plough(現MSD)の資金により行われた
試験概要
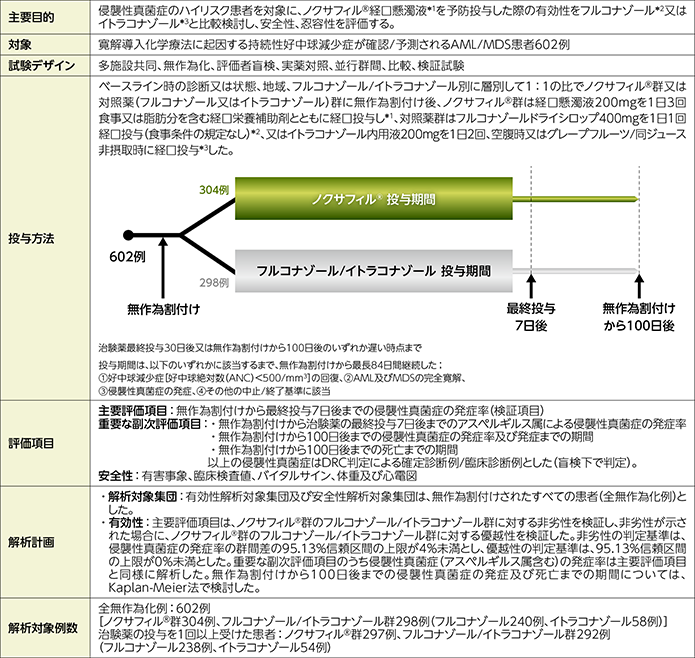
AML:急性骨髄性白血病、MDS:骨髄異形成症候群、DRC:データレビュー委員会
*1:国内未承認の剤形、用法及び用量 *2:国内未承認の効能又は効果 *3:国内未承認の用法及び用量
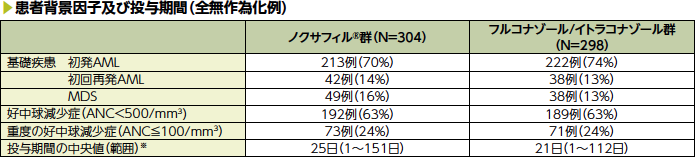
AML:急性骨髄性白血病、MDS:骨髄異形成症候群、ANC:好中球絶対数
※:ノクサフィル®群の7例、フルコナゾール/イトラコナゾール群の6例は、無作為割付けされたが治験薬の投与を一度も受けなかった。
有効性
1)無作為割付けから最終投与7日後/100日後までの侵襲性真菌症の発症率
(主要評価項目、非劣性試験、検証的解析結果/重要な副次評価項目)
無作為割付けから治験薬の最終投与7日後における侵襲性真菌症※の発症率(主要評価項目、非劣性試験、検証的解析結果)は、ノクサフィル®群2%(7/304例)、フルコナゾール/イトラコナゾール群8%(25/298例)でした。発症率の群間差[(ノクサフィル®群)-(フルコナゾール/イトラコナゾール群)](95.13%信頼区間)は、-6.09%(-9.68~-2.50%)であり、事前に規定した標準的アゾール系抗真菌薬(フルコナゾール/イトラコナゾール)群に対するノクサフィル®群の非劣性の基準(信頼区間上限値が4%未満)及び優越性の基準(信頼区間上限値が0%未満)が満たされ、フルコナゾール/イトラコナゾール群に対するノクサフィル®群の非劣性並びに優越性が検証されました(P=0.0009:χ2検定)。
重要な副次評価項目である最終投与7日後におけるアスペルギルス属による侵襲性真菌症※の発症率はノクサフィル®群で1%、フルコナゾール/イトラコナゾール群で7%、無作為割付けから100日後までの侵襲性真菌症※の発症率はノクサフィル®群で5%、フルコナゾール/イトラコナゾール群で11%でした。
※:DRC判定による確定診断例又は臨床診断例
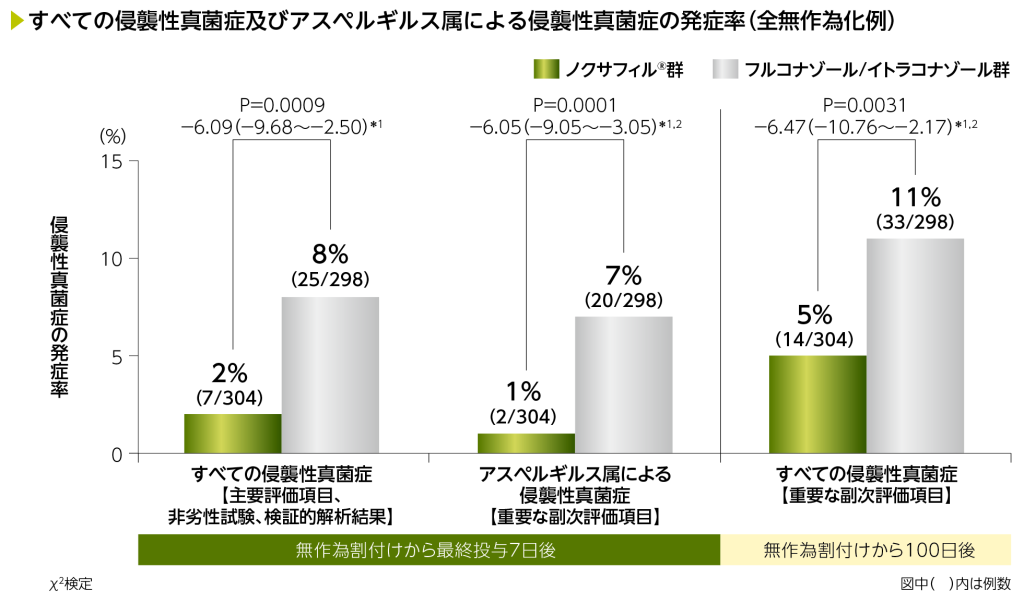
*1:群間差[(ノクサフィル®群)-(フルコナゾール/イトラコナゾール群)]%(95.13%信頼区間)
*2:名目上のP値
主要評価項目におけるノクサフィル®群-フルコナゾール/イトラコナゾール群の群間差(95.13%信頼区間)は‒6.09%(‒9.68~‒2.50)であり、フルコナゾール/イトラコナゾール群に対するノクサフィル®群の非劣性の基準(信頼区間上限値が4%未満)だけでなく、優越性の基準(信頼区間上限値が0%未満)も満たされたことから、フルコナゾール/イトラコナゾール群に対するノクサフィル®群の非劣性ならびに優越性が検証された。
DRC:データレビュー委員会
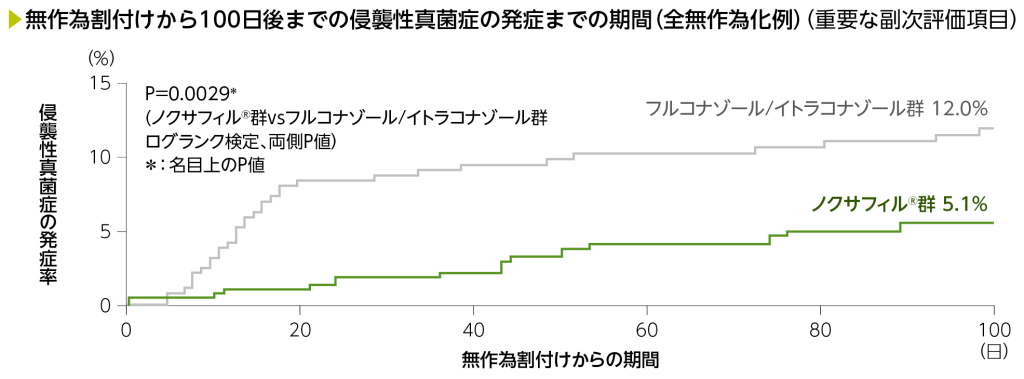
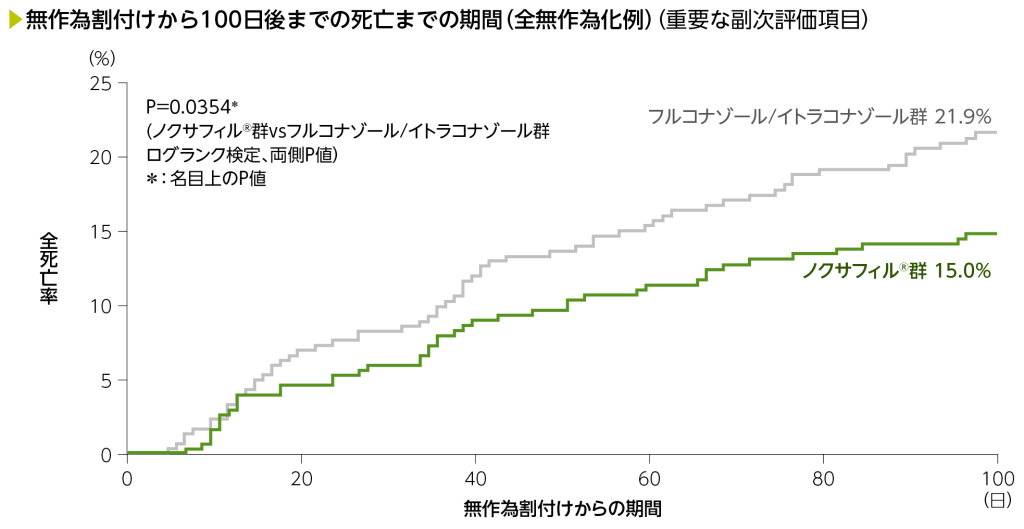
2)無作為割付けから100日後までの侵襲性真菌症の発症及び死亡までの期間(重要な副次評価項目)
Kaplan-Meier法による無作為割付けから100日後までの侵襲性真菌症の累積発症率は、ノクサフィル®群5.1%、フルコナゾール/イトラコナゾール群で12.0%でした。また、無作為割付けから100日後までの死亡の累積発生率はノクサフィル®群15.0%、フルコナゾール/イトラコナゾール群で21.9%でした。
安全性
副作用は、ノクサフィル®群304例中102例(34%)、フルコナゾール/イトラコナゾール群298例中101例(34%)に認められました。
主な副作用は、ノクサフィル®群で悪心22例(7%)、下痢20例(7%)、嘔吐14例(5%)、フルコナゾール/イトラコナゾール群で悪心25例(8%)、下痢21例(7%)、嘔吐20例(7%)などでした。
重篤な副作用は、ノクサフィル®群で19例、フルコナゾール/イトラコナゾール群で6例であり、発現頻度の高かった重篤な副作用は、ノクサフィル®群でビリルビン血症5例、フルコナゾール/イトラコナゾール群でビリルビン血症3例でした。
投与中止に至った副作用は、ノクサフィル®群で25例、フルコナゾール/イトラコナゾール群で25例であり、主な投与中止に至った副作用は、ノクサフィル®群でQT/QTc延長6例、肝酵素上昇4例、下痢及び悪心各2例、フルコナゾール/イトラコナゾール群で下痢及び嘔吐各4例、悪心及びQT/QTc延長各2例などでした。
死亡に至った副作用は、ノクサフィル®群の2例3件(ビリルビン血症/脳症1例、肝不全1例)であり、フルコナゾール/イトラコナゾール群では認められませんでした。
- フルコナゾールの効能又は効果は「造血幹細胞移植患者における深在性真菌症の予防」です。
- イトラコナゾールの好中球減少が予測される血液悪性腫瘍又は造血幹細胞移植患者における深在性真菌症の予防の用法及び用量は、「通常、成人には20mL(イトラコナゾールとして200mg)を1日1回空腹時に経口投与する。なお、患者の状態などにより適宜増減する。ただし、1回量の最大は20mL、1日量の最大は40mLとする。」です。
詳細は製品電子添文をご参照ください。
注意:本邦で承認されたノクサフィル®の剤形は錠剤又は静注液です。
6. 用法及び用量
錠100mg
通常、成人にはポサコナゾールとして初日は1回300mgを1日2回、2日目以降は300mgを1日1回経口投与する。
点滴静注300mg
通常、成人にはポサコナゾールとして初日は1回300mgを1日2回、2日目以降は300mgを1日1回、中心静脈ラインから約90分間かけて緩徐に点滴静注する。
7. 用法及び用量に関連する注意 ―抜粋―
〈造血幹細胞移植患者又は好中球減少が予測される血液悪性腫瘍患者における深在性真菌症の予防〉
7.2 投与期間は好中球減少症又は免疫抑制からの回復に基づき設定すること。急性骨髄性白血病又は骨髄異形成症候群の患者では、好中球減少症の発症が予測される数日前に本剤による予防を開始し、好中球数が500 cells/mm3以上に増加後、7日間程度投与を継続すること。
【禁忌を含む注意事項等情報】 等はこちらをご参照ください。