侵襲性真菌症の予防投与:HSCT患者
ノクサフィル®の侵襲性真菌症の予防効果に関するエビデンスは、日本人患者を対象とした予防投与の臨床試験を新たに実施することなく、承認時評価資料である海外臨床試験データに基づいて承認されており、国内の承認内容とは異なる製剤(経口懸濁液)を用いた成績が含まれています。
臨床成績
侵襲性真菌症の予防投与:HSCT患者
海外第Ⅲ相試験(C/I98-316試験)1), 2)
同種造血幹細胞移植後の移植片対宿主病患者における侵襲性真菌症に対する予防効果(検証試験、海外データ)
1)承認時評価資料(侵襲性真菌症予防に対する海外第Ⅲ相試験:C/I98-316試験)
2)Ullmann AJ et al. N Engl J Med. 2007;356(4):335-347
利益相反:本研究はSchering-Plough(現MSD)の資金により行われた
試験概要
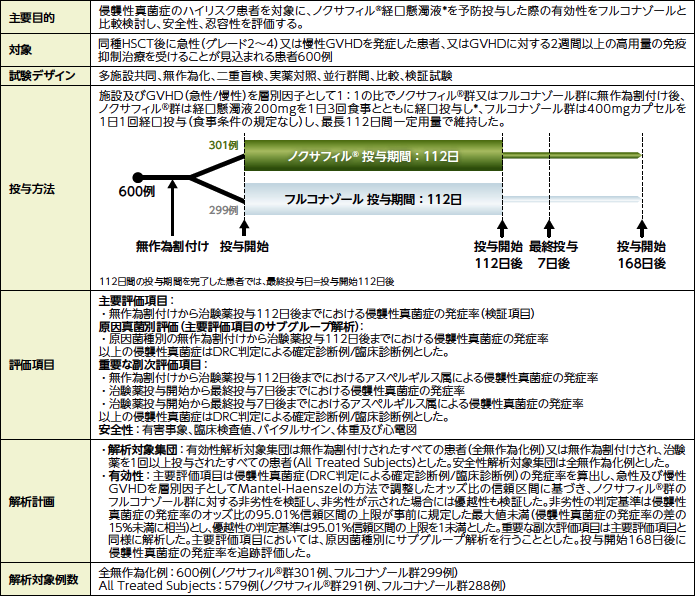
HSCT:造血幹細胞移植、GVHD:移植片対宿主病、DRC:データレビュー委員会
*:国内未承認の剤形、用法及び用量
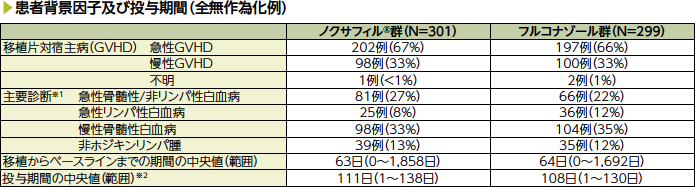
※1:主要診断を複数回受けた患者はそれぞれの主要診断カテゴリでカウントした(いずれかの群で10%以上を表示)。
※2:ノクサフィル®️群の10例及びフルコナゾール群の11例(無作為割付けされたが治験薬の投与を一度も受けなかった)を除く。
有効性
1)無作為割付けから投与112日後/投与開始から最終投与7日後までの侵襲性真菌症の発症率
(主要評価項目、非劣性試験、検証的解析結果/重要な副次評価項目)
無作為割付けから治験薬投与112日後までの侵襲性真菌症※の発症率(主要評価項目、非劣性試験、検証的解析結果)は、ノクサフィル®群5%(16/301例)、フルコナゾール群9%(27/299例)でした。侵襲性真菌症の発症率のオッズ比は0.5614と推定され、その95.01%信頼区間は0.2959~1.0651でした。95.01%信頼区間の上限が事前に規定した最大値(侵襲性真菌症の発症率の15%の差に相当)の1.1625未満であったため、ノクサフィル®群のフルコナゾール群に対する非劣性が検証されましたが、95.01%信頼区間の上限が1以上であったため、優越性は示されませんでした。
重要な副次評価項目であるアスペルギルス属による侵襲性真菌症※の発症率、投与開始から最終投与7日後の侵襲性真菌症※及びアスペルギルス属による侵襲性真菌症※の発症率は以下のとおりでした。
※:DRC判定による確定診断例又は臨床診断例
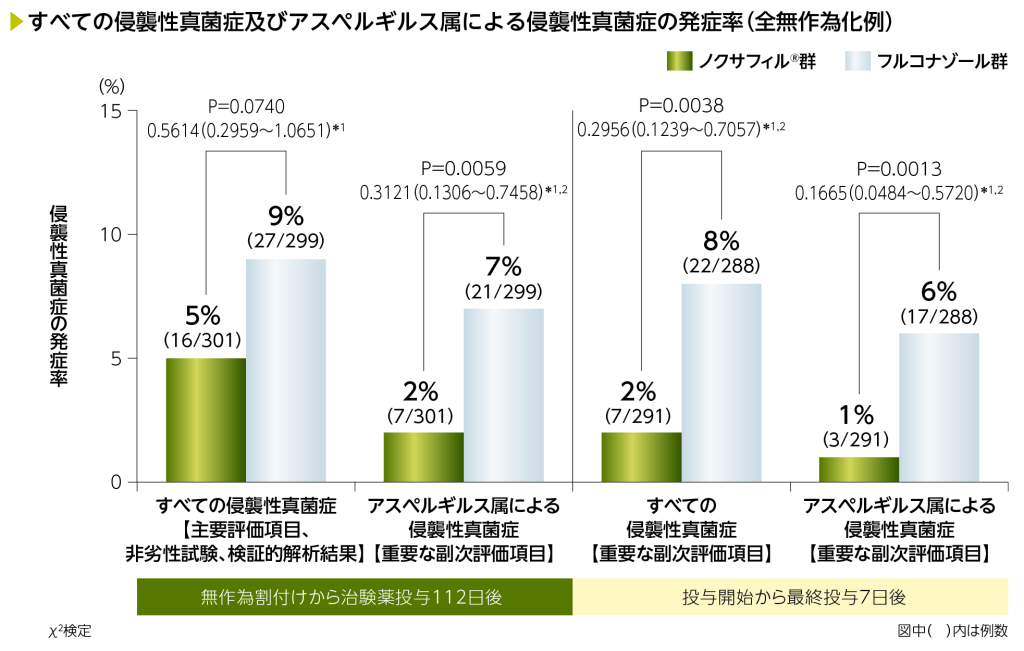
*1:ベースライン時のGVHD分類(急性又は慢性)で調整したMantel-Haenszel検定
*2:名目上のP値
主要評価項目であるすべての侵襲性真菌症の発症率のオッズ比は0.5614と推定され、その95.01%信頼区間は0.2959~1.0651であった。95.01%信頼区間の上限が事前に規定した最大値(侵襲性真菌症の発症率の15%の差に相当)の1.1625未満であったため、ノクサフィル®群のフルコナゾール群に対する非劣性が検証されたが、95.01%CIの上限が1以上であったため、優越性は示されなかった。
DRC:データレビュー委員会
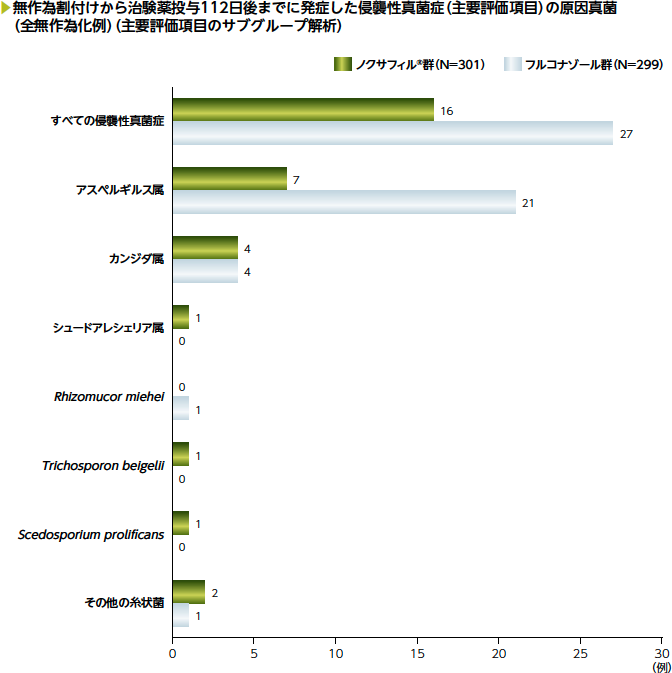
2)原因菌種別の無作為割付けから治験薬投与112日後までにおける侵襲性真菌症の内訳
(主要評価項目のサブグループ解析)
侵襲性真菌症(DRC判定による確定診断例/臨床診断例)を発症した43例の原因真菌は、アスペルギルス属(ノクサフィル®群7/16例、フルコナゾール群21/27例)、カンジダ属(各群4例)等でした。なお、フルコナゾール耐性菌が38/43例(ノクサフィル®群14例、フルコナゾール群24例)で検出されました。
安全性
副作用は、ノクサフィル®群301例中107例(36%)、フルコナゾール群299例中115例(38%)に認められました。主な副作用は、ノクサフィル®群で悪心22例(7%)、嘔吐13例(4%)、γ-GTP増加及び血清ALT増加各9例(3%)、フルコナゾール群で悪心28例(9%)、嘔吐15例(5%)、下痢12例(4%)などでした。
重篤な副作用はノクサフィル®群40例、フルコナゾール群29例であり、発現頻度の高かった重篤な副作用は、ノクサフィル®群で肝酵素上昇6例、γ-GTP増加5例、フルコナゾール群でγ-GTP増加 3例、肝酵素上昇1例でした。投与中止に至った副作用はノクサフィル®群33例、フルコナゾール群37例であり、発現頻度の高かった投与中止に至った副作用は、ノクサフィル®群で悪心10例、嘔吐7例、肝酵素上昇6例、フルコナゾール群で嘔吐7例、悪心6例、肝酵素上昇2例でした。
死亡に至った副作用は、ノクサフィル®群の薬物毒性NOS及び脳症各1例、フルコナゾール群の腎不全1例でした。
NOS:特定不能
注意:本邦で承認されたノクサフィル®の剤形は錠剤又は静注液です。
6. 用法及び用量
錠100mg
通常、成人にはポサコナゾールとして初日は1回300mgを1日2回、2日目以降は300mgを1日1回経口投与する。
点滴静注300mg
通常、成人にはポサコナゾールとして初日は1回300mgを1日2回、2日目以降は300mgを1日1回、中心静脈ラインから約90分間かけて緩徐に点滴静注する。
7. 用法及び用量に関連する注意 ―抜粋―
〈造血幹細胞移植患者又は好中球減少が予測される血液悪性腫瘍患者における深在性真菌症の予防〉
7.2 投与期間は好中球減少症又は免疫抑制からの回復に基づき設定すること。急性骨髄性白血病又は骨髄異形成症候群の患者では、好中球減少症の発症が予測される数日前に本剤による予防を開始し、好中球数が500 cells/mm3以上に増加後、7日間程度投与を継続すること。
【禁忌を含む注意事項等情報】 等はこちらをご参照ください。