ラゲブリオ®の軌跡・剤形
ラゲブリオ®の軌跡・剤形
ラゲブリオ®の軌跡
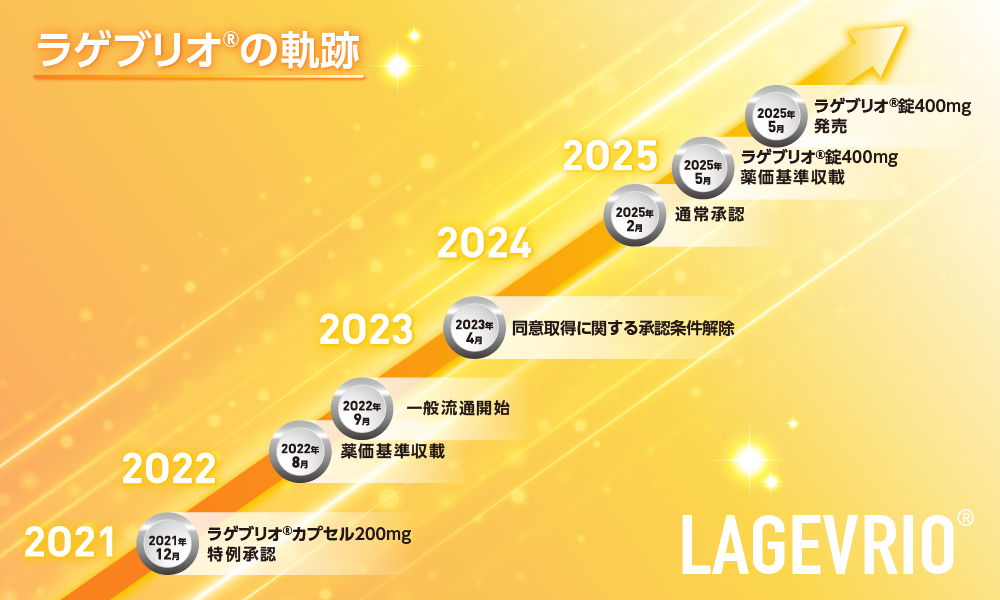
ラゲブリオ®カプセル200mgは、2021年12月に特例承認され、国購入品として配分が開始されました。その後、 2022年8月に薬価基準収載、同年9月には一般流通が開始され、2023年4月には同意取得に関する承認条件が解除、文書による患者からの同意取得が不要となり、2025年2月に通常承認を受けました。同年5月にラゲブリオ®錠400mgが薬価基準収載され、発売しました。
ラゲブリオ®の投与方法
ラゲブリオ®は1回800mgを1日2回、5日間経口投与します。

1回4カプセルを1日2回、5日間投与


1回2錠を1日2回、5日間投与

※ラゲブリオ®は1ボトル(40カプセル又は20錠)が、一人分です。
【用法及び用量】
通常、18歳以上の患者には、モルヌピラビルとして1回800mgを1日2回、5日間経口投与する。
【用法及び用量に関連する注意】
SARS-CoV-2による感染症の症状が発現してから速やかに投与を開始すること。臨床試験において、症状発現から6日目以降に投与を開始した患者における有効性を裏付けるデータは得られていない。[17.1.1 参照]
ラゲブリオ®錠400mgとラゲブリオ®カプセル200mgの生物学的同等性(外国人データ)1,2)
クロスオーバー法により健康成人にモルヌピラビル錠又はモルヌピラビルカプセルを400mgの用量で単回経口投与した際、得られたNHCの血漿中Cmax及びAUC0-lastの幾何平均比とその90%信頼区間(モルヌピラビル錠/モルヌピラビルカプセル)は、それぞれ0.98(0.93-1.03)及び1.00(0.97-1.03)でした。幾何平均比の90%信頼区間は事前に規定した同等域[0.8~1.25]の範囲内であり、モルヌピラビル錠はモルヌピラビルカプセルと生物学的に同等でした。
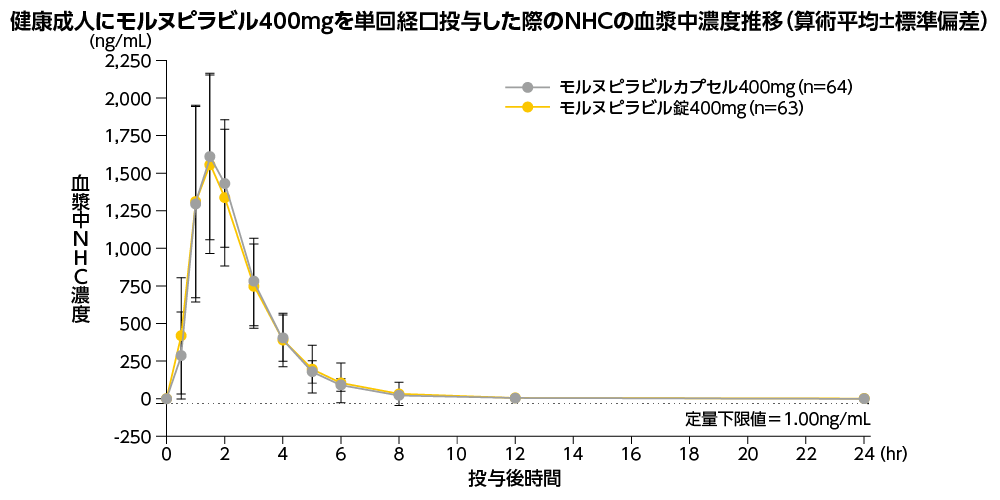
※1例が心電図異常の有害事象により試験を中止したため、当該症例の第2期でモルヌピラビル錠400mgを投与した際の濃度データは得られなかった。
1)承認時評価資料:健康成人を対象とした生物学的同等性試験(MK-4482-011試験)
2)Fiore JL et al. Antimicrob Agents Chemother. 2025; 69(3): e0143424.
https://creativecommons.org/licenses/by/4.0/
本試験はMSDより資金提供を受けている。本論文の著者には同社の社員が含まれる。