血漿中濃度
血漿中濃度
1.単回投与
(1)単回投与(健康成人)1)
日本人健康成人にザバクサ®を60分かけて点滴静注で単回投与した際のタゾバクタム及びセフトロザンの血漿中濃度推移及び薬物動態パラメータを以下に示す。タゾバクタム及びセフトロザンのCmax及びAUC0-∞は用量に比例して増加した。
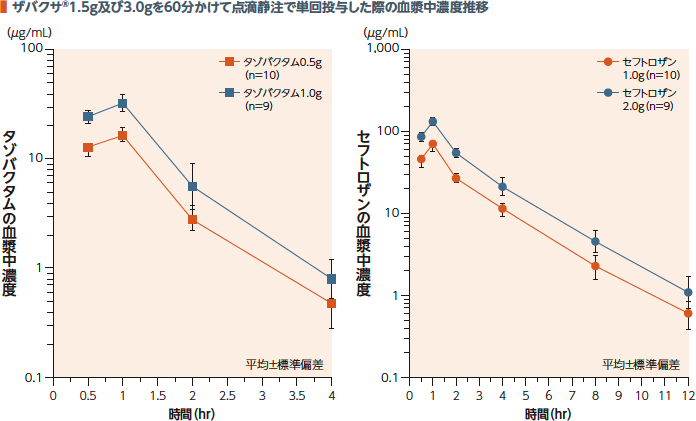
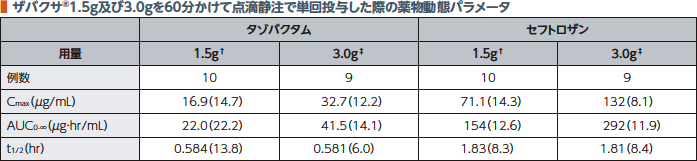
幾何平均(幾何変動係数%)
† タゾバクタム0.5g及びセフトロザン1.0g
‡ タゾバクタム1.0g及びセフトロザン2.0g
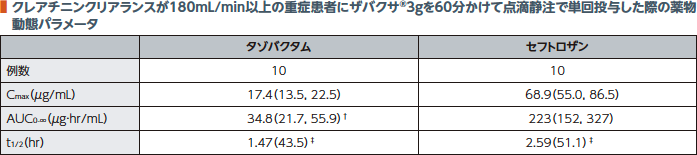
(2)単回投与(重症患者:外国人データ)2)
クレアチニンクリアランスが180mL/min以上の重症患者にザバクサ®3gを60分かけて点滴静注で単回投与した際のタゾバクタム及びセフトロザンの薬物動態パラメータを以下に示す。遊離型タゾバクタムの血漿中濃度は8時間の投与間隔の60%にわたって1μg/mL超を維持していた。遊離型セフトロザンの血漿中濃度は8時間の投与間隔の70%にわたって8μg/mL超を維持していた。
2.反復投与(複雑性尿路感染症患者及び複雑性腹腔内感染症患者)3)
国内第Ⅲ相試験において、日本人の複雑性尿路感染症患者及び複雑性腹腔内感染症患者にザバクサ®1.5gを60分かけて点滴静注で8時間ごとに反復投与した際の、母集団薬物動態解析に基づくタゾバクタム及びセフトロザンの定常状態時の薬物動態パラメータは以下のとおりであった。
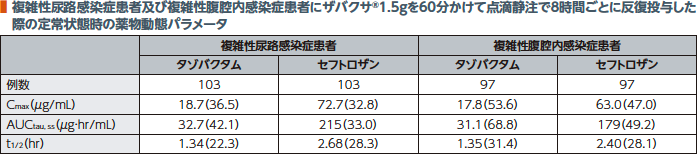
幾何平均(幾何変動係数%)
注)CLCRが30~50mL/minの患者ではザバクサ®750mgを投与した。
3.反復投与(人工呼吸器を装着している院内肺炎患者)(日本人及び外国人データ)4)
国際共同第Ⅲ相試験において、人工呼吸器を装着している院内肺炎患者にザバクサ®3gを60分かけて点滴静注で8時間ごとに反復投与した際の、母集団薬物動態解析に基づくタゾバクタム及びセフトロザンの定常状態時の薬物動態パラメータは以下のとおりであった。
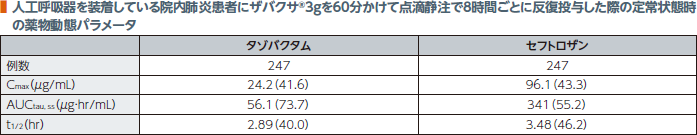
幾何平均(幾何変動係数%)
注)CLCRが50mL/min超の患者のデータ
4.腎機能障害者における薬物動態(外国人データ)5,6)
軽度、中等度及び重度の腎機能障害者では腎機能正常者と比較し、タゾバクタムの用量補正したAUCの幾何平均がそれぞれ約1.3倍、2倍及び4倍に、セフトロザンの用量補正したAUCの幾何平均がそれぞれ約1.3倍、2.5倍及び5倍に増加した。また、タゾバクタム及びセフトロザンの投与量の約2/3が血液透析により除去される。
軽度、中等度及び重度の腎機能障害者並びに腎機能正常者にザバクサ®を60分かけて点滴静注で単回投与した際のタゾバクタム及びセフトロザンの薬物動態パラメータは以下のとおりであった。
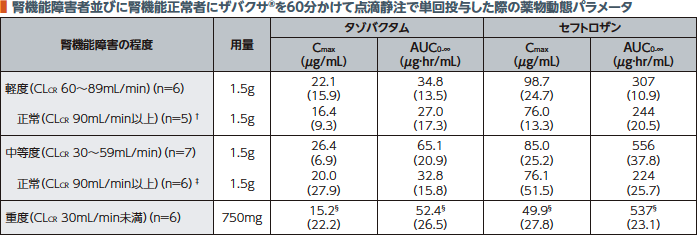
幾何平均(幾何変動係数%)
† 軽度腎機能障害者と性別、年齢及びBMIでマッチングさせた腎機能正常者
‡ 中等度腎機能障害者と性別、年齢及びBMIでマッチングさせた腎機能正常者
§ 算術平均(変動係数%)
7. 用法及び用量に関連する注意
〈効能共通〉
7.1 腎機能障害のある患者(CLCRが50mL/min以下)に対しては下表を参考に本剤の用量を調節すること。[8.3、9.2、9.8、16.6.1参照]
〈膀胱炎、腎盂腎炎、腹膜炎、腹腔内膿瘍、胆嚢炎、肝膿瘍〉
1) 本剤750mg(タゾバクタム250mg、セフトロザン500mg)
2) 本剤375mg(タゾバクタム125mg、セフトロザン250mg)
3) 本剤150mg(タゾバクタム50mg、セフトロザン100mg)
〈敗血症、肺炎〉
1) 本剤1.5g(タゾバクタム0.5g、セフトロザン1g)
2) 本剤750mg(タゾバクタム250mg、セフトロザン500mg)
3) 本剤450mg(タゾバクタム150mg、セフトロザン300mg)
4) 本剤2.25g(タゾバクタム0.75g、セフトロザン1.5g)
† Cockcroft-Gault式により推定したCLCR
‡ いずれの用量も60分かけて投与する。
§ CLCRが15mL/min未満で血液透析をしていない患者における臨床推奨用量の根拠となるデータは得られていない。
1)承認時評価資料:日本人及び外国人健康成人を対象とした海外第Ⅰ相臨床試験(CXA-EB-13-05試験)
2)社内資料:細菌性肺炎患者を対象とした肺への移行性試験(007試験)
3)社内資料:日本人患者対象国内反復投与試験(013試験/014試験)
4)社内資料:肺炎患者の母集団薬物動態解析
5)社内資料:腎機能障害者対象海外臨床試験(CXA-REN-11-01試験)
6)社内資料:腎機能障害者対象海外臨床試験(CXA-201-02試験)