作用機序と耐性化メカニズム
作用機序と耐性化メカニズム
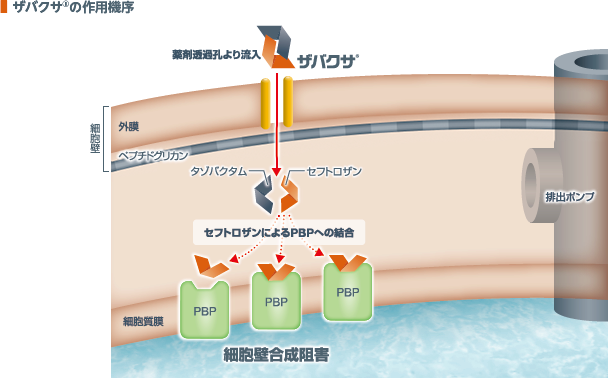
1.ザバクサ®の作用機序
セフトロザンはペニシリン結合蛋白(PBP)に結合し、細胞壁合成を阻害する1)。また、タゾバクタムはESBLを含むβ-ラクタマーゼを阻害し、セフトロザンがβ-ラクタマーゼによって不活化されることを防ぐ2)。
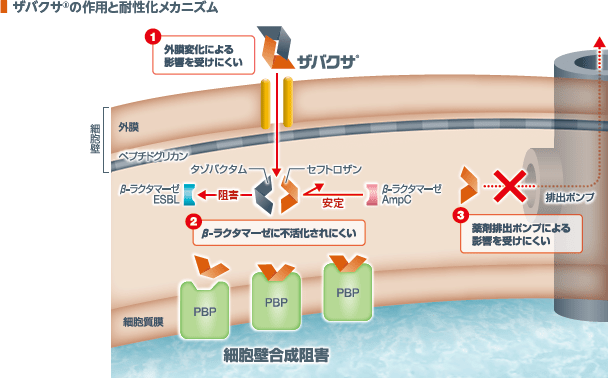
2.ザバクサ®の作用と耐性化メカニズム
ザバクサ®は、細菌の耐性化メカニズムの1つである外膜変化による影響を受けにくく、外膜を通過して細菌内に流入する。その後、β-ラクタマーゼによるセフトロザンの不活化に対して、タゾバクタムが主にESBLを阻害する一方で、AmpCに対してはセフトロザン自体が安定である3)。さらに、薬剤排出ポンプによる影響を受けにくい。これらの機序から、細菌の耐性化メカニズムの影響をあまり受けずに、セフトロザンがPBPに到達し、抗菌効果を発揮する。
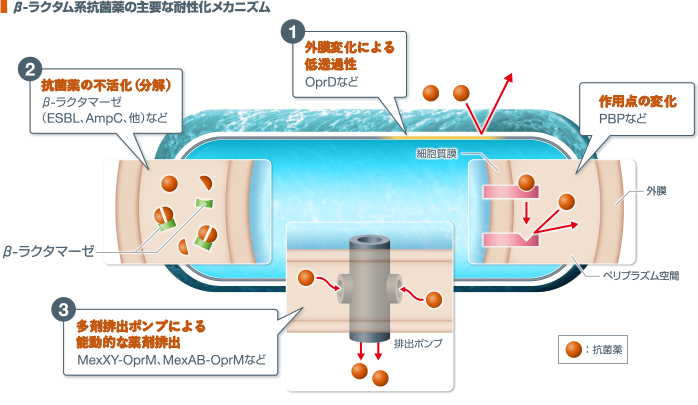
3. 細菌の耐性化に及ぼす影響(in vitro)
β-ラクタム系抗菌薬の耐性化には、①外膜変化による低透過性、②β-ラクタマーゼによる薬剤の不活化、③多剤排出ポンプによる能動的な薬剤排出機構などが介在している。
監修:東邦大学医学部 微生物感染症学講座 教授 石井良和 先生
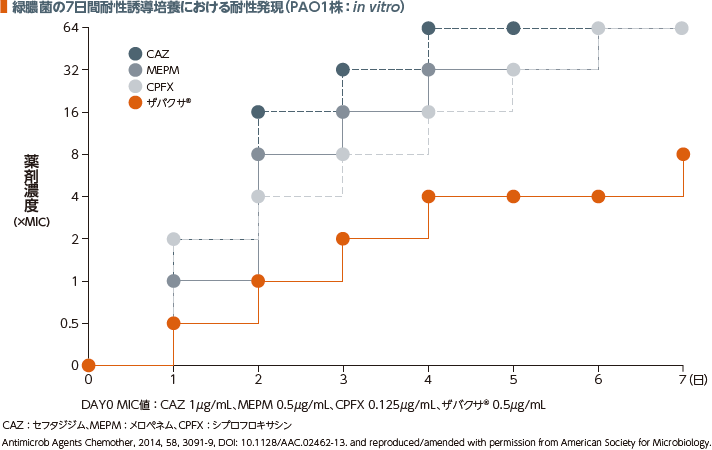
緑膿菌の耐性発現に及ぼす影響(PAO1株:in vitro)4)
ザバクサ®は耐性誘導培養において、7日目においても高度耐性株の発現はみられなかった(in vitro)。
方法:
緑膿菌野生型株(PAO1株、ザバクサ®感受性0.5μg/mL)を用いた。各種抗菌薬におけるそれぞれのMIC濃度(0.5×、1×、2×、4×、8×、16×、32×、64×)を添加した10mLのMueller-Hinton培地(試験管)におよそ106CFU/mLのPAO1株を接種し、37℃、24時間、180rpmで培養した。最も高い抗菌薬濃度で生育がみられた試験管から菌液を採取して1,000倍希釈となるよう新しい培地に再接種し、24時間培養した。64×MIC濃度まで7日間連続で実施した。なお、すべての実験は3回ずつ行った。
1)Moyá B et al. Antimicrob Agents Chemother. 2010; 54(9): 3933-3937.
2)Craig WA et al. Antimicrob Agents Chemother. 2013; 57(4): 1577-1582.
3)Takeda S et al. Antimicrob Agents Chemother. 2007; 51(3): 826-830.
4)Cabot G et al. Antimicrob Agents Chemother. 2014; 58(6): 3091–3099.
[利益相反:本試験は、Cubist社(現MSD)の支援により行われた。]