成人<同種造血幹細胞移植> 移植後約200日目まで投与 第Ⅲ相国際共同試験(040試験)
臨床成績
成人<同種造血幹細胞移植>
移植後約200日目まで投与
第Ⅲ相国際共同試験(040試験)1、2)
CMV抗体陽性の成人同種造血幹細胞移植患者へのプレバイミス®予防投与*を移植後100日から200日に延長した際の安全性及び有効性を評価する二重盲検無作為化プラセボ対照第Ⅲ相試験(検証試験)
1)電子添文改訂時評価資料(第Ⅲ相国際共同試験:040試験)
2)Russo D et al. Lancet Haematol. 2024; 11(2): e127-135. 利益相反:本試験はMSDより資金提供を受けている。
*:プレバイミス®の効能又は効果は、「下記におけるサイトメガロウイルス感染症の発症抑制 〇同種造血幹細胞移植 〇臓器移植」である。
試験概要
主要目的:
移植後14週(約100日)から28週(約200日)までに臨床的に意味のあるCMV感染がみられた患者の割合を評価し、プレバイミス®による予防投与を移植後100日から200日に延長した際の有効性をプラセボと比較する。
対象:
移植後14週(約100日)までプレバイミス®の予防投与を受けたがこれ以降もCMV感染/感染症のリスクが高いCMV抗体陽性の成人同種造血幹細胞移植(HSCT)患者※1220例(うち日本人は16例)
※1:移植後14週(約100日)以降もCMV感染及び感染症リスクを有する患者として、次の基準を1つ以上満たした者が含まれた。
a. 血縁ドナーで3つのHLA遺伝子座(HLA-A、HLA-B又はHLA-DR)の少なくとも1つに1箇所以上の不一致がある
b. HLA半合致ドナー
c. 非血縁ドナーで4つのHLA遺伝子座(HLA-A、HLA-B、HLA-C及びHLA-DRB1)の少なくとも1つに1箇所以上の不一致がある
d. 臍帯血移植
e. ex vivo T細胞除去移植
f. 抗ヒト胸腺細胞免疫グロブリン使用
g. アレムツズマブ使用
h. 無作為割付け前6週以内に1mg/kg/日以上のプレドニゾロン(又は同等の薬剤)の全身投与
試験デザイン:
国際多施設共同無作為化二重盲検プラセボ対照比較試験[検証試験]
投与方法:
移植後14週(約100日)までプレバイミス®による予防投与を完了した患者を対象に、2:1の比でプレバイミス®群又はプラセボ群のいずれかに無作為に割り付け、プレバイミス®480mg(シクロスポリン併用時は240mg)又はプラセボを、1日1回経口又は静脈内投与にて移植後28週(約200日)まで投与した。

主な選択基準:
- 移植時にCMV抗体陽性が認められていた者[CMV IgG抗体陽性のレシピエント(R+)]
- 無作為割付け前約100日以内に同種HSCT(骨髄、末梢血幹細胞又は臍帯血移植)を受けた者
- 無作為割付け前14日以内に採取した血漿検体により、CMV DNAが検出されなかった、又は検出されたが定量可能なCMV DNAが確認できなかった(中央検査機関により確認)者
- HSCT後28日以内に一次予防としてプレバイミス®の投与を開始し、無作為割付け前、移植後14週(100日)±1週間まで継続した者
- CMV感染症のリスクが高い者(※1の基準を1つ以上満たした者)
- 同意取得時の年齢が18歳以上の者
評価項目:
【主要評価項目】移植後14週(約100日)から28週(約200日)までに臨床的に意味のあるCMV感染※2がみられた患者の割合(検証的解析項目)
【副次評価項目】移植後14週から38週及び48週までに臨床的に意味のあるCMV感染がみられた患者の割合
移植後14週から28週及び48週までに臨床的に意味のあるCMV感染がみられるまでの期間(移植日から臓器障害を伴うCMV感染症の発症日又は抗CMV薬による先制治療の開始日までの日数)
移植後14週から28週及び48週までに死亡した患者の割合(死亡の原因は問わない) 等
※2:臨床的に意味のあるCMV感染は以下のように定義した。
「臓器障害を伴うCMV感染症の発症」もしくは「先制治療の開始(中央測定機関でPCR法によりCMV血症が確認された場合及び患者の状態に基づく)」
【安全性】有害事象、臨床検査、バイタルサイン 等
解析計画:
- 有効性の主要解析対象集団は、無作為割付け後に治験薬の投与を1回以上受けたすべての患者から構成される最大の解析対象集団[FAS(Full analysis set)]とした。
- 有効性の主要解析は、層別因子のHLA半合致ドナー(該当又は非該当)で調整したMantel-Haenszel法により群間差を算出し、片側p値が0.0249以下の場合に、プラセボ群に対するプレバイミス®群の有効性が示されたとした。また、主要な欠測値は、臨床的に意味のあるCMV感染がみられた患者及び中止例で治験早期中止時にCMV血症がみられた患者を無効例とした[OF(Observed Failure)アプローチ]。
- 副次評価項目である移植後14週から28週及び48週までに臨床的に意味のあるCMV感染がみられるまでの期間について、投与群別にKaplan-Meier曲線をプロットし、層別因子のHLA半合致ドナー(該当又は非該当)で調整したログランク検定を用いて群間差に関する片側p値(名目上のp値)を求めた。また、移植後14週から28週及び48週までに死亡した患者の割合については、主要評価項目の解析と同様の方法を用いて解析した。
解析対象例数:
有効性解析対象例数(FAS):218例(プレバイミス群®144例、プラセボ群74例)
安全性解析対象例数:218例(プレバイミス群®144例、プラセボ群74例)
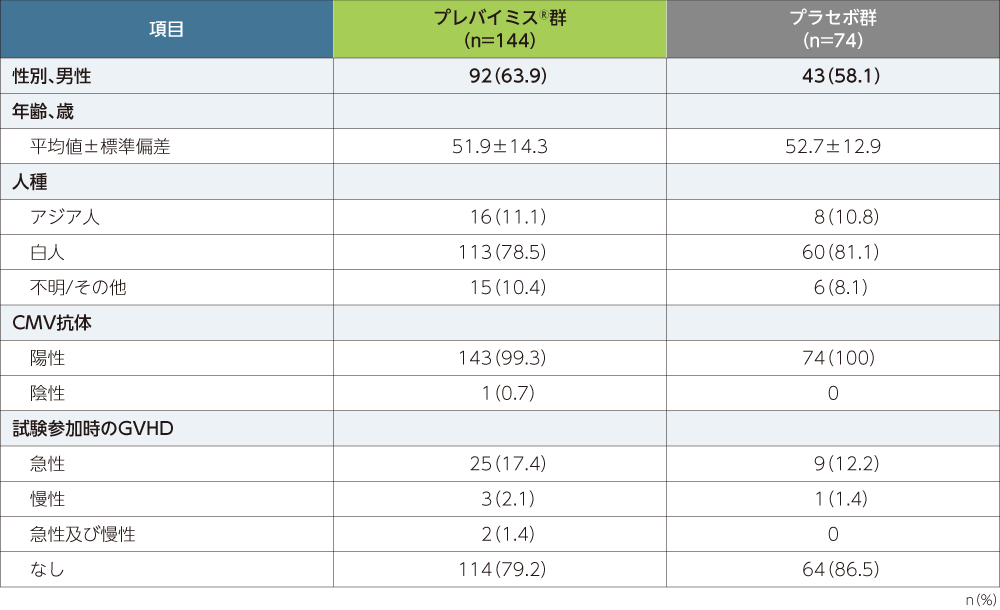
患者背景
■患者背景(FAS)
1. 移植後14週から28週までに臨床的に意味のあるCMV感染※1がみられた患者の割合(主要評価項目、検証的解析項目)※2
移植後14週から28週までに臨床的に意味のあるCMV感染がみられた患者(OFアプローチ※2)の割合は、プレバイミス®群2.8%(4/144例)であり、プラセボ群の18.9%(14/74例)と比較して有意に低く、プレバイミス®群の優越性が示されました[群間差-16.1%、片側p値:p=0.0005、層(HLA半合致ドナーの該当又は非該当)で調整したMantel-Haenszel法(各層の2群の症例数の調和平均で重み付け)]。
■移植後14週から28週までに臨床的に意味のあるCMV感染がみられた患者の割合(優越性試験、検証的解析結果、主要評価項目、FAS)
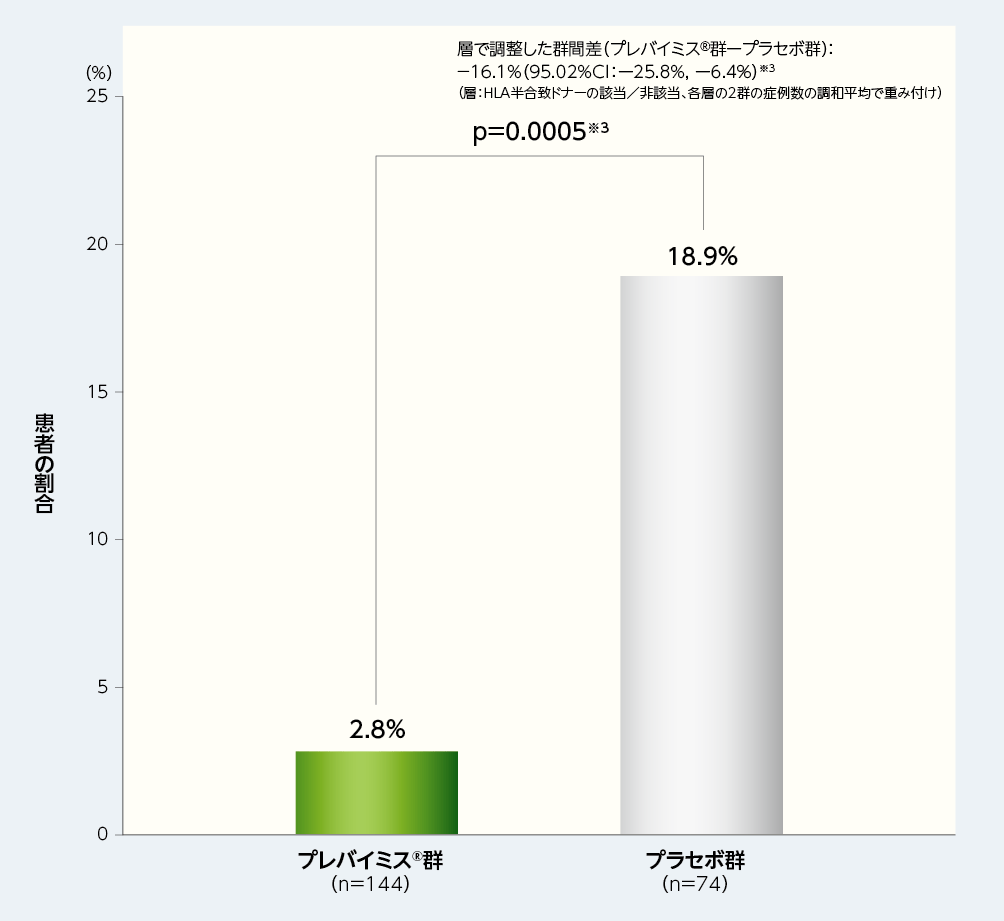
※1:臨床的に意味のあるCMV感染は、「臓器障害を伴うCMV感染症の発症」もしくは「先制治療の開始(中央測定機関でPCR法によりCMV血症が確認された場合及び患者の状態に基づく)」と定義した。
※2:主要評価項目の解析においては、Observed Failure approach(OFアプローチ)を用いて、臨床的に意味のあるCMV感染がみられた患者及び中止例で治験早期中止時にCMV血症がみられた患者は無効例とみなした。
※3:層(HLA半合致ドナーの該当又は非該当)で調整したMantel-Haenszel法(各層の2群の症例数の調和平均で重み付け)を用いて群間差の95.02%CI及びp値を算出し、統計学的有意差の判定には片側p値(0.0249)を用いた。
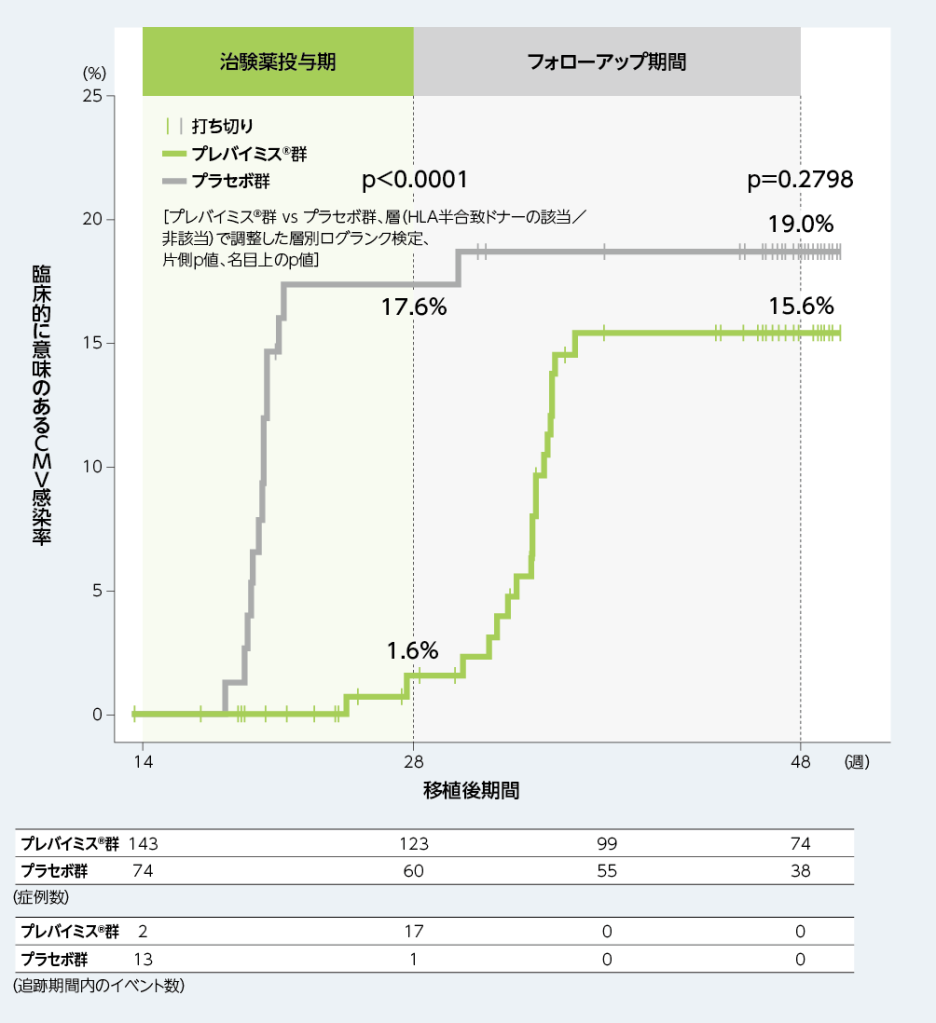
2. 移植後14週から28週及び48週までに臨床的に意味のあるCMV感染がみられるまでの期間(副次評価項目)
移植後14週から28週時点の臨床的に意味のあるCMV感染の累積イベント発生率は、プレバイミス®群で1.6%、プラセボ群で17.6%でした。移植後14週から48週時点では、プレバイミス®群で15.6%、プラセボ群で19.0%でした。
■移植後14週から28週及び48週までに臨床的に意味のあるCMV感染がみられるまでの期間(副次評価項目、FAS)
3. 移植後14週から28週及び48週までの全死亡(副次評価項目)
移植後14週から28週及び48週までの全死亡率は、移植後28週時点ではプレバイミス®群2.1%(3/144例)に対してプラセボ群1.4%(1/74例)であり、移植後48週時点ではプレバイミス®群8.3%(12/144例)に対してプラセボ群8.1%(6/74例)でした。
■移植後14週から28週及び48週までの全死亡(副次評価項目、FAS)
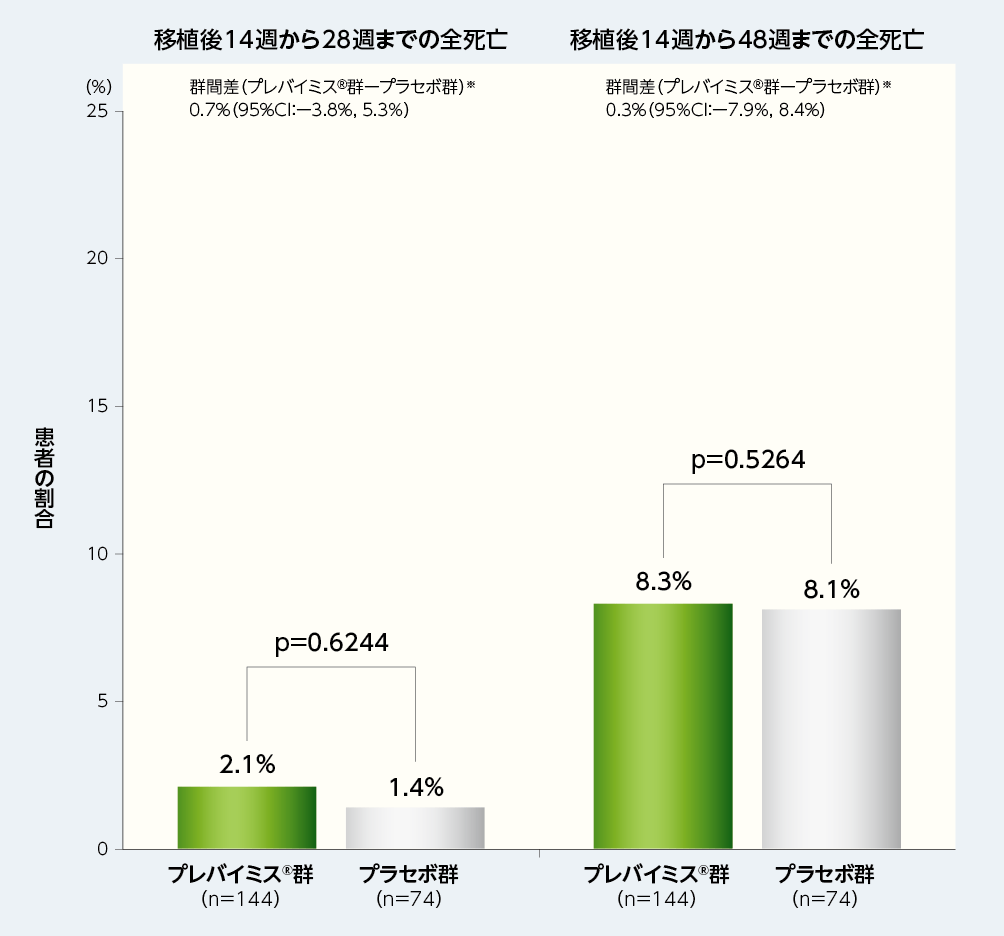
※:層(HLA半合致ドナーの該当又は非該当)で調整したMantel-Haenszel法(各層の2群の症例数の調和平均で重み付け)を用いて群間差の95%CI及び片側p値(名目上のp値)を算出した。
4. 安全性
副作用※発現率
移植後14週から28週までの副作用は、プレバイミス®群で144例中4例(2.8%)、プラセボ群で74例中3例(4.1%)に認められました。各群で頻度の高かった副作用(発現頻度1%以上)は、プレバイミス®群で悪心3例(2.1%)、嘔吐2例(1.4%)、プラセボ群で腹痛、鼓腸、悪心、疲労各1例(1.4%)でした。
本試験において、重篤な副作用、投与中止に至った副作用、死亡に至った副作用は認められませんでした。
■第Ⅲ相国際共同試験(040試験)における副作用発現率
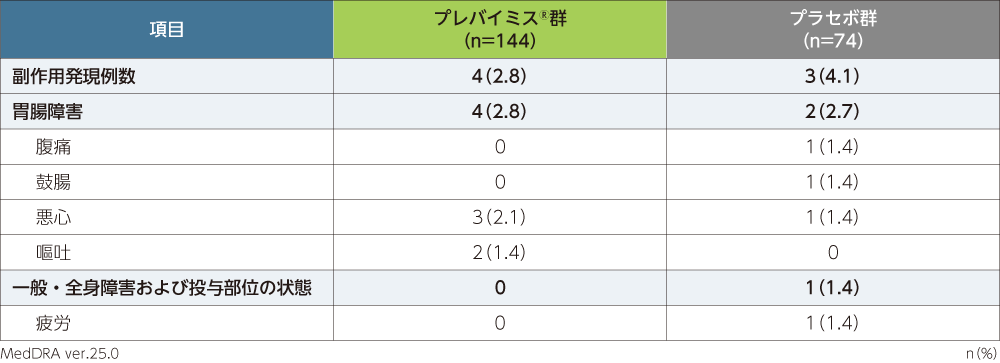
※:治験担当医師が盲検下で治験薬との因果関係ありと判定した有害事象を副作用と定義した。