副反応
副反応
次の副反応があらわれることがあるので、観察を十分に行い、異常が認められた場合には適切な処置を行うこと。
重大な副反応
アナフィラキシー様反応(頻度不明)
呼吸困難、血管浮腫、蕁麻疹、発汗等があらわれることがある。
血小板減少(頻度不明)
小康期にある特発性血小板減少性紫斑病患者において血小板減少の再燃がみられたことが報告されている。
知覚異常、ギランバレー症候群等の急性神経根障害(頻度不明)
蜂巣炎・蜂巣炎様反応、注射部位壊死、注射部位潰瘍(頻度不明)
本剤接種後、主として注射部位を中心とした蜂巣炎・蜂巣炎様反応(発赤、腫脹、疼痛、発熱等)があらわれ、壊死や潰瘍に至ることがある。
その他の副反応
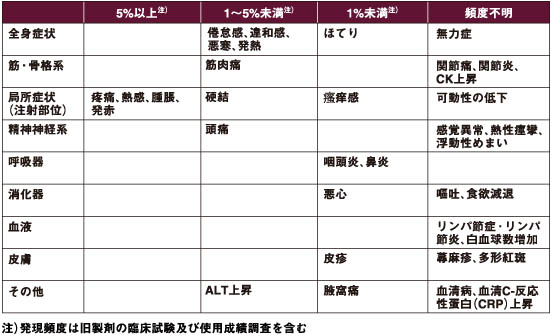
ニューモバックス®NPシリンジ電子添文. 2023年8月改訂(第3版)

関連コンテンツ
ニューモバックス®NP・ワクチン関連領域情報
関連製品

