3回目接種データ
3回目接種時の免疫原性と安全性
慢性肺疾患を有する高齢者に対し、23価肺炎球菌ワクチンを3回まで接種した際のIgG抗体価およびオプソニン活性
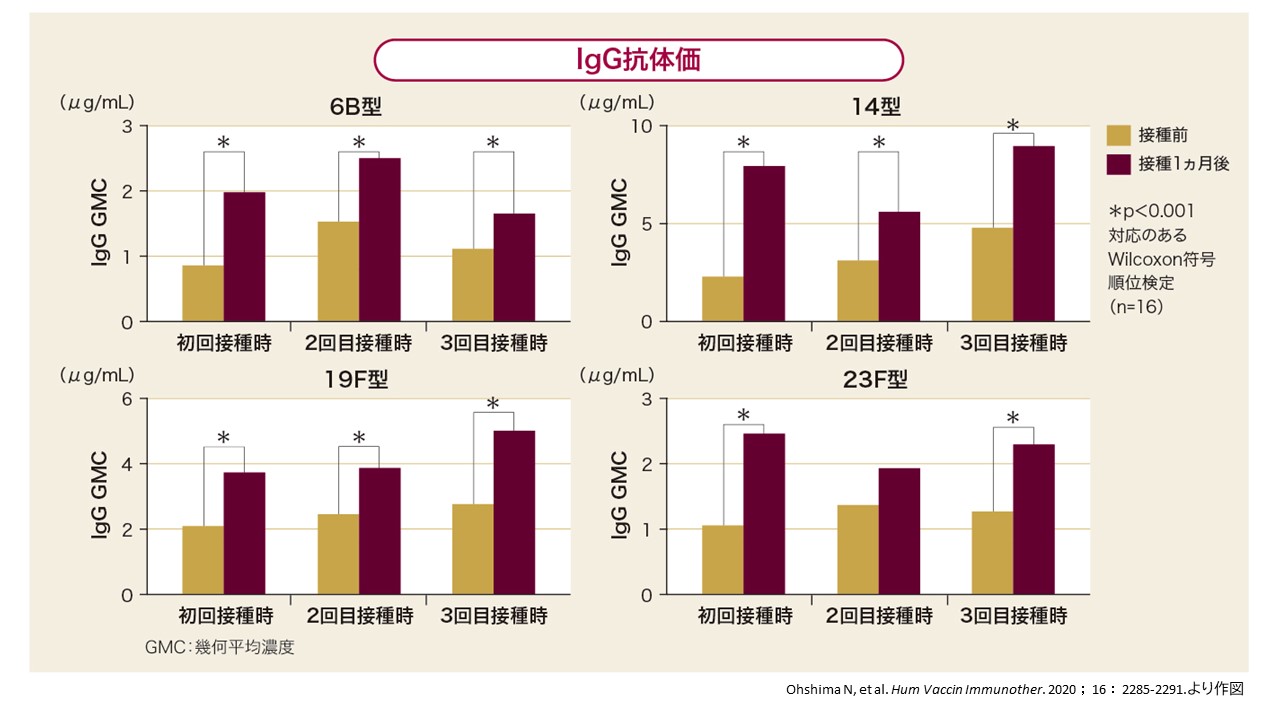
23価肺炎球菌ワクチン※を過去に2回接種したことがある慢性肺疾患を有する高齢者を対象に3回目の23価肺炎球菌ワクチン接種を行ったところ、3回目接種時でも、接種前と比べて接種後に6B、14、19F、23F型のIgG抗体価が有意に上昇しました。
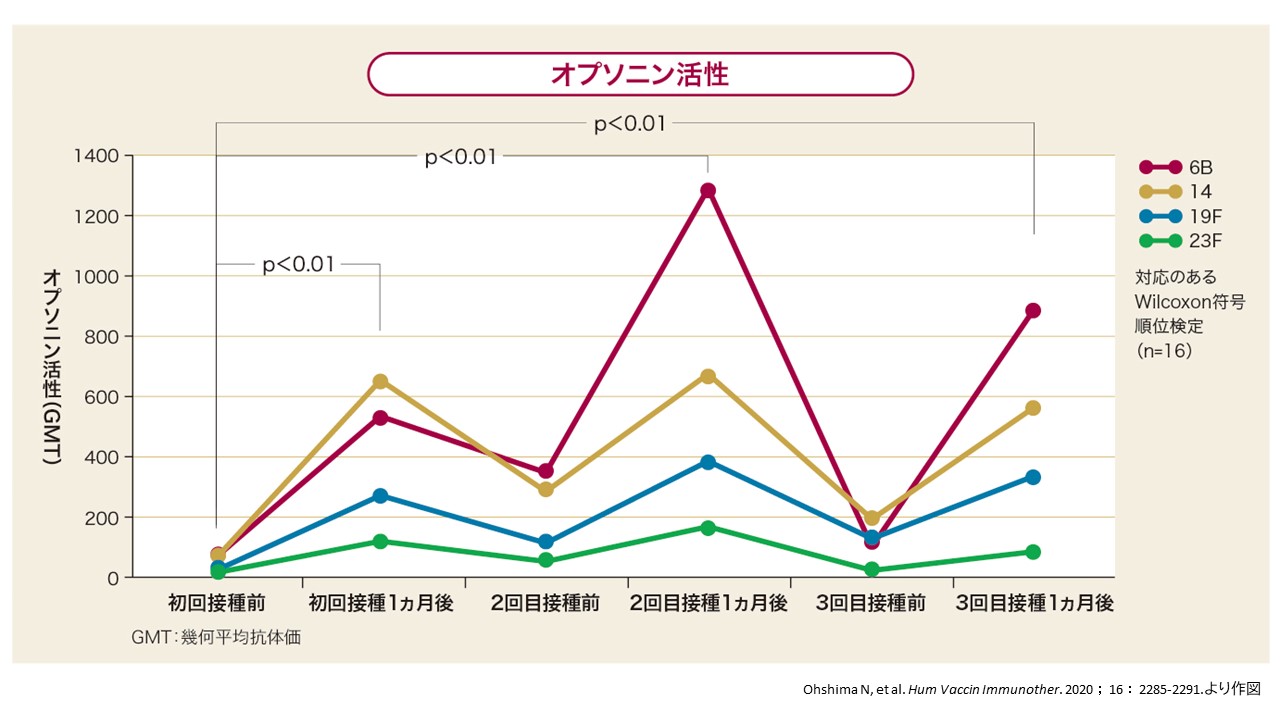
6B、14、19F、23F型の4種類のオプソニン活性は、初回接種前と比べて、初回・2回目接種時と同様に、3回目接種時でも有意に上昇しました。
23価肺炎球菌ワクチン3回接種後の安全性
<局所の有害事象>
下記の表に示す通り、腫脹/発赤および上腕の疼痛は3回目接種1日後にピークに達し、その後1週間以内に徐々に消失しました。

<全身性の有害事象>
3回目接種後の有害事象は、疲労が接種当日に2例(12.5%)、1日後に5例(31.25%)、2日後に4例(25%)、3日後に2例(12.5%)、4日後および5日後に各1例(6.25%)、6日後に3例(18.75%)、頭痛が接種当日に1例(6.25%)、1日後に2例(12.5%)、3日後に3例(18.75%)、3~6日後に各2例(12.5%)認められました。悪心が接種2~6日後に各1例(6.25%)、関節痛が、接種1日後および2日後に各1例(6.25%)認められました。3回目接種後に重篤な有害事象は認められませんでした。
Ohshima N, et al. Hum Vaccin Immunother. 2020;16:2285-2291.より作成

※国内ではニューモバックス(旧製剤)®及びニューモバックス®NP(現行製剤)を含みます。製法変更等に係る承認申請を経て、2006年から現行製剤が販売され、旧製剤は 販売中止となりました。両製剤を比較した国内臨床試験では、抗体価上昇の観点から同等の抗原性を示すワクチンであることが確認されています(審査報告書, IV総合評価)。
Ohshima N, et al. Hum Vaccin Immunother. 2020; 16: 2285-2291.
