PIONEER 6:プラセボ比較、心血管アウトカム試験
参考情報:海外第3相臨床試験:PIONEER 6
2型糖尿病患者を対象とした、プラセボ比較、心血管アウトカム試験(海外データ)
社内資料:リベルサス®錠 第3相臨床試験(NN9924-4221)(承認時評価資料)
Husain M et al.:N Engl J Med 381(9):841-851, 2019
本試験はノボ ノルディスク社のスポンサーシップにより実施された。
■試験概要

■<参考情報> 最初のMACEを発現するまでの時間
MACEのいずれかの初回発現までの時間に関するHRの推定値は0.79(95%CI[0.57;1.11])であり、95%CIの上限が非劣性基準である1.8未満を達成し、リベルサス®14mgのプラセボに対する非劣性が検証された(p<0.001)。 なお、優越性については検証されなかった(p=0.17)。
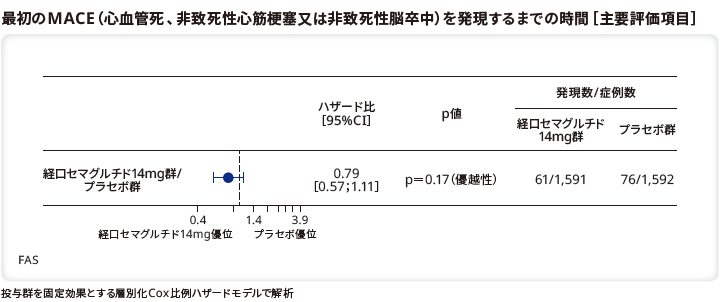
■<参考情報>MACE、拡大複合心血管アウトカム及びその各コンポーネントの発現率
MACE発現率は、リベルサス®14mg群では3.8%(61/1,591例)、プラセボ群では4.8%(76/1,592例)であった。
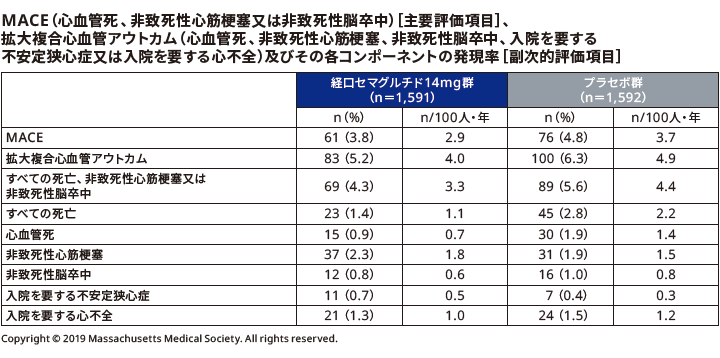
■HbA1cの変化量と推移
HbA1cのベースラインから最終評価時までの変化量は、リベルサス®14mg群では–1.0%、プラセボ群では–0.3%であった。
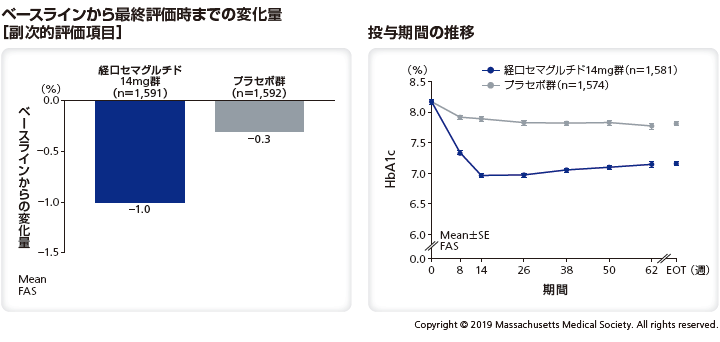
■<参考情報> 体重への影響
体重のベースラインから最終評価時までの変化量は、リベルサス®14mg群では–4.2kg、プラセボ群では–0.8kgであった。
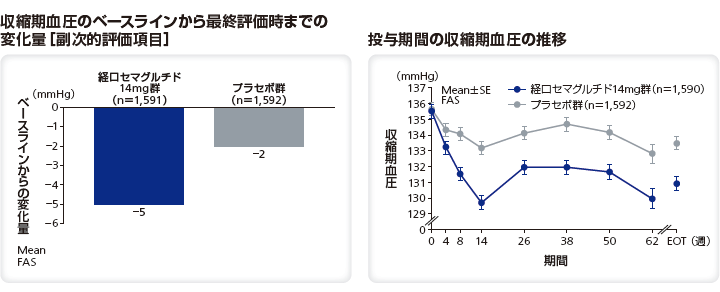
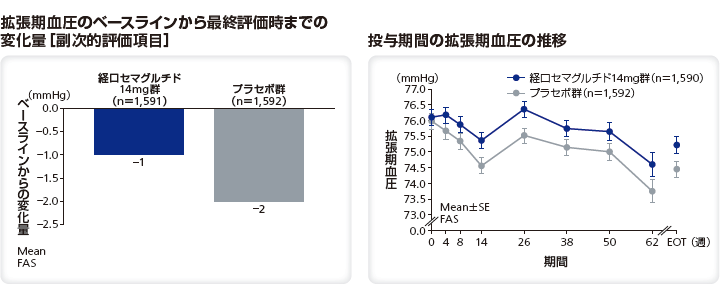
■<参考情報> 血圧への影響
収縮期血圧のベースラインから最終評価時までの変化量は、リベルサス®14mg群では–5mmHg、プラセボ群では–2mmHgであった。 拡張期血圧のベースラインから最終評価時までの変化量は、リベルサス®14mg群では–1mmHg、プラセボ群では–2mmHgであった。
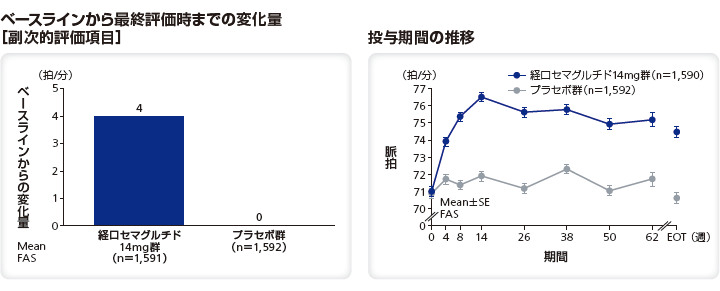
■<参考情報>脈拍への影響
脈拍のベースラインから最終評価時までの変化量は、リベルサス®14mg群では4拍/分であり、プラセボ群では0拍/分であった。
■低血糖
試験期間中に重大な低血糖を発現した患者の割合は、リベルサス®14mg群で1.4%(23/1,591例)、プラセボ群で0.8%(13/1,592例)であった。

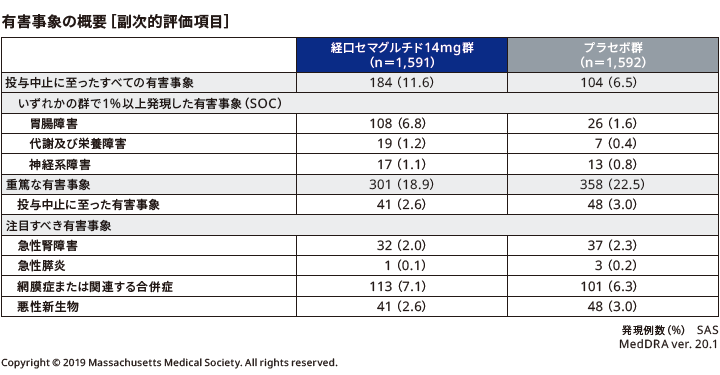
■安全性
重篤な有害事象は、リベルサス®14mg群で301例545件(急性心筋梗塞25件、不安定狭心症20件、急性腎障害14件、肺炎13件、うっ血性心不全12件、心筋梗塞、低血糖性意識消失、慢性閉塞性肺疾患、非心臓性胸痛、各11件、冠動脈疾患、狭心症、蜂巣炎、虚血性脳卒中、各9件、心房細動、白内障、各8件、失神7件、心停止、変形性関節症、各6件、慢性心不全、胃腸炎、骨髄炎、低血圧、転倒、低血糖、各5件、頚動脈狭窄、結腸腺癌、下痢、嘔吐、各4件、心房粗動、第二度房室ブロック、急性心不全、憩室炎、尿路感染、敗血症、一過性脳虚血発作、不全片麻痺、尿管結石症、深部静脈血栓症、末梢血管障害、末梢動脈狭窄、硬膜下血腫、脱水、乳酸アシドーシス、無力症、急性胆嚢炎、良性前立腺肥大症、各3件、急性左室不全、心筋虚血、心不全、インフルエンザ、下気道感染、尿路性敗血症、敗血症性ショック、頚動脈閉塞、脳症、浮動性めまい、神経炎、遠隔転移を伴う肺癌、遠隔転移を伴う膵癌、下垂体の良性腫瘍、肝細胞癌、肺腺癌、血尿、腎結石症、悪心、下部消化管出血、虚血性大腸炎、腹痛、臍ヘルニア、鼡径ヘルニア、末梢動脈閉塞性疾患、呼吸不全、肺塞栓症、肺水腫、胸水、呼吸困難、股関節部骨折、交通事故、処置後血尿、大腿骨骨折、高血糖、高血糖性高浸透圧性非ケトン性症候群、糖尿病性ケトアシドーシス、頚部痛、胆石症、鉄欠乏性貧血、貧血、糖尿病性足病変、各2件、冠動脈狭窄、冠動脈硬化症、急性冠動脈症候群、虚血性心筋症、徐脈、心筋炎、心筋症、心室細動、心肺停止、僧帽弁閉鎖不全症、第一度房室ブロック、頻脈、不整脈、変性大動脈弁疾患、よう、アシネトバクター性肺炎、インフルエンザ性肺炎、ウイルス性胃腸炎、カンピロバクター胃腸炎、レンサ球菌性肺炎、医療機器関連感染、感染性腱鞘炎、気管支炎、急性腎盂腎炎、細菌性上気道感染、細菌性心内膜炎、四肢膿瘍、処置後肺炎、上気道感染、髄膜炎、脊髄炎、胆嚢蓄膿、蓄膿、注射部位膿瘍、糖尿病性壊疽、糖尿病性足感染、膿創、肺結核、発疹熱、副鼻腔炎、ラクナ脳卒中、感覚鈍麻、視神経炎、小脳梗塞、第6脳神経麻痺、低血糖性痙攣、脳梗塞、L鎖病、びまん性大細胞型B細胞性リンパ腫、胃腺癌、遠隔転移を伴う悪性黒色腫、遠隔転移を伴う甲状腺癌、遠隔転移を伴う前立腺癌、遠隔転移を伴う膵神経内分泌腫瘍、形質細胞性骨髄腫、結腸癌、甲状腺髄様癌、真性多血症、腎新生物、前立腺癌第3期、前立腺癌第4期、虫垂のカルチノイド腫瘍、乳頭状腎細胞癌、肺転移、非ホジキンリンパ腫、IgA腎症、腎機能障害、腎不全、水腎症、慢性腎臓病、膀胱脱、胃炎、胃十二指腸炎、胃食道逆流性疾患、胃腸出血、胃潰瘍、血便排泄、痔核、出血性十二指腸潰瘍、消化不良、上腹部痛、食道出血、大腸ポリープ、大腸炎、膵炎、悪性高血圧、起立性低血圧、高血圧、大動脈解離、大動脈狭窄、末梢性虚血、末梢動脈解離、末梢動脈閉塞、咽頭浮腫、気管支反応性亢進、急性肺水腫、血胸、誤嚥、特発性肺線維症、肺障害、閉塞性気道障害、開放性眼球外傷、関節損傷、関節脱臼、偶発的過量投与、骨盤骨折、耳内異物、術後胸部処置合併症、上肢骨折、脊椎圧迫骨折、足関節部骨折、脳挫傷、膝蓋骨骨折、肋骨骨折、橈骨骨折、腱損傷、コントロール不良の糖尿病、高カリウム血症、低カリウム血症、低ナトリウム血症、胸痛、死亡、全身性炎症反応症候群、疲労、末梢性浮腫、横紋筋融解症、滑液包炎、関節炎、関節障害、筋骨格系胸痛、弾発指、椎間板突出、病的骨折、変形性脊椎症、肝炎、肝硬変、肝障害、急性胆管炎、脂肪肝、胆管結石、胆嚢炎、慢性胆嚢炎、網膜裂孔、関節形成、経尿道的前立腺摘除、股関節形成、植込み型除細動器挿入、心臓ペースメーカー挿入、大動脈瘤修復、白内障手術、緑内障手術、自己免疫性溶血性貧血、白血球増加症、脾臓出血、うつ病、アルコール症、錯乱状態、薬物依存、皮膚潰瘍、クロストリジウム検査陽性、駆出率減少、医療機器機能不良、各1件)、プラセボ群で358例618件(急性心筋梗塞25件、肺炎21件、不安定狭心症、急性腎障害、各18件、心房細動14件、冠動脈疾患13件、虚血性脳卒中12件、うっ血性心不全、転倒、各11件、変形性関節症10件、心筋梗塞、慢性心不全、非心臓性胸痛、各9件、心不全、低血糖性意識消失、各8件、狭心症、蜂巣炎、末梢動脈閉塞性疾患、糖尿病性足病変、各7件、敗血症、一過性脳虚血発作、白内障、各6件、胃腸炎、尿路感染、尿路性敗血症、頚動脈狭窄、慢性腎臓病、各5件、左室不全、気管支炎、失神、前立腺癌、慢性閉塞性肺疾患、低血糖、高血糖、胆石症、皮膚潰瘍、各4件、心筋虚血、冠動脈狭窄、心肺停止、敗血症性ショック、医療機器関連感染、丹毒、低血圧、起立性低血圧、末梢性虚血、急性呼吸不全、コントロール不良の糖尿病、死亡、各3件、急性左室不全、急性心不全、憩室炎、急性腎盂腎炎、術後創感染、唾液腺炎、浮動性めまい、虚血性脳梗塞、痙攣発作、胃腺癌、基底細胞癌、舌扁平上皮癌、胆管細胞癌、膵腺癌、尿管結石症、血尿、腎結石症、腎不全、腹痛、鼡径ヘルニア、胃腸出血、末梢血管障害、呼吸不全、肺塞栓症、呼吸困難、喘息、脊椎圧迫骨折、血管偽動脈瘤、処置後合併症、上腕骨骨折、大腿骨頚部骨折、脱水、乳酸アシドーシス、胸痛、心突然死、肩回旋筋腱板症候群、腰部脊柱管狭窄症、背部痛、急性胆嚢炎、脂肪肝、胆嚢炎、外科的脊椎固定、貧血、良性前立腺肥大症、各2件、心房粗動、第二度房室ブロック、虚血性心筋症、不整脈、プリンツメタル狭心症、冠動脈血栓症、冠動脈攣縮、完全房室ブロック、高血圧性心疾患、上室性頻脈、心原性ショック、心室性頻脈、心腎症候群、心粗動、心肺不全、洞結節機能不全、無脈性電気活動、骨髄炎、インフルエンザ、上気道感染、クレブシエラ菌性肺炎、ブドウ球菌性菌血症、ルードウィッヒ口峡炎、壊疽、感染性胆嚢炎、眼窩周囲蜂巣炎、口腔感染、処置後感染、処置後蜂巣炎、腎盂腎炎、足部白癬、帯状疱疹、大腸菌性腎盂腎炎、大腸菌性肺炎、胆道性敗血症、直腸膿瘍、椎間板炎、毛包炎、扁桃炎、肛門膿瘍、感覚鈍麻、脳梗塞、パーキンソニズム、ラクナ梗塞、レヴィ小体型認知症、血管性認知症、腰仙部神経叢障害、重症筋無力症、神経毒性、脊椎炎性脊髄症、糖尿病性ニューロパチー、統合運動障害、頭痛、脳虚血、脳血管発作、片頭痛、結腸腺癌、遠隔転移を伴う膵癌、肝細胞癌、びまん性大細胞型B細胞性リンパ腫、腎新生物、B細胞性リンパ腫、リンパ腫、悪性中皮腫、陰茎扁平上皮癌、肝癌、肝転移、血管腫、口唇扁平上皮癌、子宮内膜腺癌、小細胞癌、直腸腺癌、乳癌、肺扁平上皮癌、腹膜の悪性新生物、慢性骨髄単球性白血病、脈絡膜黒色腫、膀胱移行上皮癌、膀胱癌、膵癌、水腎症、急性腎前性腎不全、高窒素血症、糖尿病性腎症、尿失禁、尿道狭窄、悪心、下部消化管出血、臍ヘルニア、出血性十二指腸潰瘍、膵炎、胃腸ポリープ出血、胃排出不全、急性膵炎、十二指腸潰瘍、出血性消化性潰瘍、食道炎、食道静脈瘤出血、唾液腺結石、腸管虚血、腸管腫瘤、潰瘍性食道炎、便秘、慢性膵炎、深部静脈血栓症、末梢動脈狭窄、高血圧、大動脈狭窄、血栓症、高血圧クリーゼ、高血圧緊急症、大動脈瘤、動脈硬化症、胸水、器質化肺炎、気管支痙攣、睡眠時無呼吸症候群、低酸素症、肺臓炎、股関節部骨折、交通事故、大腿骨骨折、開放性眼球外傷、足関節部骨折、橈骨骨折、移植部位出血、化学性腹膜炎、角膜損傷、冠動脈再狭窄、顔面骨骨折、頚椎骨折、硬膜下出血、四肢損傷、耳部損傷、処置後胆汁漏出、前腕骨折、足骨折、熱傷、粉砕骨折、裂傷、腱断裂、高血糖性高浸透圧性非ケトン性症候群、高カリウム血症、低ナトリウム血症、血液量減少症、血液量増加症、成人潜在性自己免疫性糖尿病、糖尿病、ヘルニア痛、血管ステント再狭窄、溺死、発熱、末梢腫脹、頚部痛、横紋筋融解症、滑液包炎、関節障害、筋骨格系胸痛、リウマチ性多発筋痛、筋力低下、四肢痛、脊柱管狭窄症、仙腸骨炎、肝硬変、胆管瘻、胆嚢ポリープ、薬物性肝障害、増殖性網膜症、白内障手術、胃バイパス、硬膜下血腫除去、指修復手術、大菱形骨切除、胆嚢切除、膝関節形成、鉄欠乏性貧血、薬物依存、精神状態変化、双極性障害、躁病、血管炎性潰瘍、血管浮腫、皮膚筋炎、トロポニン増加、肝酵素上昇、血中カリウム増加、血中クレアチニン増加、回転性めまい、甲状腺機能亢進症、甲状腺腫瘤、アナフィラキシー反応、各1件)が報告された。また、投与中止に至った有害事象はリベルサス®14mg群で184例253件(悪心46件、嘔吐25件、下痢22件、食欲減退16件、腹部不快感10件、消化不良7件、便秘、リパーゼ増加、各6件、胃食道逆流性疾患、味覚異常、アミラーゼ増加、各4件、虚血性脳卒中、頭痛、結腸腺癌、膵酵素増加、無力症、各3件、鼓腸、低血糖、脳症、浮動性めまい、嗜眠、遠隔転移を伴う肺癌、遠隔転移を伴う膵癌、肝細胞癌、血中カルシトニン増加、体重減少、疲労、心筋梗塞、筋肉痛、そう痒症、発疹、各2件、おくび、レッチング、胃炎、胃排出不全、下部消化管出血、下腹部痛、虚血性大腸炎、酸消化性障害、腹痛、腹部膨満、膵炎、高血糖性高浸透圧性非ケトン性症候群、視神経炎、平衡障害、胃腺癌、遠隔転移を伴う悪性黒色腫、遠隔転移を伴う甲状腺癌、結腸癌、甲状腺髄様癌、肺転移、膵神経内分泌腫瘍、血中クレアチニン増加、悪寒、倦怠感、非心臓性胸痛、下気道感染、気管支炎、急性腎盂腎炎、脊髄炎、敗血症性ショック、肺結核、急性心筋梗塞、急性心不全、虚血性心筋症、心室細動、心停止、心房粗動、関節リウマチ、筋骨格系胸痛、病的骨折、アレルギー性皮膚炎、胸水、肺塞栓症、慢性閉塞性肺疾患、急性腎障害、腎前性腎不全、慢性腎臓病、硬膜下血腫、転倒、脳挫傷、うつ病、アルコール症、薬物依存、環状切除、胆嚢炎、大動脈解離、回転性めまい、過敏症、各1件)、プラセボ群で104例132件(悪心8件、下痢6件、嘔吐、消化不良、急性腎障害、各4件、浮動性めまい、肺炎、急性心筋梗塞、胆石症、各3件、腹部不快感、急性膵炎、食欲減退、虚血性脳卒中、頭痛、胆管細胞癌、膵腺癌、無力症、疲労、慢性腎臓病、各2件、腹痛、腹部膨満、胃腸障害、胃潰瘍、後天性食道ウエッブ、上腹部痛、食道炎、高カリウム血症、高リパーゼ血症、高血糖、成人潜在性自己免疫性糖尿病、痛風、味覚異常、レヴィ小体型認知症、虚血性脳梗塞、傾眠、健忘、神経毒性、末梢性ニューロパチー、結腸腺癌、遠隔転移を伴う膵癌、肝細胞癌、胃腺癌、悪性中皮腫、肝癌、肝転移、形質細胞性骨髄腫、舌扁平上皮癌、慢性骨髄単球性白血病、膵癌、膵酵素増加、血中カルシトニン増加、血中クレアチニン増加、空腹、発熱、胃腸炎、術後創感染、胆道性敗血症、膿瘍、敗血症、急性心不全、うっ血性心不全、右室不全、上室性頻脈、心腎症候群、動悸、慢性心不全、筋肉痛、頚部痛、そう痒症、血管浮腫、皮膚潰瘍、慢性閉塞性肺疾患、発声障害、下部尿路症状、腎症、糖尿病性腎症、移植部位出血、易刺激性、双極性障害、躁病、胃バイパス、肝硬変、急性胆嚢炎、起立性低血圧、大動脈狭窄、低血圧、末梢動脈閉塞性疾患、過敏症、サルコイドーシス、黄斑症、鉄欠乏性貧血、勃起不全、甲状腺機能亢進症、各1件)で報告された。死亡はリベルサス®14mg群で23例(心臓病による突然死、悪性腫瘍、感染 など)、プラセボ群で45例(心臓病による突然死、悪性腫瘍、急性心筋梗塞 など)に認められた。
6. 用法及び用量
通常、成人には、セマグルチド(遺伝子組換え)として1日1回7mgを維持用量とし経口投与する。ただし、1日1回3mgから開始し、4週間以上投与した後、1日1回7mgに増量する。なお、患者の状態に応じて適宜増減するが、1日1回7mgを4週間以上投与しても効果不十分な場合には、1日1回14mgに増量することができる。
7. 用法及び用量に関連する注意(抜粋)
7.1 本剤の吸収は胃の内容物により低下することから、本剤は、1日のうちの最初の食事又は飲水の前に、空腹の状態でコップ約半分の水(約120mL 以下)とともに3mg錠、7mg錠又は14mg錠を1錠服用すること。また、服用時及び服用後少なくとも30分は、飲食及び他の薬剤の経口摂取を避けること。分割・粉砕及びかみ砕いて服用してはならない。[電子添文16.2.1-16.2.3参照]
ADA:米国糖尿病学会 CI:信頼区間 EOT:最終評価時 FAS:最大の解析対象集団 HR:ハザード比 SAS:安全性解析対象集団 SOC:器官別大分類
【禁忌を含む使用上の注意】等はこちらをご参照ください。