KEYNOTE-590試験(1次治療:化学療法併用)
KEYNOTE-590試験(1次治療:化学療法併用)
承認時評価資料: 国際共同第Ⅲ相試験(KEYNOTE-590試験)
Sun JM et al. Lancet 2021: 398; 759-771
Kojima T et al. Esophagus 2022: 19: 683-692
本試験はMSD社の資金提供により行われた。
Jong-Mu SunはMSD社から研究費などを受領している。その他の著者に同社から顧問料などを受領している者が含まれる。著者のうち、Qi Liu、Sukrut Shah、Pooja BhagiaはMSD社の社員である。
Takashi KojimaはMSD社から研究費などを受領している。その他の著者にMSD社より顧問料などを受領している者が含まれる。著者のうち、Shirong Han、Tomoko Sakata、Naoyoshi YatsuzukaはMSD社の社員である。
試験概要
KEYNOTE-590試験は、根治切除不能な進行・再発食道癌の1次治療において初めて優越性が検証された国際共同第Ⅲ相試験です。
【目的】
根治切除不能な進行・再発の食道癌の1次治療における、キイトルーダ®化学療法併用群(キイトルーダ®とシスプラチン及び5-FUの併用)と、化学療法群(プラセボとシスプラチン及び5-FUの併用)の有効性及び安全性を比較検討する。
【デザイン】
国際共同無作為化二重盲検第Ⅲ相試験[優越性検証試験][中間解析結果(データカットオフ日:2020年7月2日)]
【対象】
根治切除不能な進行・再発の食道癌(食道扁平上皮癌(ESCC*1)及びSiewert分類typeⅠ食道胃接合部腺癌含む食道腺癌
(EAC*2))患者749例(日本人患者141例を含む)
【方法】
キイトルーダ®化学療法併用群(キイトルーダ® 200mgとシスプラチン 80mg/m2を1日目、5-FU 800mg/m2/日を1日目〜5日目まで持続静注を3週間間隔で投与)、化学療法群(プラセボとシスプラチン 80mg/m2を1日目、5-FU 800mg/m2/日を1日目〜5日目まで持続静注を3週間間隔で投与)の2群に1:1の割合で無作為に割り付けた。ベースライン時と無作為割り付け後は9週間毎に患者の疾患状態を画像診断により評価した。疾患進行又は許容できない毒性発現等まで投与を継続した。各群ともシスプラチンの投与は最大で6サイクルまで、キイトルーダ®及びプラセボ、5-FUの投与は最大で35サイクルまでとした。
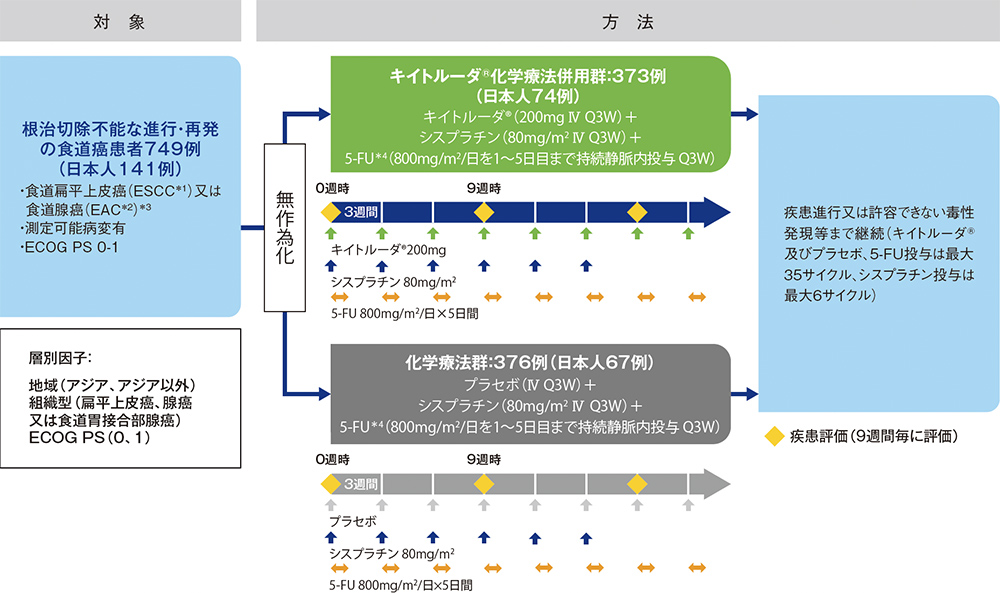
【評価項目】
主要評価項目※1:
●全生存期間(overall survival; OS)
・ITT集団*5
・ESCC患者
・PD-L1*6発現陽性(CPS*7≧10)患者
・ESCCかつCPS≧10患者
●無増悪生存期間(progression free survival; PFS)
・ITT集団
・ESCC患者
・CPS≧10患者
副次評価項目:
●奏効率(objective response rate; ORR)※2、奏効期間(duration of response; DOR)及び健康関連のQOLに関するPRO*8(EORTC QLQ-C30、QLQ-OES18)
・ITT集団
・ESCC患者
・CPS≧10患者
・ESCCかつCPS≧10患者
●安全性
探索的評価項目:健康関連のQOLに関するPRO(EQ-5D)など
※1 検証的解析項目 ※2 ITT集団は検証的解析項目
【判定基準】
PFS、ORR及びDORは治験担当医師がRECISTガイドライン1.1版に基づき評価した。
【解析計画】
解析対象集団:有効性はITT集団、安全性はASaT集団*9を解析対象とした。
有効性評価の統計手法:主要評価項目であるOS及びPFSは、層別ログランク検定を用いて評価し、投与群を共変量とした層別Cox比例ハザードモデルを用いてハザード比を推定した。Kaplan-Meier法を用いて経時的なイベント発生率を投与群ごとに推定した。副次評価項目のORRは層別Miettinen and Nurminen法、DORはKaplan-Meier法を用いて評価した。層別ログランク検定及び層別Cox比例ハザードモデルは、層別因子として、地域(アジア又はアジア以外)、組織型(ESCC又はEAC)及びECOG PS(0又は1)を用いた。QOLの結果における治療効果の評価は、制約付き経時データ解析モデルを用い、スコアの悪化までの期間は層別Coxモデル及びKaplan-Meier法を、改善率については層別Miettinen and Nurminen法を用いて解析した。主要評価項目(OS、PFS)のサブグループ解析を、地域(アジア又はアジア以外)、組織型(ESCC又はEAC)、ECOG PS(0又は1)、年齢(65歳未満又は65歳以上)、性別(男性又は女性)、癌の状態(局所進行又は転移)に基づいて実施した。なお、主要評価項目(OS、PFS)のサブグループ解析のうち、PD-L1発現率(CPS≧10又はCPS<10)に基づく解析は、治験実施計画書には記載されていないが、評価資料として承認時に評価された。また、日本人集団についてもITT集団と同様の統計手法にて検討した。
多重性の調整:本試験では7つの主要仮説(ITT集団、ESCC患者、CPS≧10患者及びESCCかつCPS≧10患者のOS、ITT集団、ESCC患者及びCPS≧10患者のPFS)について、1回の有効性の中間解析を事前に計画した。主要仮説と1つの副次仮説(ITT集団におけるORR)の多重性については、Maurer and Bretzのグラフィカルアプローチ方法を用いて試験全体の有意水準を片側2.5%に厳密に制御した。OSは中間解析及び最終解析の2回の解析を実施することとした。なお中間解析に関する多重性はLan-DeMetsによるO’Brien-Fleming型のα消費関数を用いて調整した。最初に、ESCCかつCPS≧10患者及びESCC患者におけるOSと、ESCC患者におけるPFSにおいて優越性を検定し、いずれかのOSの優越性が示された場合は次にCPS≧10患者、ITT集団の順でOSの優越性を、PFSの優越性が示された場合は、次にCPS≧10患者、ITT集団の順でPFSの優越性を検定することとした。また、ITT集団のORRは、全てのOS及びPFSの優越性が示された場合に検定することとした。
健康関連QOLに関するPROの統計手法:制約付き経時データ解析モデルを用いてベースラインから規定した時点までの最小二乗平均スコアの変化量に関する治療群間差を推定し、スコアの悪化までの期間は層別Coxモデル及びKaplan-Meier法を、改善率については層別Miettinen and Nurminen法を用いて解析した。
*1 ESCC(esophageal squamous cell carcinoma):食道扁平上皮癌
*2 EAC(esophageal adenocarcinoma):食道腺癌
*3 Siewert分類type Ⅰ食道胃接合部腺癌含む
*4 5-FUは投与量がQ3Wの1サイクルあたり計4,000mg/m2となっている限り(例:1,000mg/m2/日を1~4日目まで投与)、地域の標準手順に従ってよい。
*5 ITT(intention-to-treat)集団:無作為化したすべての患者
*6 PD-L1発現の評価は、IHC法(PD-L1 IHC 22C3 pharmDx「ダコ」)を用いて、治験薬投与前に採取された腫瘍組織検体中の腫瘍細胞及び炎症細胞を解析した
*7 CPS(combined positive score):PD-L1陽性細胞数(腫瘍細胞、リンパ球及びマクロファージ)を総腫瘍細胞数で除し、100を乗じた値
*8 PRO(patient reported outcome):患者報告アウトカム
*9 ASaT(all subjects as treated)集団:治験薬を1回以上投与されたすべての患者
シスプラチンの用法及び用量は以下のとおりです。
用法及び用量(抜粋)
1. 食道癌には、B法を標準的用法・用量とし、患者の状態によりA法を選択する。B法:シスプラチンとして50~70mg/m2(体表面積)を1日1回投与し、少なくとも3週間休薬する。これを1クールとし、投与を繰り返す。A法:シスプラチンとして15~20mg/m2(体表面積)を1日1回、5日間連続投与し、少なくとも2週間休薬する。これを1クールとし、投与を繰り返す。
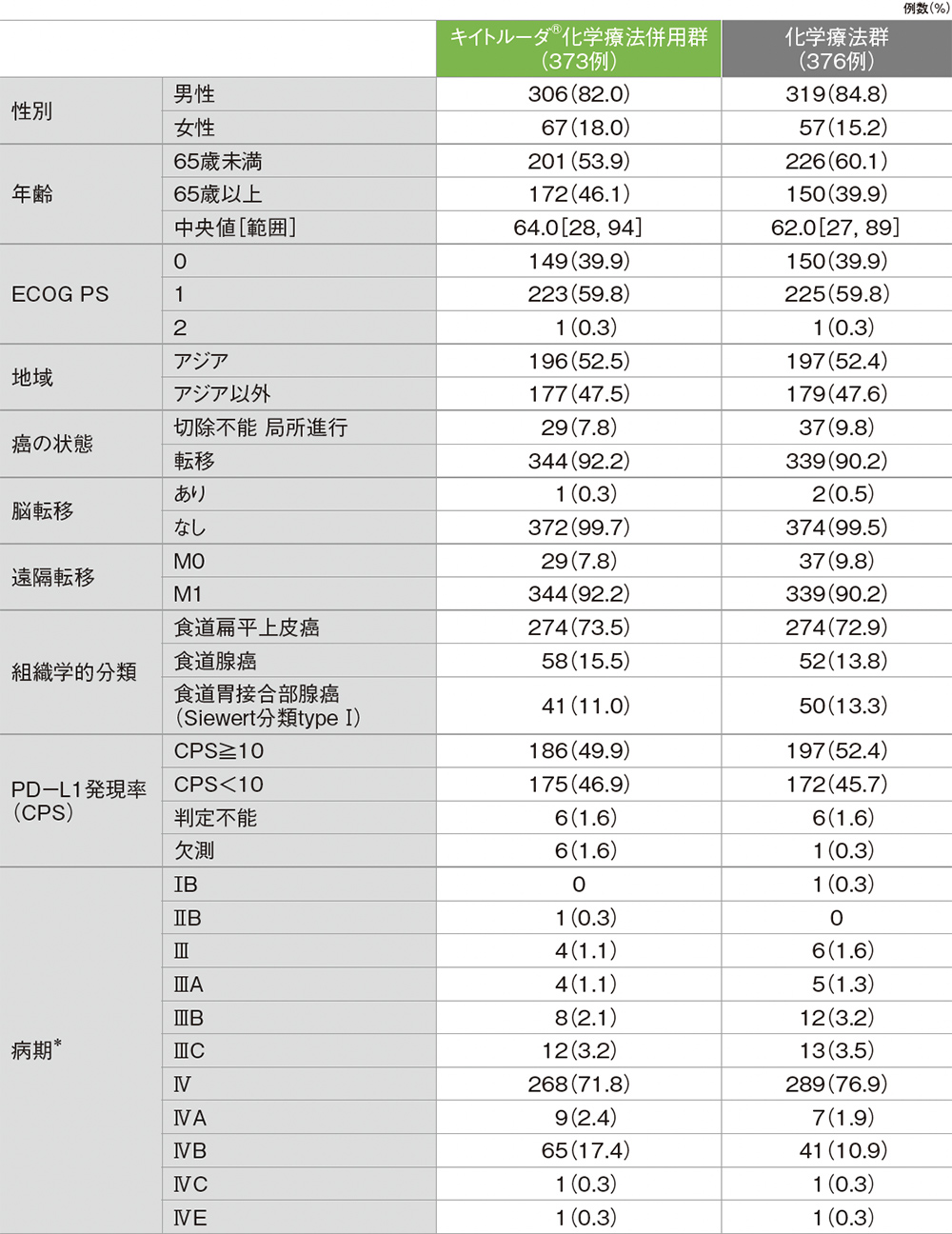
患者背景(ITT集団)
749例が無作為化され、キイトルーダ®化学療法併用群373例、化学療法群376例に割り付けられた。
年齢中央値はキイトルーダ®化学療法併用群64.0歳、化学療法群62.0歳であった。組織学的分類は食道扁平上皮癌(ESCC)がキイトルーダ®化学療法併用群73.5%、化学療法群72.9%、食道腺癌(EAC)がキイトルーダ®化学療法併用群15.5%、化学療法群13.8%、食道胃接合部腺癌(Siewert分類type I)がキイトルーダ®化学療法併用群11.0%、化学療法群13.3%であった。
*医師報告による集計
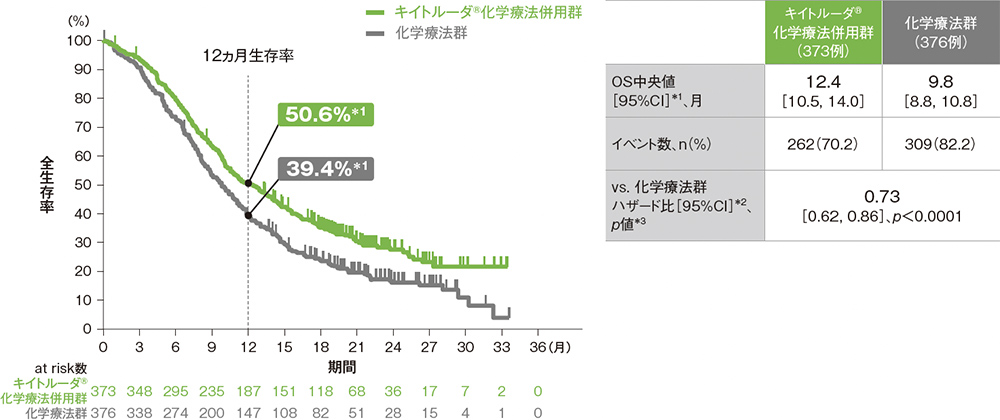
主要評価項目 全生存期間:OS(優越性検証試験)
キイトルーダ®とFP(シスプラチン及び5-FU)の併用療法は、根治切除不能な進行・再発の食道癌に対する1次治療薬として初めてFP療法に対してOS延長を示しました。
ITT集団における全生存期間:OS
OS中央値はキイトルーダ®化学療法併用群で12.4ヵ月(95%CI: 10.5, 14.0)、化学療法群で9.8ヵ月(95%CI: 8.8, 10.8)でした。化学療法群に対するキイトルーダ®化学療法併用群のOSのハザード比は0.73(95%CI: 0.62, 0.86)であり、OSを有意に延長しました(p<0.0001、層別ログランク検定[片側]、有意水準α=0.01421; 検証的解析結果)。
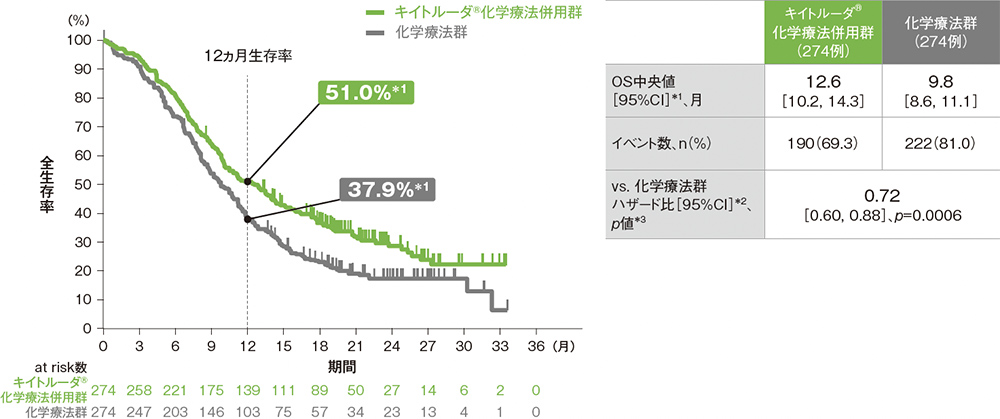
ESCC患者における全生存期間:OS
OS中央値はキイトルーダ®化学療法併用群で12.6ヵ月(95%CI: 10.2, 14.3)、化学療法群で9.8ヵ月(95%CI: 8.6, 11.1)でした。化学療法群に対するキイトルーダ®化学療法併用群のOSのハザード比は0.72(95%CI: 0.60, 0.88)であり、OSを有意に延長しました(p=0.0006、層別ログランク検定[片側]、有意水準α=0.01003; 検証的解析結果)。
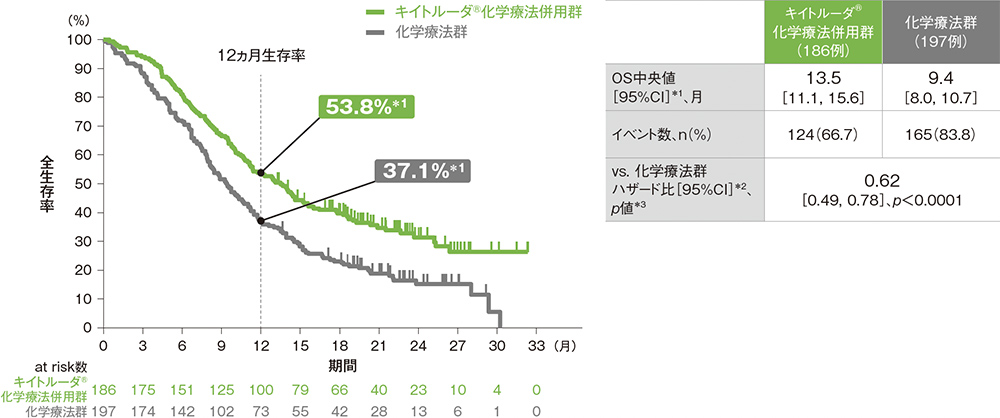
CPS≧10患者における全生存期間:OS
OS中央値はキイトルーダ®化学療法併用群で13.5ヵ月(95%CI: 11.1, 15.6)、化学療法群で9.4ヵ月(95%CI: 8.0, 10.7)でした。化学療法群に対するキイトルーダ®化学療法併用群のOSのハザード比は0.62(95%CI: 0.49, 0.78)であり、OSを有意に延長しました(p<0.0001、層別ログランク検定[片側]、有意水準α=0.01414; 検証的解析結果)。
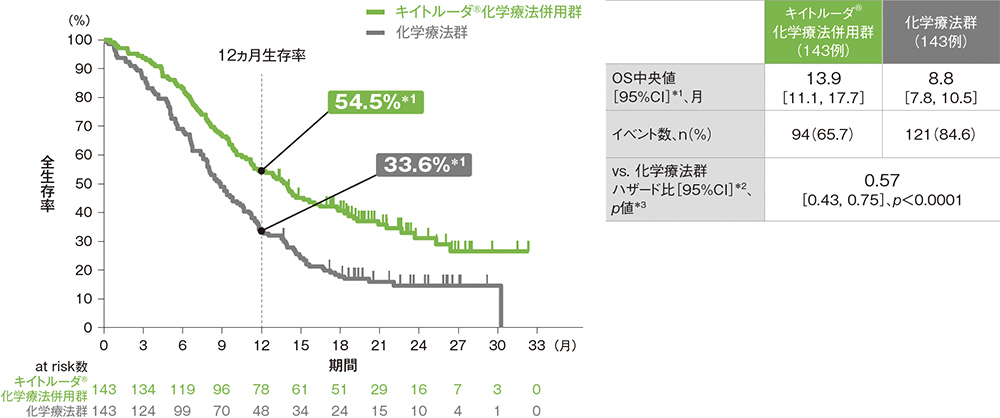
ESCCかつCPS≧10患者における全生存期間:OS
OS中央値はキイトルーダ®化学療法併用群で13.9ヵ月(95%CI: 11.1, 17.7)、化学療法群で8.8ヵ月(95%CI: 7.8, 10.5)でした。化学療法群に対するキイトルーダ®化学療法併用群のOSのハザード比は0.57(95%CI: 0.43, 0.75)であり、OSを有意に延長しました(p<0.0001、層別ログランク検定[片側]、有意水準α=0.0067; 検証的解析結果)。
ITT集団の追跡期間中央値:キイトルーダ®化学療法併用群 12.6ヵ月[範囲:0.1, 33.6]、化学療法群 9.8ヵ月[範囲:0.1, 33.6]
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、層別Cox比例ハザードモデルに基づいてハザード比を推定した。
*3 層別ログランク検定[片側]、各集団の有意水準αは次の通りであった。
[ITT集団:α=0.01421、ESCC患者:α=0.01003、CPS≧10患者:α=0.01414、ESCCかつCPS≧10患者:α=0.0067]
※ 層別Cox比例ハザードモデル及び層別ログランク検定に用いられた各集団の層別因子は次の通りであった。
[ITT集団:地域(アジア、アジア以外)、組織型(扁平上皮癌、腺癌)、ECOG PS(0、1)][ESCC患者及びESCCかつCPS≧10患者:地域(アジア、アジア以外)、ECOG PS(0、1)][CPS≧10患者:地域(アジア、アジア以外)、組織型(扁平上皮癌、腺癌)]
主要評価項目 無増悪生存期間: PFS(優越性検証試験)
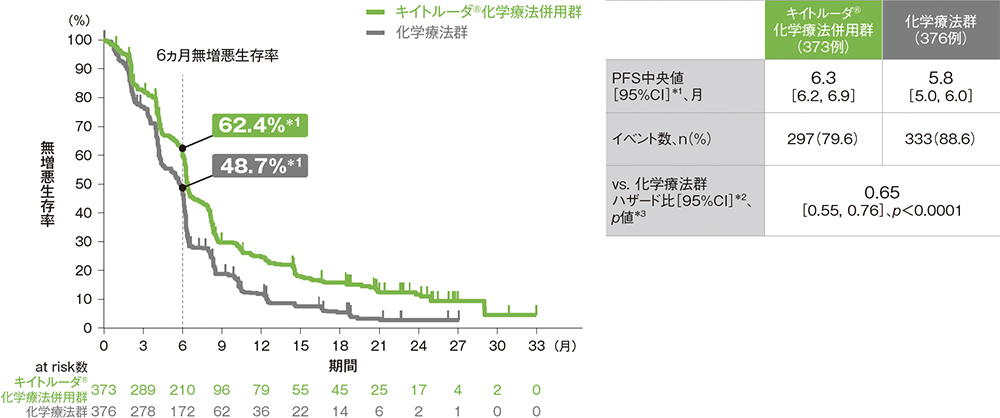
ITT集団における無増悪生存期間:PFS
PFS中央値はキイトルーダ®化学療法併用群で6.3ヵ月(95%CI: 6.2, 6.9)、化学療法群で5.8ヵ月(95%CI: 5.0, 6.0)でした。化学療法群に対するキイトルーダ®化学療法併用群のPFSのハザード比は0.65(95%CI: 0.55, 0.76)であり、PFSを有意に延長しました(p<0.0001、層別ログランク検定[片側]、有意水準α=0.02477; 検証的解析結果)。
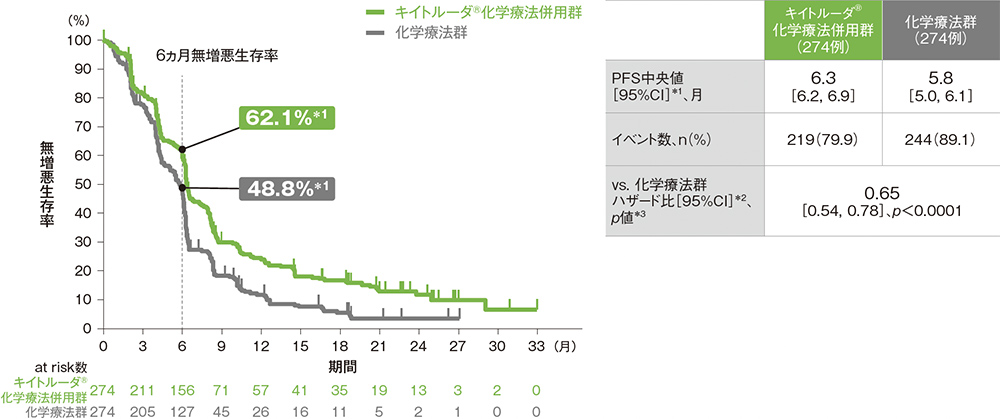
ESCC患者における無増悪生存期間:PFS
PFS中央値はキイトルーダ®化学療法併用群で6.3ヵ月(95%CI: 6.2, 6.9)、化学療法群で5.8ヵ月(95%CI: 5.0, 6.1)でした。化学療法群に対するキイトルーダ®化学療法併用群のPFSのハザード比は0.65(95%CI: 0.54, 0.78)であり、PFSを有意に延長しました(p<0.0001、層別ログランク検定[片側]、有意水準α=0.002; 検証的解析結果)。
CPS≧10患者における無増悪生存期間:PFS
PFS中央値はキイトルーダ®化学療法併用群で7.5ヵ月(95%CI: 6.2, 8.2)、化学療法群で5.5ヵ月(95%CI: 4.3, 6.0)でした。化学療法群に対するキイトルーダ®化学療法併用群のPFSのハザード比は0.51(95%CI: 0.41, 0.65)であり、PFSを有意に延長しました(p<0.0001、層別ログランク検定[片側]、有意水準α=0.002; 検証的解析結果)。
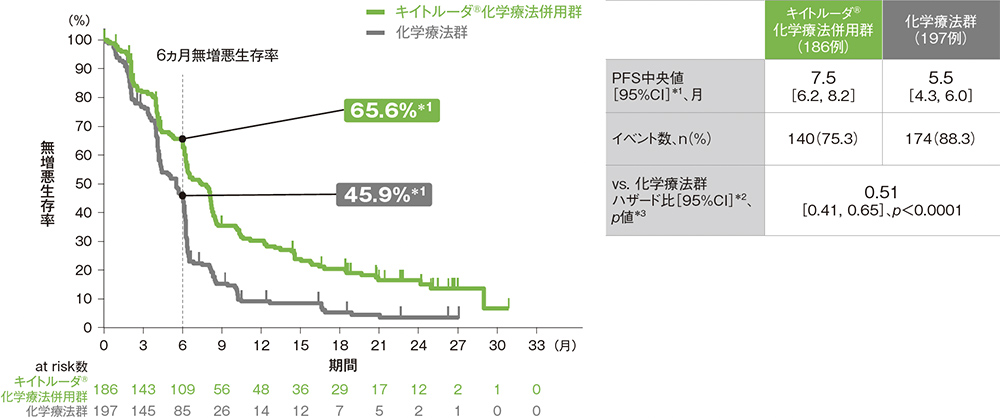
治験担当医師によるRECISTガイドライン1.1版に基づいた評価
ITT集団の追跡期間中央値:キイトルーダ®化学療法併用群 12.6ヵ月[範囲:0.1, 33.6]、化学療法群 9.8ヵ月[範囲:0.1, 33.6]
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、層別Cox比例ハザードモデルに基づいてハザード比を推定した。
*3 層別ログランク検定[片側]、各集団の有意水準αは次の通りであった。
[ITT集団:α=0.02477、ESCC患者及びCPS≧10患者:α=0.002]
※ 層別Cox比例ハザードモデル及び層別ログランク検定に用いられた各集団の層別因子は次の通りであった。[ITT集団:地域(アジア、アジア以外)、組織型(扁平上皮癌、腺癌)、ECOG PS(0、1)][ESCC患者:地域(アジア、アジア以外)、ECOG PS(0、1)][CPS≧10患者:地域(アジア、アジア以外)、組織型(扁平上皮癌、腺癌)]
副次評価項目 奏効率: ORR
ITT集団においてORRは、キイトルーダ®化学療法併用群45.0%、化学療法群29.3%であり、優越性が検証されました(p<0.0001、層別Miettinen and Nurminen法[片側]、有意水準α=0.025; 検証的解析結果)。
また、各患者集団のORRについては下に示すとおりでした。
なお、ORRの優越性はITT集団でのみ検定されました。
奏効率(ORR:CR+PR)
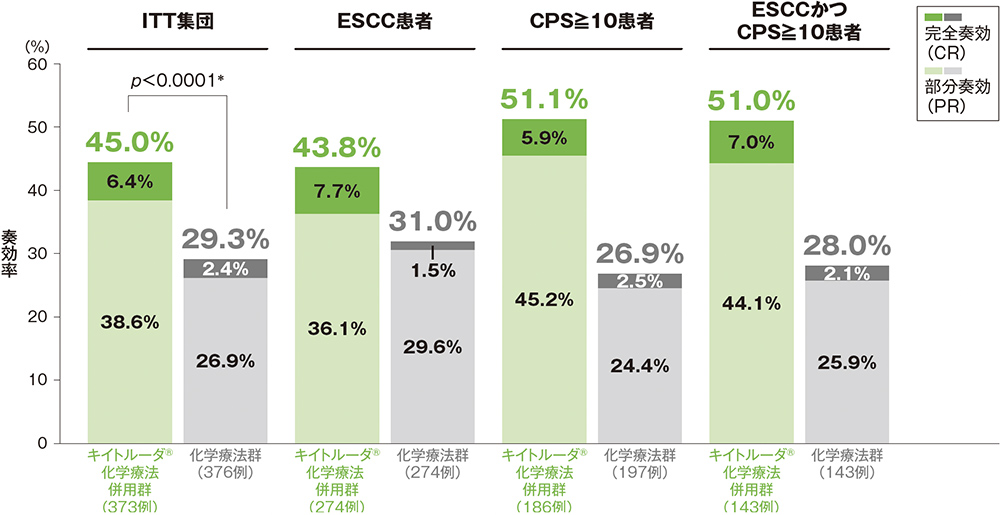
奏効率及び最良総合効果
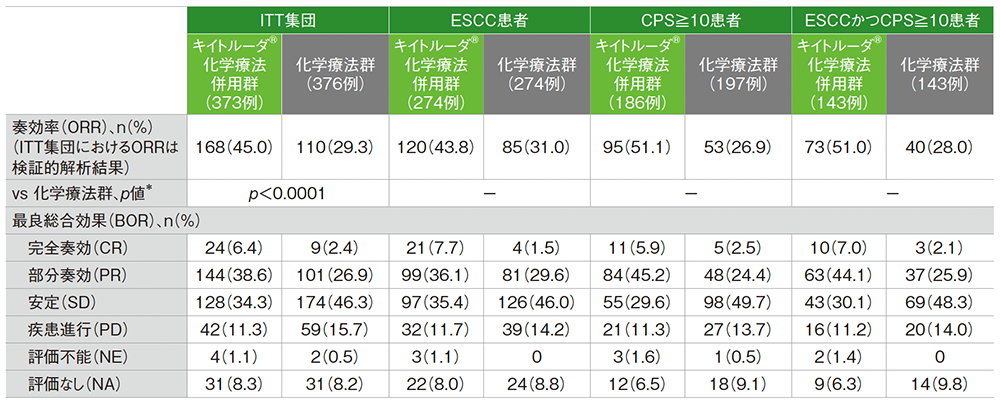
治験担当医師によるRECISTガイドライン1.1版に基づいた評価
ITT集団の追跡期間中央値:キイトルーダ®化学療法併用群 12.6ヵ月[範囲:0.1, 33.6]、化学療法群 9.8ヵ月[範囲:0.1, 33.6]
*地域(アジア、アジア以外)、組織型(扁平上皮癌、腺癌)、ECOG PS(0、1)を層別因子とした層別Miettinen and Nurminen法[片側]、有意水準α=0.025
副次評価項目 奏効期間: DOR
ITT集団において、DOR中央値はキイトルーダ®化学療法併用群で8.3ヵ月(範囲:1.2+,31.0+)、化学療法群で6.0ヵ月(範囲:1.5+,25.0+)でした。また、各患者集団のDORについては下に示すとおりでした。
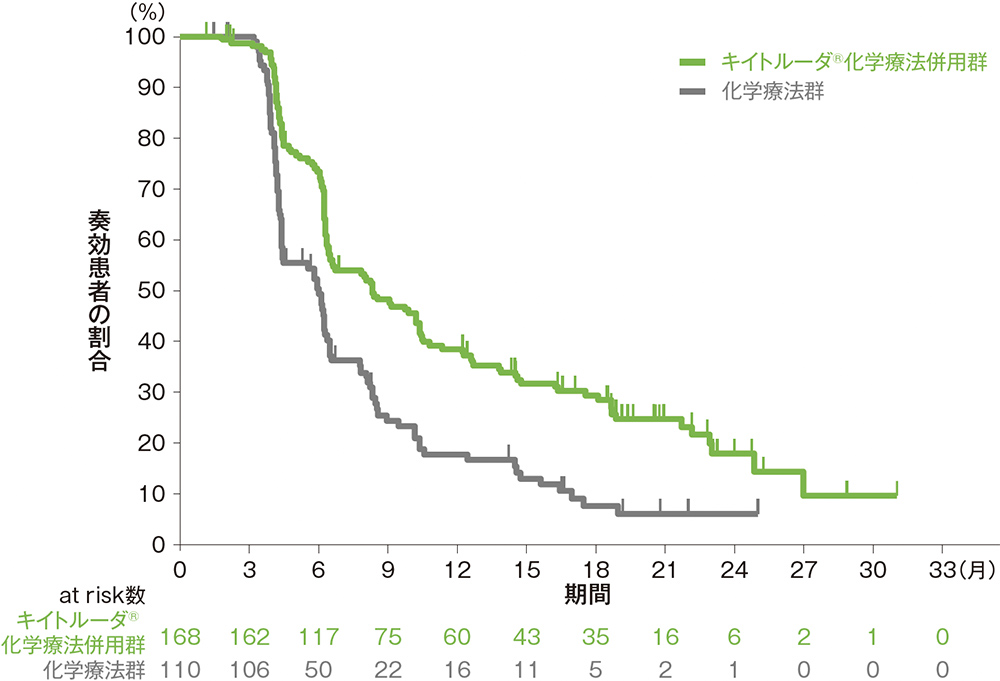
奏効までの期間及び奏効期間(DOR)の要約
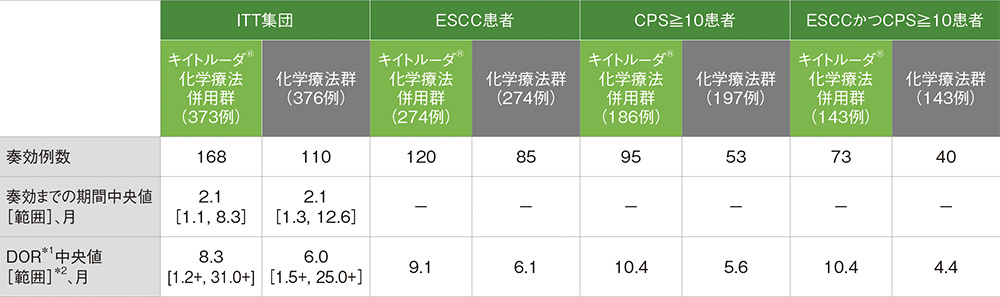
ITT集団の追跡期間中央値:キイトルーダ®化学療法併用群 12.6ヵ月[範囲:0.1, 33.6]、化学療法群 9.8ヵ月[範囲:0.1, 33.6]
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 「+」は最後の疾患評価までにPDがみられないことを示す
安全性
キイトルーダ®化学療法併用群
キイトルーダ®化学療法併用群の副作用は364/370例(98.4%)に認められました。主な副作用(発現率20%以上)は、悪心233例(63.0%)、食欲減退145例(39.2%)、貧血143例(38.6%)、疲労、好中球数減少 各135例(36.5%)、嘔吐110例(29.7%)、下痢97例(26.2%)、好中球減少症、口内炎 各96例(25.9%)、白血球数減少89例(24.1%)でした。
重篤な副作用は117例(31.6%)に認められました。5例以上にみられた重篤な副作用は、肺炎13例(3.5%)、肺臓炎12例(3.2%)、発熱性好中球減少症9例(2.4%)、急性腎障害、嘔吐 各8例(2.2%)、低ナトリウム血症7例(1.9%)、食欲減退6例(1.6%)、下痢、低カリウム血症、悪心、好中球減少症、血小板数減少 各5例(1.4%)でした。
いずれかの治験薬で投与中止に至った副作用は72例(19.5%)に認められ、5例以上にみられた投与中止に至った副作用は、血中クレアチニン増加8例(2.2%)、肺臓炎6例(1.6%)でした。
副作用による死亡は9例(2.4%)で、その内訳は多臓器機能不全症候群、肺塞栓症、間質性肺疾患、肺臓炎、発熱性好中球減少症、肺炎、急性腎障害、下痢、肝不全 各1例(0.3%)でした。
化学療法群
化学療法群の副作用は360/370例(97.3%)に認められました。主な副作用(発現率20%以上)は、悪心220例(59.5%)、貧血162例(43.8%)、食欲減退119例(32.2%)、好中球数減少109例(29.5%)、疲労107例(28.9%)、嘔吐99例(26.8%)、口内炎93例(25.1%)、好中球減少症88例(23.8%)、下痢85例(23.0%)でした。
重篤な副作用は97例(26.2%)に認められました。5例以上にみられた重篤な副作用は、発熱性好中球減少症12例(3.2%)、血小板数減少8例(2.2%)、悪心7例(1.9%)、嘔吐、貧血 各6例(1.6%)、急性腎障害、口内炎、好中球数減少、疲労 各5例(1.4%)でした。
いずれかの治験薬で投与中止に至った副作用は42例(11.4%)に認められ、5例以上にみられた投与中止に至った副作用は、血中クレアチニン増加10例(2.7%)でした。
副作用による死亡は5例(1.4%)で、その内訳は敗血症、間質性肺疾患、死亡、発熱性好中球減少症、多臓器機能不全症候群 各1例(0.3%)でした。
副作用(いずれかの投与群で発現率10%以上)(ASaT集団)
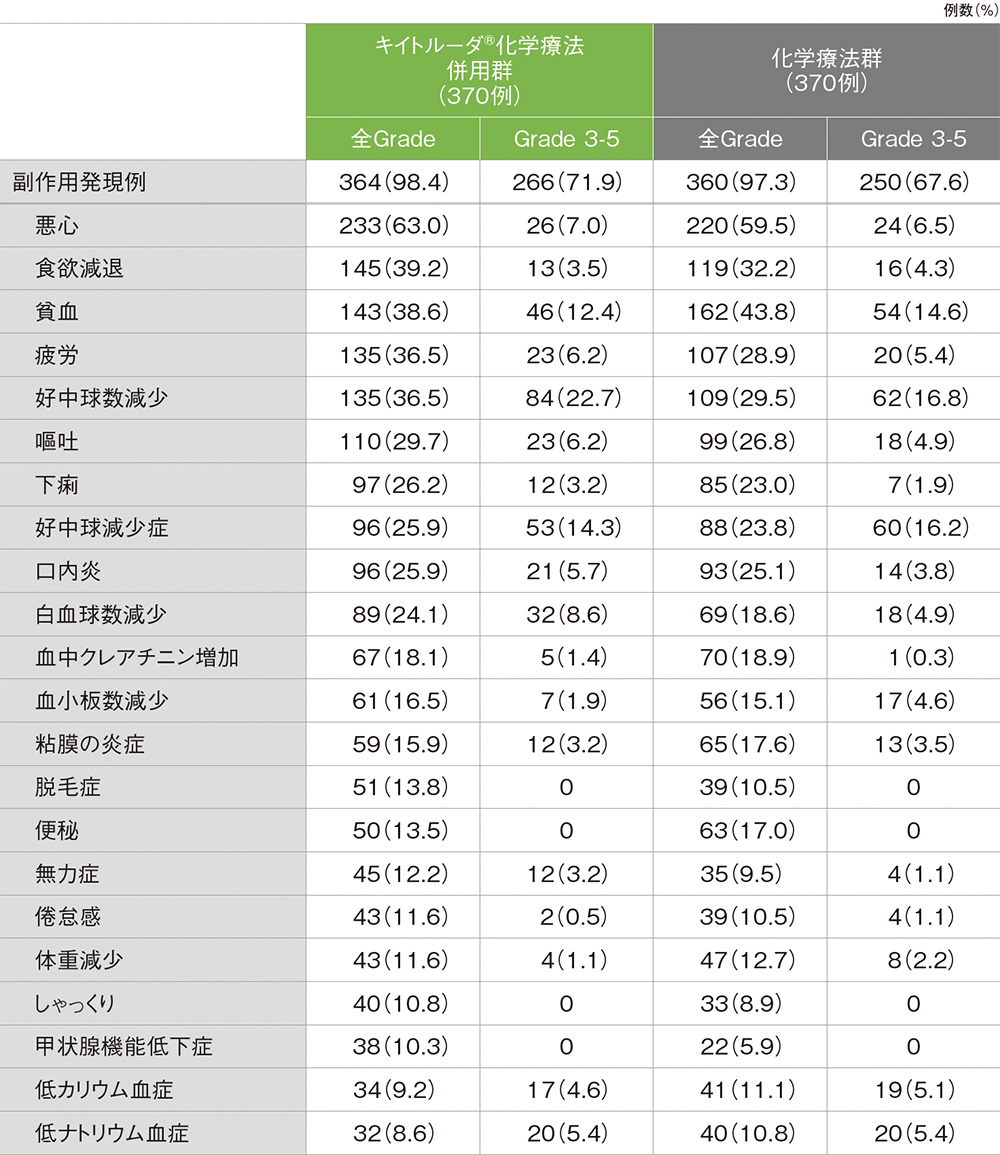
MedDRA/J v23.0、GradeはNCI CTCAE v4.03
免疫関連など特に注目すべき有害事象
キイトルーダ®化学療法併用群
キイトルーダ®化学療法併用群の免疫関連など特に注目すべき有害事象は95/370例(25.7%)に認められ、2例以上にみられた免疫関連など特に注目すべき有害事象は、甲状腺機能低下症40例(10.8%)、肺臓炎21例(5.7%)、甲状腺機能亢進症20例(5.4%)、大腸炎6例(1.6%)、副腎機能不全、注入に伴う反応、斑状丘疹状皮疹 各4例(1.1%)、肝炎3例(0.8%)、自己免疫性肝炎、下垂体機能低下症、過敏症、膵炎、間質性肺疾患 各2例(0.5%)でした。
重篤な免疫関連など特に注目すべき有害事象は30例(8.1%)に認められ、その内訳は肺臓炎12例(3.2%)、大腸炎4例(1.1%)、自己免疫性肝炎、間質性肺疾患、斑状丘疹状皮疹 各2例(0.5%)、副腎機能不全、自己免疫性大腸炎、腸炎、肝炎、甲状腺機能亢進症、バセドウ病、下垂体機能低下症、下垂体炎、注入に伴う反応 各1例(0.3%)でした。
いずれかの治験薬で投与中止に至った免疫関連など特に注目すべき有害事象は16例(4.3%)に認められ、その内訳は肺臓炎6例(1.6%)、注入に伴う反応、間質性肺疾患 各2例(0.5%)、大腸炎、腸炎、肝炎、自己免疫性肝炎、過敏症、尿細管間質性腎炎 各1例(0.3%)でした。
死亡に至った免疫関連など特に注目すべき有害事象は2例(0.5%)で、その内訳は肺臓炎、間質性肺疾患 各1例(0.3%)でした。
化学療法群
化学療法群の免疫関連など特に注目すべき有害事象は43/370例(11.6%)に認められ、2例以上にみられた免疫関連など特に注目すべき有害事象は、甲状腺機能低下症24例(6.5%)、大腸炎4例(1.1%)、甲状腺機能亢進症3例(0.8%)、副腎機能不全、過敏症、間質性肺疾患、腸炎、薬物過敏症 各2例(0.5%)でした。
重篤な免疫関連など特に注目すべき有害事象は7例(1.9%)に認められ、その内訳は大腸炎、腸炎、過敏症、尿細管間質性腎炎、膵炎、間質性肺疾患、斑状丘疹状皮疹 各1例(0.3%)でした。
いずれかの治験薬で投与中止に至った免疫関連など特に注目すべき有害事象は2例(0.5%)に認められ、その内訳は尿細管間質性腎炎、間質性肺疾患 各1例(0.3%)でした。
死亡に至った免疫関連など特に注目すべき有害事象は間質性肺疾患1例(0.3%)でした。
免疫関連など特に注目すべき有害事象(ASaT集団)
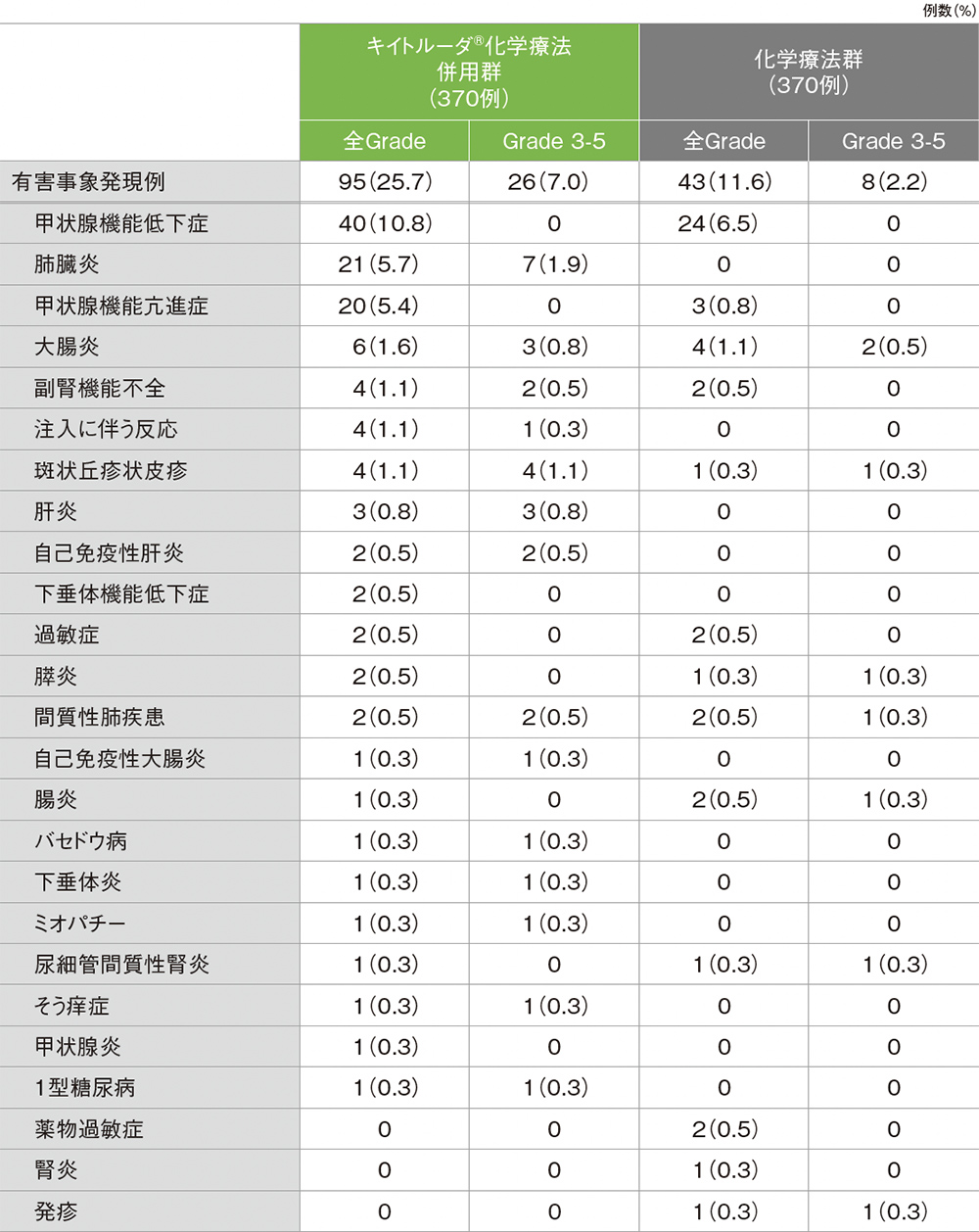
MedDRA/J v23.0、GradeはNCI CTCAE v4.03
関連コンテンツ
キイトルーダ®・悪性腫瘍関連領域情報
関連製品
