PD-L1検査の臨床的意義
「警告・禁忌を含む注意事項等情報」等はこちらをご参照ください。
PD-L1検査の臨床的意義
はじめに
監修
昭和大学横浜市北部病院
臨床病理診断科 教授
根本 哲生 先生
近年、分子標的治療薬や免疫チェックポイント阻害薬の登場、またパネル検査の保険収載に伴い、治療の適否や効果予測に関わる病理診断の重要性はますます高まっています。
そのような状況下で、キイトルーダ®は、2020年8月に「がん化学療法後に増悪したPD-L1陽性の根治切除不能な進行・再発の食道扁平上皮癌」の効能又は効果追加の承認を取得し、2021年11月にはPD-L1陽性の根治切除不能な進行・再発の食道扁平上皮癌患者に対する2次治療と根治切除不能な進行・再発の食道癌患者に対する1次治療が統合した「根治切除不能な進行・再発の食道癌」の効能又は効果一部変更の承認を取得しました。キイトルーダ®はT細胞機能を負に制御するPD-L1及びPD-L2のPD-1への結合を阻害する抗体であり、PD-L1を発現する癌細胞や炎症細胞が多い症例に抗腫瘍作用が期待されます。食道扁平上皮癌症例への単独投与の適応は、「コンパニオン診断薬※1」(PD-L1 IHC 22C3 pharmDx「ダコ」[Autostainer Link 48用])を用いた免疫染色標本のCombined Positive Score(CPS)によって判定されます。
CPSは、腫瘍細胞に加えて、腫瘍浸潤免疫細胞(リンパ球、マクロファージ)も評価対象として陽性細胞率を算出するスコアです。本邦では、2019年に頭頸部癌の治療方針を判断するために導入されたコンプリメンタリー診断薬※1を使用する評価方法で、肺癌でコンパニオン診断薬※1を用いて腫瘍細胞のみを評価するTumor Proportion Score(TPS)とは異なることに注意が必要です。
食道扁平上皮癌の2次治療に対するキイトルーダ®単独療法承認の根拠となった国際共同第Ⅲ相試験(KEYNOTE-181試験)では、CPS≧10 の症例(切除不能進行・再発食道扁平上皮癌患者、2次治療以降)において、化学療法群を対照としたキイトルーダ®群の有効性成績が得られた1,2)ことから、実際の使用適応の判断にもCPS≧10をカットオフとする評価が用いられることとなりました。
以上のように、キイトルーダ®使用の組織学的判断(PD-L1検査)においては、CPSについて十分にご理解いただくことが非常に重要であると考え、サイトではCPSの計算方法や評価対象細胞の詳細についてページを割いて説明させていただいています。それと同時に、検体の取り扱い(固定・包埋・薄切・染色など)についても精度管理が求められることも忘れてはなりません。本サイトが、多くの施設におけるPD-L1検査の均一化につながり、キイトルーダ®が根治切除不能な進行・再発の食道扁平上皮癌の治療に寄与することを希望します。
IHC:Immunohistochemistry(免疫組織化学的染色)
※1 コンパニオン診断薬は、特定の医薬品の有効性や安全性を担保するために、その医薬品の投与に先立って必須の診断において使用されます。一方、コンプリメンタリー診断薬は、医薬品の有効性や安全性に対して参考になりますが、必須ではありません。
1)承認時評価資料:国際共同第Ⅲ相試験(KEYNOTE-181試験)
2)キイトルーダ®製品電子添文詳細
食道癌に対するキイトルーダ®の「効能又は効果」、「用法及び用量」
効能又は効果(抜粋)
根治切除不能な進行・再発の食道癌
効能又は効果に関連する注意(抜粋)
〈根治切除不能な進行・再発の食道癌〉
5.17 がん化学療法後に増悪したPD-L1陽性の根治切除不能な進行・再発の食道扁平上皮癌に対して、本剤を単独で投与する場合には、PD-L1発現率(CPS)について、「17.臨床成績」の項の内容を熟知し、十分な経験を有する病理医又は検査施設における検査により、PD-L1の発現が確認された患者に投与すること。検査にあたっては、承認された体外診断用医薬品又は医療機器を用いること。なお、承認された体外診断用医薬品又は医療機器に関する情報については、以下のウェブサイトから入手可能である:
https://www.pmda.go.jp/review-services/drug-reviews/review-information/cd/0001.html
[17.1.21参照]
5.18 本剤の手術の補助療法における有効性及び安全性は確立していない。
用法及び用量(抜粋)
〈根治切除不能な進行・再発の食道癌〉
フルオロウラシル及びシスプラチンとの併用において、通常、成人には、ペムブロリズマブ(遺伝子組換え)として、1回200mgを3週間間隔又は1回400mgを6週間間隔で30分間かけて点滴静注する。がん化学療法後に増悪したPD-L1陽性の根治切除不能な進行・再発の食道扁平上皮癌に対しては、本剤を単独投与することもできる。
PD-L1検査の臨床的意義
●効果予測因子になり得る
PD-L1発現がキイトルーダ®の効果予測因子になり得る1,3)。
●治療選択に役立つ
PD-L1発現率(CPS:Combined Positive Score)を確認することにより、治療選択ができ、キイトルーダ®の適正使用に役立つ。
PD-L1検査のタイミング4)
PD-L1検査は、「がん化学療法後に増悪した根治切除不能な進行・再発の食道扁平上皮癌」の治療開始前に実施が考慮されます。
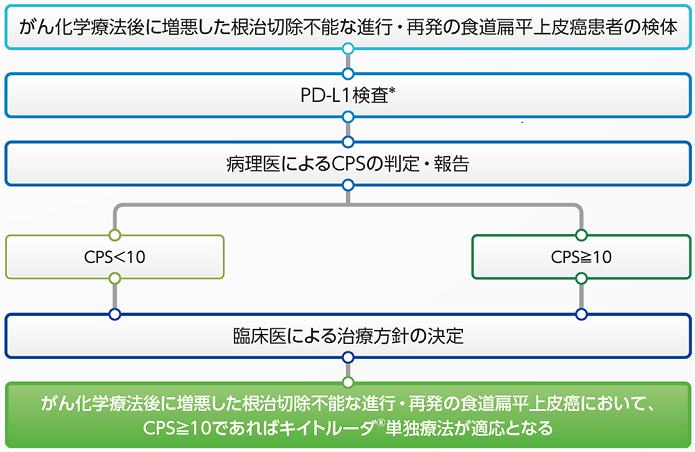
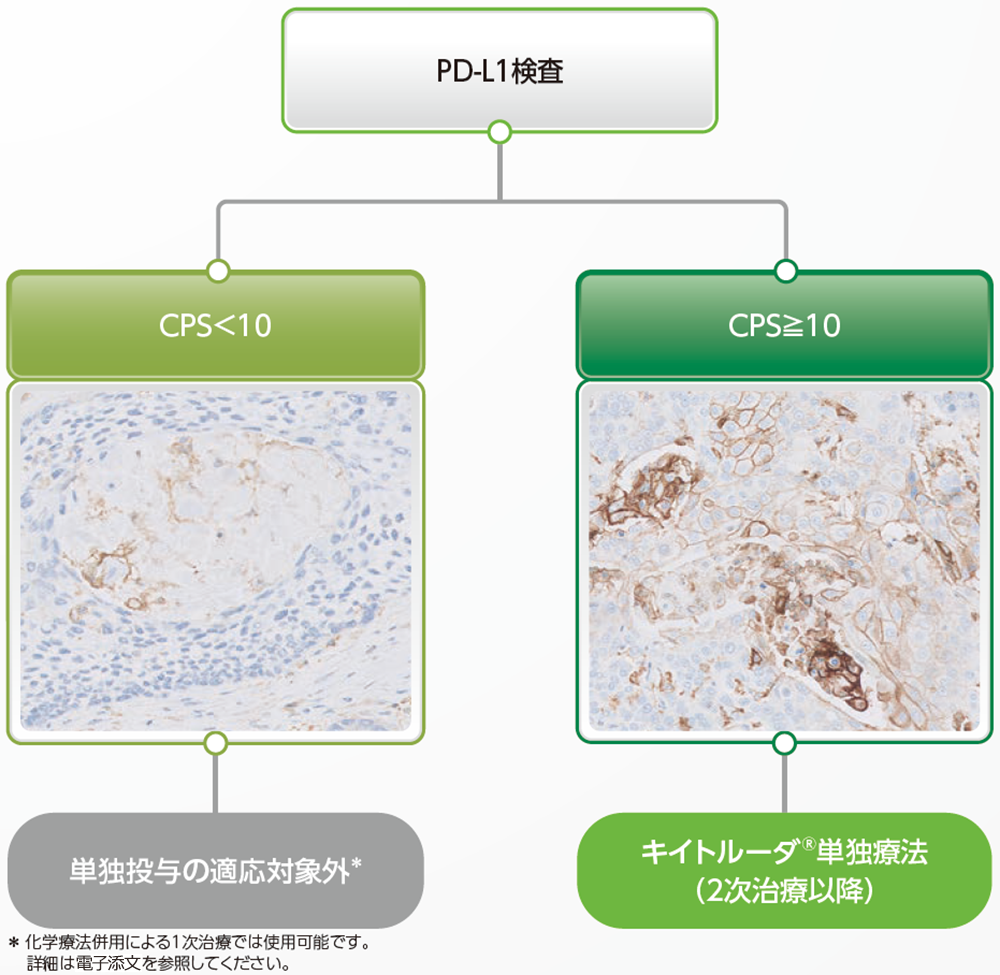
*PD-L1 IHC 22C3 pharmDx「ダコ」(ASL48用)によるPD-L1検査
がん化学療法後に増悪した根治切除不能な進行・再発の食道扁平上皮癌におけるキイトルーダ®治療対象の判定基準4)
がん化学療法後に増悪した根治切除不能な進行又は再発の食道扁平上皮癌患者では、PD-L1検査を行い、CPS≧10が確認された場合にキイトルーダ®の単独投与が可能です。
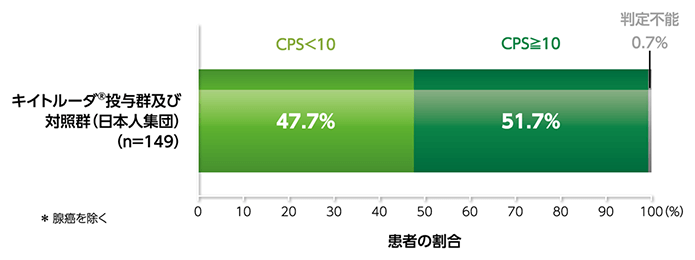
キイトルーダ®の臨床試験(KEYNOTE-181試験)における日本人食道扁平上皮癌(ESCC)患者*(149例)のPD-L1タンパク発現程度(CPSの分布)1)
KEYNOTE-181試験は、1次治療として全身治療歴のある切除不能進行・再発ESCC及びEAC(Siewert分類type Ⅰ食道胃接合部腺癌含む)患者628例(日本人患者152例を含む)を対象に、キイトルーダ®単剤と化学療法を比較した国際共同無作為化非盲検第Ⅲ相試験です。臨床成績の詳細につきましては、こちらをご参照ください。
CPSの評価において、PD-L1陽性細胞として加算すべき細胞
CPSの分子および分母の組み入れ/除外基準4)
CPSの評価において、分子あるいは分母に組み入れる細胞あるいは除外する細胞の種類は以下の表に示す通りです。
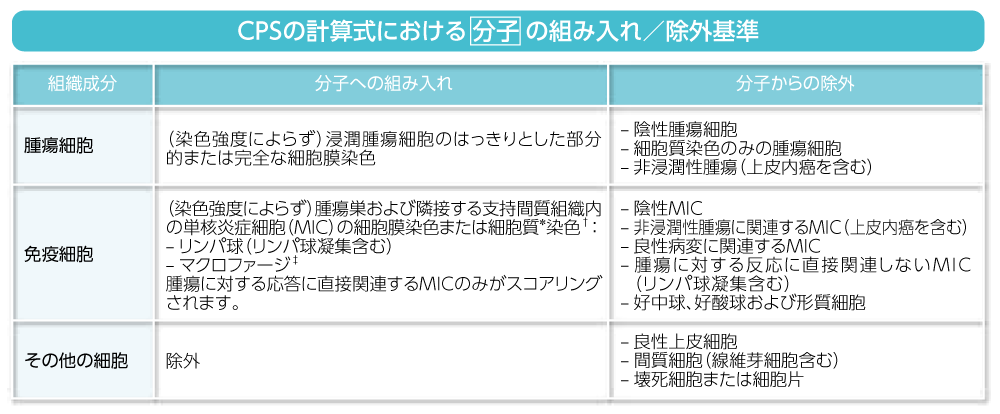
* MICでは、細胞質に対する細胞核の比率が高いため、多くの場合細胞膜染色と細胞質染色とは判別不能です。
このため、MICの細胞膜または細胞質染色はスコアリングに含まれます。
† 隣接するMICは腫瘍と同じ20倍視野内にあると定義されます。しかし、腫瘍に対する反応に直接関連しないMICは除外されます。
‡ マクロファージと組織球は同じ細胞と考えられます。

CPS(Combined Positive Score)の算出手順
CPSの算出方法4)
CPSの算出には、以下に示す計算式を用います。
CPSはTPSと異なり、浸潤癌で判定します。
計算式5)

※:CPSの評価において、分子あるいは分母に組み入れる細胞あるいは除外する細胞の種類については、上記の「CPSの評価において、PD-L1陽性細胞として加算すべき細胞」をご参照ください。

【参考】TPS(Tumor Proportion Score)の計算式

Ⅳ期非小細胞肺癌におけるPD-L1検査では、TPS(Tumor Proportion Score)が指標として用いられており、腫瘍細胞のみが評価対象細胞となっています。
<2次治療:単剤>
国際共同第Ⅲ相試験:KEYNOTE-181試験1)の概要
引用文献
1)承認時評価資料:国際共同第Ⅲ相試験(KEYNOTE-181試験)
2)キイトルーダ®製品電子添文
3)承認時評価資料:国際共同第Ⅱ相試験(KEYNOTE-180試験)
4)PD-L1 IHC 22C3 pharmDx「ダコ」食道扁平上皮癌染色結果判定マニュアル
5)PD-L1 IHC 22C3 pharmDx「ダコ」(Code No. SK006)電子添文
関連コンテンツ
キイトルーダ®・悪性腫瘍関連領域情報
関連製品
