KEYNOTE-181試験(2次治療:単剤)
本剤は、一部承認外の効能又は効果による臨床試験の成績も含めた臨床データパッケージで評価され、承認されました。
そのため、国内で承認されている効能・効果と異なる海外データも紹介しています。
国際共同第Ⅲ相試験<KEYNOTE-181試験>(2次治療:単剤)
承認時評価資料: 国際共同第Ⅲ相試験(KEYNOTE-181試験)
Kojima T et al. J Clin Oncol 2020; 38: 4138-4148
本試験はMSD社の資金提供により行われた。Takashi KojimaはMSD社から顧問料などを受領している。その他の著者に同社から顧問料などを受領している者が含まれる。著者のうち、Ruixue Wang、Shailaja Suryawanshi、Pooja Bhagia、S. Peter KangはMSD社の社員である。
試験概要
【目的】切除不能進行・再発食道扁平上皮癌(ESCC*1)及び食道腺癌(EAC*2;Siewert分類type Ⅰ食道胃接合部腺癌含む)患者におけるキイトルーダ®と化学療法の有効性及び安全性を比較検討する。
【デザイン】国際共同無作為化非盲検第Ⅲ相試験 [優越性検証試験]
【対象】1次治療として全身治療歴のある切除不能進行・再発ESCC及びEAC(Siewert分類type Ⅰ食道胃接合部腺癌含む)患者628例(日本人患者152例を含む)
【方法】 キイトルーダ®群(200mgを3週間間隔(Q3W)で点滴静注)又は化学療法群(治験担当医師が以下の治療法のいずれかを選択:パクリタキセル;80〜100mg/m2を1週間間隔で3回点滴静注、1週間休薬、ドセタキセル;75mg/m2を3週間間隔で点滴静注、イリノテカン※;180mg/m2を2週間間隔で点滴静注)に1:1の割合で無作為に割り付けた。ベースライン時と無作為割り付け後は9週間毎に患者の疾患状態を画像診断により評価した。疾患進行又は許容できない毒性発現等まで、最長約2年間投与を継続した(キイトルーダ®投与は最大35サイクル)。

【評価項目】主要評価項目※1:PD-L1*4発現陽性(CPS*5≧10)患者、ESCC患者、ITT*6集団における全生存期間(overall survival;OS)
副次評価項目:CPS≧10患者、ESCC患者、ITT集団における無増悪生存期間(progression free survival;PFS)※2及び奏効率(objective response rate;ORR)※2、安全性
※1 検証的解析項目 ※2 ITT集団は検証的解析項目
【判定基準】PFS及びORRはBICR*7がRECISTガイドライン1.1版に基づき評価した。
【解析計画】解析対象集団:有効性はITT集団、安全性はASaT集団*8を解析対象とした。
有効性評価の統計手法:OS及びPFSはKaplan-Meier法を用いて推定した。CPS≧10患者とESCC患者においては、層別ログランク検定を用いて群間で比較した。ハザード比は、投与群を共変量とし、層別Cox比例ハザードモデルにより評価した。ITT集団においては、層別maximum weighted log-rank test(主要解析)を用いて群間で比較した。OSのサブグループ解析を、年齢(65歳未満又は65歳以上)、性別(女性又は男性)、地域(アジア又はアジア以外)、ECOG PS(0又は1)及び組織型(ESCC又はEAC)に基づいて実施した。ITT集団においては、サブグループ解析としてPD-L1発現(CPS≧10又は<10)に基づく解析も実施した。また、ESCC集団及びEAC集団におけるPD-L1発現(CPS≧10又は<10)に基づく解析は、治験実施計画書には記載されていないが、ITT集団と同様の統計手法にて解析し、評価資料として承認時に評価された。日本人集団におけるOS、PFS、ORRをITT集団と同様の統計手法にて検討した。
多重性の調整:本試験では3つの主要仮説(CPS≧10患者、ESCC患者及びITT集団のOS)について、1回の有効性の中間解析を計画し、主要仮説と2つの副次仮説(ITT集団のPFS及びORR)の多重性については、Maurer & Bretzのグラフィカルアプローチを用いて試験全体の有意水準を片側2.5%に厳密に制御した。OSは中間解析及び最終解析の2回の解析を実施することとした。なお、中間解析に関する多重性はLan-DeMetsによるO’Brien-Fleming型のalpha消費関数を用いて調整した。3つの主要仮説を最初に検定し、ITT集団におけるOSの優越性が示された場合のみに2つの副次仮説を検定することとした。
※イリノテカンは、食道癌に対して国内適応外
*1 ESCC(esophageal squamous cell carcinoma):食道扁平上皮癌
*2 EAC(esophageal adenocarcinoma):食道腺癌
*3 Siewert分類type Ⅰ食道胃接合部腺癌含む
*4 PD-L1発現の評価は、IHC法(PD-L1 IHC 22C3 pharmDx「ダコ」)を用いて、治験薬投与前に採取された腫瘍組織検体中の腫瘍細胞及び炎症細胞を解析した
*5 CPS(combined positive score):PD-L1陽性細胞数(腫瘍細胞、リンパ球及びマクロファージ)を総腫瘍細胞数で除し、100を乗じた数値
*6 ITT(intention-to-treat)集団:無作為化したすべての患者
*7 BICR(blinded independent central review):盲検下独立判定委員会
*8 ASaT(all subjects as treated)集団:治験薬を1回以上投与されたすべての患者
がん化学療法後に増悪した根治切除不能な進行・再発の食道扁平上皮癌へのキイトルーダ®の投与に際しては、コンパニオン診断薬であるPD-L1 IHC 22C3 pharmDx「ダコ」を用いて検査を行ってください。
4. 効能又は効果(抜粋)
根治切除不能な進行・再発の食道癌
5. 効能又は効果に関連する注意(抜粋)
<根治切除不能な進行・再発の食道癌>
5.16 がん化学療法後に増悪したPD-L1陽性の根治切除不能な進行・再発の食道扁平上皮癌に対して、本剤を単独で投与する場合には、PD-L1発現率(CPS)について、「17.臨床成績」の項の内容を熟知し、十分な経験を有する病理医又は検査施設における検査により、PD-L1の発現が確認された患者に投与すること。検査にあたっては、承認された体外診断用医薬品又は医療機器を用いること。なお、承認された体外診断用医薬品又は医療機器に関する情報については、以下のウェブサイトから入手可能である:
https://www.pmda.go.jp/review-services/drug-reviews/review-information/cd/0001.html
[17.1.24参照]
5.17 本剤の手術の補助療法における有効性及び安全性は確立していない。
6. 用法及び用量(抜粋)
<根治切除不能な進行・再発の食道癌>
フルオロウラシル及びシスプラチンとの併用において、通常、成人には、ペムブロリズマブ(遺伝子組換え)として、1回200mgを3週間間隔又は1回400mgを6週間間隔で30分間かけて点滴静注する。がん化学療法後に増悪したPD-L1陽性の根治切除不能な進行・再発の食道扁平上皮癌に対しては、本剤を単独投与することもできる。
パクリタキセルの用法及び用量は以下のとおりです。
用法及び用量(抜粋)
再発又は遠隔転移を有する頭頸部癌、再発又は遠隔転移を有する食道癌、血管肉腫にはB法を使用する。
B法:通常、成人にはパクリタキセルとして、1日1回100mg/m2(体表面積)を1時間かけて点滴静注し、週1回投与を6週連続し、少なくとも2週間休薬する。これを1クールとして、投与を繰り返す。
ドセタキセルの用法及び用量は以下のとおりです。
用法及び用量(抜粋)食道癌、子宮体癌
通常、成人に1日1回、ドセタキセルとして70mg/m2(体表面積)を1時間以上かけて3〜4週間間隔で点滴静注する。なお、患者の状態により適宜減量すること。
イリノテカンの効能又は効果は以下のとおりです。
効能又は効果
小細胞肺癌、非小細胞肺癌、子宮頸癌、卵巣癌、胃癌(手術不能又は再発)、結腸・直腸癌(手術不能又は再発)、乳癌(手術不能又は再発)、有棘細胞癌、悪性リンパ腫(非ホジキンリンパ腫)、小児悪性固形腫瘍、治癒切除不能な膵癌
患者背景(ITT集団)
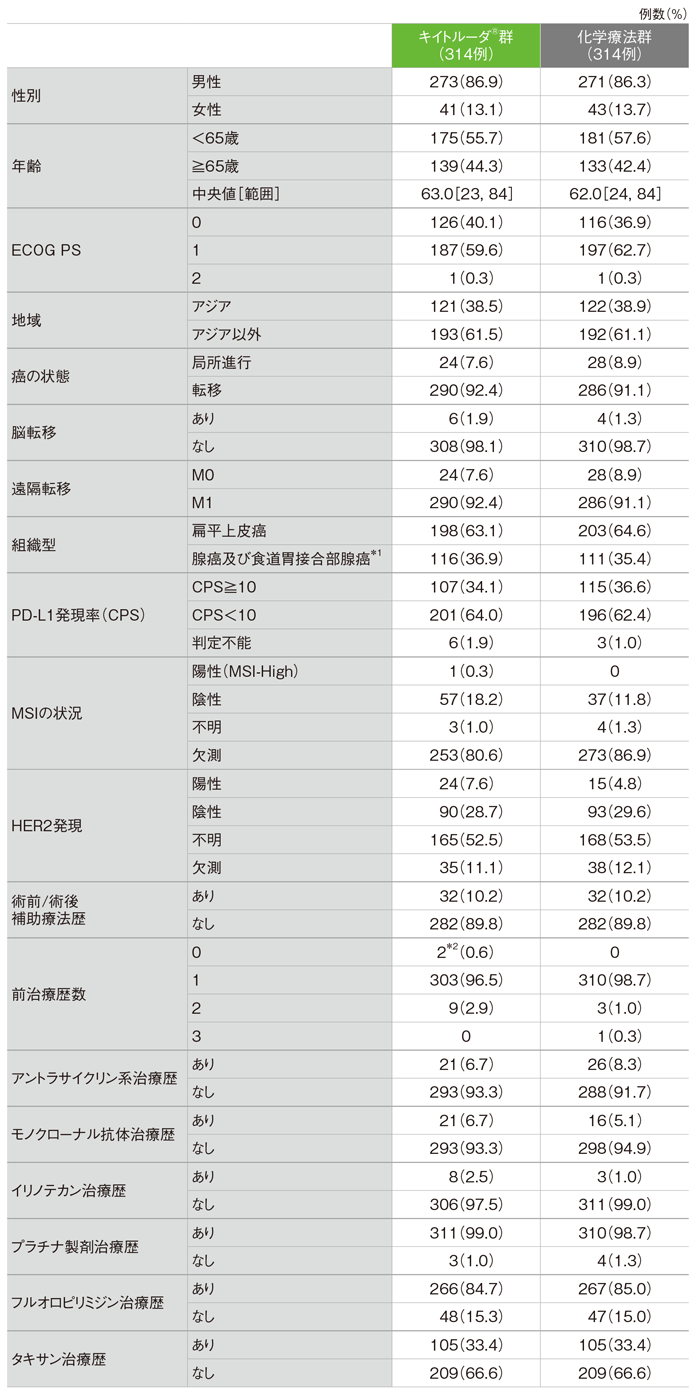
*1 Siewert分類type Ⅰ
*2 術前補助化学療法による全身治療の前治療歴あり
本試験では、最終解析後に2例の死亡情報が正しく反映されていないことが判明し、OS解析のみ再解析を実施しました。なお、最終解析と再解析(最終解析を補正したデータ)のカットオフ日は共に2018年10月15日でした。
主要評価項目(検証的解析結果) 全生存期間:OS
最終解析及び再解析(最終解析を補正したデータ)のOS
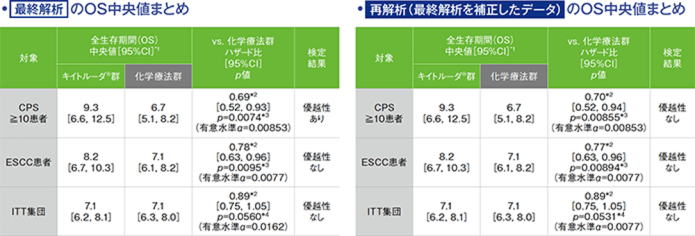
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、層別Cox比例ハザードモデルに基づいてハザード比を推定した。
*3 層別ログランク検定[片側]
*4 層別maximum weighted log-rank test[片側]
※ 層別Cox比例ハザードモデル、層別ログランク検定及び層別maximum weighted log-rank testに用いられた各集団の層別因子は次の通りであった。[CPS≧10患者及びITT集団:地域(アジア、アジア以外)、組織型(扁平上皮癌、腺癌又は食道胃接合部腺癌)][ESCC患者:地域(アジア、アジア以外)]
●PD-L1発現陽性(CPS≧10)患者における全生存期間(OS)
最終解析では、CPS≧10患者においてOS中央値はキイトルーダ®群で9.3ヵ月(95%CI:6.6, 12.5)、化学療法群で6.7ヵ月(95%CI:5.1, 8.2)、ハザード比は0.69(95%CI:0.52, 0.93、p=0.0074、層別ログランク検定[片側]*3、有意水準α=0.00853)で、OSを有意に延長しました(検証的解析結果)。
一方、再解析(最終解析を補正したデータ)では、CPS≧10患者においてOS中央値はキイトルーダ®群で9.3ヵ月(95%CI:6.6, 12.5)、化学療法群で6.7ヵ月(95%CI:5.1, 8.2)、ハザード比は0.70(95%CI:0.52, 0.94、p=0.00855、層別ログランク検定[片側]*3、有意水準α=0.00853)で、優越性は検証されませんでした(検証的解析結果)。
CPS≧10患者の全生存期間(OS)のKaplan-Meier曲線(ITT集団)<再解析(最終解析を補正したデータ)>
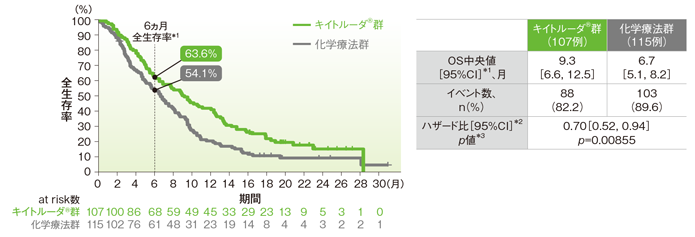
*1 打ち切りデータは product-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、層別Cox比例ハザードモデルに基づいてハザード比を推定した。
*3 層別ログランク検定[片側]、有意水準α=0.00853
※ 層別Cox比例ハザードモデル及び層別ログランク検定に用いられた層別因子は次の通りであった。[地域(アジア、アジア以外)、組織型(扁平上皮癌、腺癌又は食道胃接合部腺癌)]
●食道扁平上皮癌(ESCC)患者における全生存期間(OS)
最終解析では、ESCC患者においてOS中央値はキイトルーダ®群で8.2ヵ月(95%CI:6.7, 10.3)、化学療法群で7.1ヵ月(95%CI:6.1, 8.2)、ハザード比は0.78(95%CI:0.63, 0.96、p=0.0095、層別ログランク検定[片側]*3、有意水準α=0.0077)で、優越性は検証されませんでした(検証的解析結果)。
また、再解析(最終解析を補正したデータ)では、ESCC患者においてOS中央値はキイトルーダ®群で8.2ヵ月(95%CI:6.7, 10.3)、化学療法群で7.1ヵ月(95%CI:6.1, 8.2)、ハザード比は0.77(95%CI:0.63, 0.96、p=0.00894、層別ログランク検定[片側]*3、有意水準α=0.0077)で、優越性は検証されませんでした(検証的解析結果)。
食道扁平上皮癌(ESCC)患者の全生存期間(OS)のKaplan-Meier曲線(ITT集団)<再解析(最終解析を補正したデータ)>
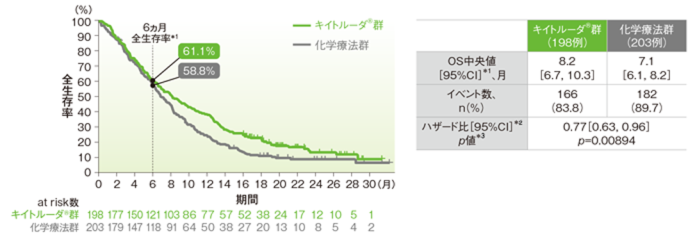
*1 打ち切りデータは product-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、層別Cox比例ハザードモデルに基づいてハザード比を推定した。
*3 層別ログランク検定[片側]、有意水準α=0.0077
※ 層別Cox比例ハザードモデル及び層別ログランク検定に用いられた層別因子は次の通りであった。[地域(アジア、アジア以外)]
●ITT集団における全生存期間(OS)
最終解析では、ITT集団においてOS中央値はキイトルーダ®群で7.1ヵ月(95%CI:6.2, 8.1)、化学療法群で7.1ヵ月(95%CI:6.3, 8.0)、ハザード比は0.89(95%CI:0.75, 1.05、p=0.0560、層別maximum weighted log-rank test[片側]*3、有意水準α=0.0162)で、優越性は検証されず、検定を終了しました(検証的解析結果)。
また、再解析(最終解析を補正したデータ)では、ITT集団においてOS中央値はキイトルーダ®群で7.1ヵ月(95%CI:6.2, 8.1)、化学療法群で7.1ヵ月(95%CI:6.3, 8.0)、ハザード比は0.89(95%CI:0.75, 1.05、p=0.0531、層別maximum weighted log-rank test[片側]*3、有意水準α=0.0077)で、優越性は検証されず、検定を終了しました(検証的解析結果)。
ITT集団の全生存期間(OS)のKaplan-Meier曲線<再解析(最終解析を補正したデータ)>
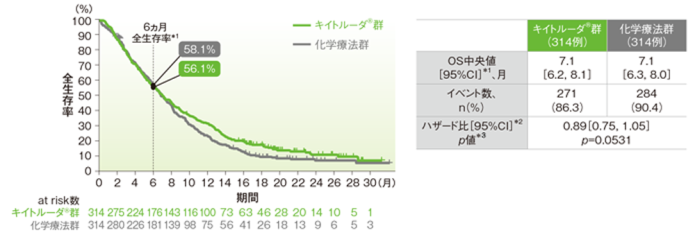
*1 打ち切りデータは product-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、層別Cox比例ハザードモデルに基づいてハザード比を推定した
*3 層別maximum weighted log-rank test[片側]、有意水準α=0.0077
※ 層別Cox比例ハザードモデル及び層別maximum weighted log-rank testに用いられた層別因子は次の通りであった。[地域(アジア、アジア以外)、組織型(扁平上皮癌、腺癌又は食道胃接合部腺癌)]
キイトルーダ®単剤療法は、本試験の最終解析、再解析(最終解析を補正したデータ)の結果を踏まえ、有効性成績が得られたがん化学療法後に増悪したPD-L1陽性の根治切除不能な進行・再発の食道扁平上皮癌に対して承認されました。
食道扁平上皮癌(ESCC)患者におけるPD-L1発現別の全生存期間:OS(サブグループ解析)<再解析(最終解析を補正したデータ)>
ESCC集団におけるPD-L1発現(CPS≧10又は<10)に基づく解析は、治験実施計画書には記載されていないが、評価資料として承認時に評価されたため記載した。
●ESCCかつCPS≧10患者においてOS中央値はキイトルーダ®群で10.3ヵ⽉(95%CI︓7.0, 13.5)、化学療法群で6.7ヵ⽉(95%CI︓4.8, 8.6)、ハザード⽐は0.64(95%CI︓0.46, 0.9 探索的解析結果)でした。
⾷道扁平上⽪癌(ESCC)かつCPS≧10患者の全⽣存期間(OS)のKaplan-Meier曲線(ITT集団)
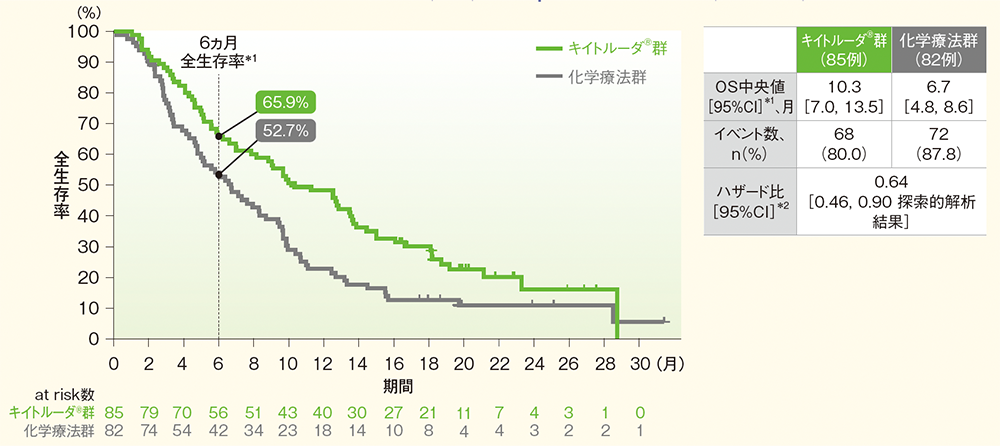
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、層別Cox比例ハザードモデルに基づいてハザード比を推定した
※ 層別Cox比例ハザードモデルに用いられた層別因子は次の通りであった。[地域(アジア、アジア以外)]
●ESCCかつCPS<10患者においてOS中央値はキイトルーダ®群で7.3ヵ⽉(95%CI︓5.7, 9.2)、化学療法群で7.5ヵ⽉(95%CI︓6.3, 8.3)、ハザード⽐は0.88でした。
⾷道扁平上⽪癌(ESCC)かつCPS<10患者の全⽣存期間(OS)のKaplan-Meier曲線(ITT集団)
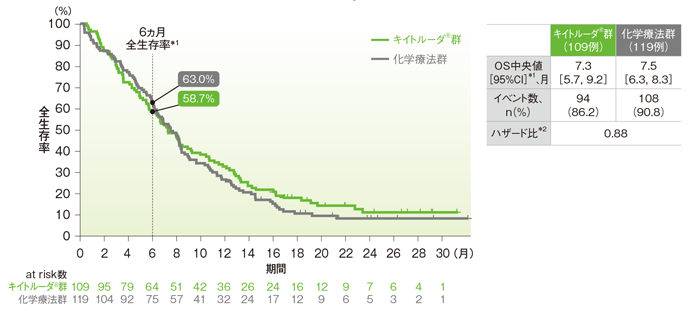
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、層別Cox比例ハザードモデルに基づいてハザード比を推定した
※ 層別Cox比例ハザードモデルに用いられた層別因子は次の通りであった。[地域(アジア、アジア以外)]
副次評価項目 無増悪生存期間:PFS
ESCCかつCPS≧10集団におけるPFSの解析は、治験実施計画書には記載されていないが、評価資料として承認時に評価されたため記載した。
ESCCかつCPS≧10患者においてPFS中央値はキイトルーダ®群で3.2ヵ月(95%CI:2.1, 4.4)、化学療法群で2.3ヵ月(95%CI:2.1, 3.4)でした。
食道扁平上皮癌(ESCC)かつCPS≧10患者の無増悪生存期間(PFS)のKaplan-Meier曲線(ITT集団)(サブグループ解析)
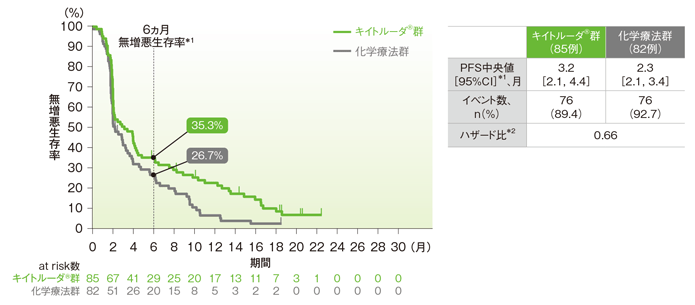
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、層別Cox比例ハザードモデルに基づいてハザード比を推定した
※ 層別Cox比例ハザードモデルに用いられた層別因子は次の通りであった。[地域(アジア、アジア以外)]
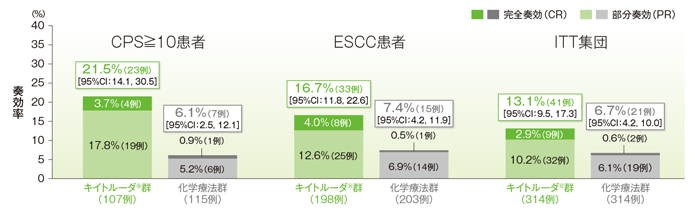
副次評価項目 奏効率:ORR
ORRはCPS≧10患者ではキイトルーダ®群21.5%(95%CI:14.1,30.5)、化学療法群6.1%(95%CI:2.5,12.1)、ESCC患者ではキイトルーダ®群16.7%(95%CI:11.8,22.6)、化学療法群7.4%(95%CI:4.2,11.9)、ITT集団ではキイトルーダ®群13.1%(95%CI:9.5,17.3)、化学療法群6.7%(95%CI:4.2,10.0)でした。
なお、多重性を考慮した解析方針に従って、ITT集団のOSにおいてキイトルーダ®群の優越性が示されなかったため、ORRでは有意差検定を実施しませんでした。
奏効率(ORR: CR+PR)(ITT集団)
RECISTガイドライン 1.1版に基づくBICRによる評価
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 「+」は最後の疾患評価までにPDがみられないことを示す
(ITT集団の追跡期間中央値:キイトルーダ®群 7.1ヵ月、化学療法群 6.9ヵ月)
安全性
●ASaT集団
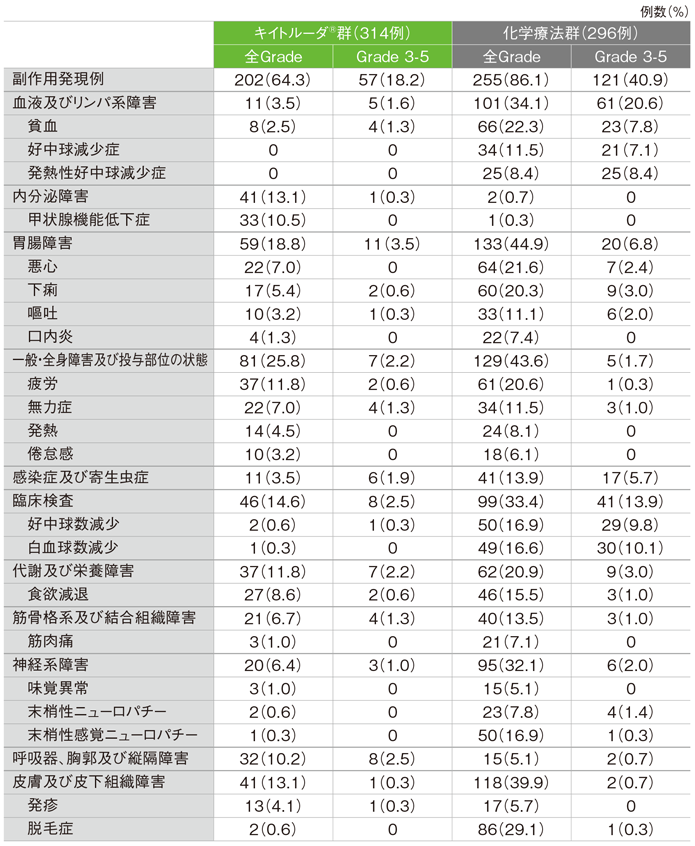
キイトルーダ®群の副作用は202/314例(64.3%)に認められました。主な副作用(発現率10%以上)は疲労37例(11.8%)、甲状腺機能低下症33例(10.5%)でした。重篤な副作用は40例(12.7%)に認められ、2例以上にみられた重篤な副作用は肺臓炎7例(2.2%)、自己免疫性肝炎、大腸炎、肺炎 各3例(1.0%)、急性腎障害、発熱 各2例(0.6%)でした。副作用によるキイトルーダ®の投与中止は19例(6.1%)に認められ、2例以上にみられた投与中止に至った副作用は自己免疫性肝炎5例(1.6%)、肺臓炎3例(1.0%)でした。副作用による死亡は5例(1.6%)に認められ、その内訳は肺臓炎2例(0.6%)、心筋炎、死亡、食道出血 各1例(0.3%)でした。
化学療法群の副作用は255/296例(86.1%)に認められました。主な副作用(発現率10%以上)は脱毛症86例(29.1%)、貧血66例(22.3%)、悪心64例(21.6%)、疲労61例(20.6%)、下痢60例(20.3%)、好中球数減少、末梢性感覚ニューロパチー 各50例(16.9%)、白血球数減少49例(16.6%)、食欲減退46例(15.5%)、無力症、好中球減少症 各34例(11.5%)、嘔吐33例(11.1%)でした。重篤な副作用は57例(19.3%)に認められ、2例以上にみられた重篤な副作用は発熱性好中球減少症21例(7.1%)、肺炎8例(2.7%)、発熱、下痢、嘔吐 各4例(1.4%)、貧血、悪心、好中球減少症、好中球数減少 各3例(1.0%)、感染症、細菌性肺炎、敗血症、白血球数減少 各2例(0.7%)でした。副作用による化学療法の投与中止は19例(6.4%)に認められ、2例以上にみられた投与中止に至った副作用は末梢性ニューロパチー3例(1.0%)、倦怠感、肺炎 各2例(0.7%)でした。副作用による死亡は5例(1.7%)に認められ、その内訳は敗血症、肺炎、出血性ショック、誤嚥性肺炎、好中球数減少、白血球数減少 各1例(0.3%)でした。
主な副作用(いずれかの投与群で発現率5%以上)(ASaT集団)
MedDRA/J v21.0、GradeはNCI CTCAE v4.0
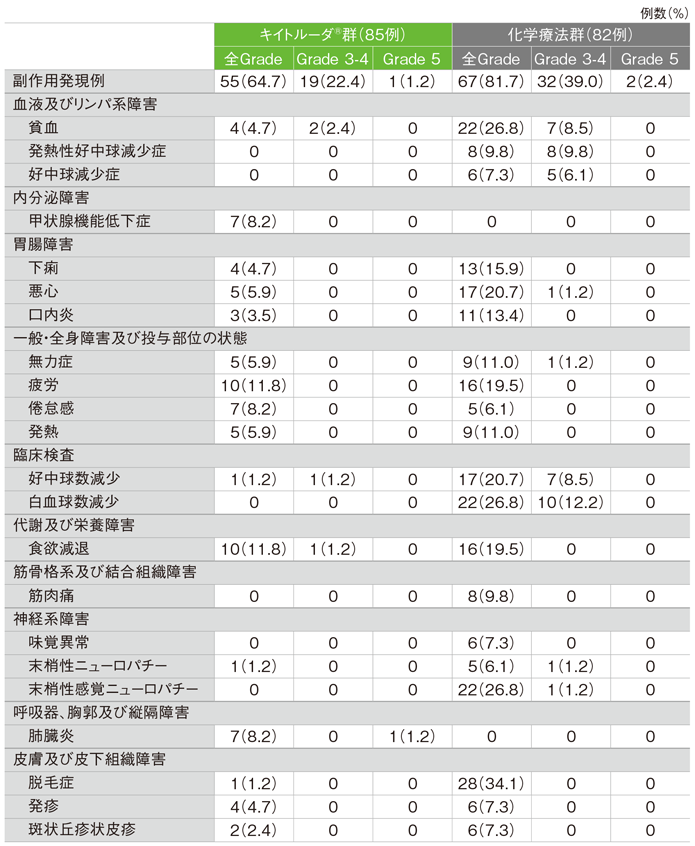
●食道扁平上皮癌(ESCC)かつCPS≧10患者集団
ESCCかつCPS≧10集団における安全性の解析は、治験実施計画書には記載されていないが、評価資料として承認時に評価されたため記載した。
ESCCかつCPS≧10患者のキイトルーダ®群における副作用は55/85例(64.7%)(日本人26/40例を含む)に認められました。主な副作用(発現率10%以上)は疲労、食欲減退 各10例(11.8%)でした。
主な副作用(いずれかの投与群で発現率5%以上)(ASaT集団)
MedDRA/J v21.0、GradeはNCI CTCAE v4.0
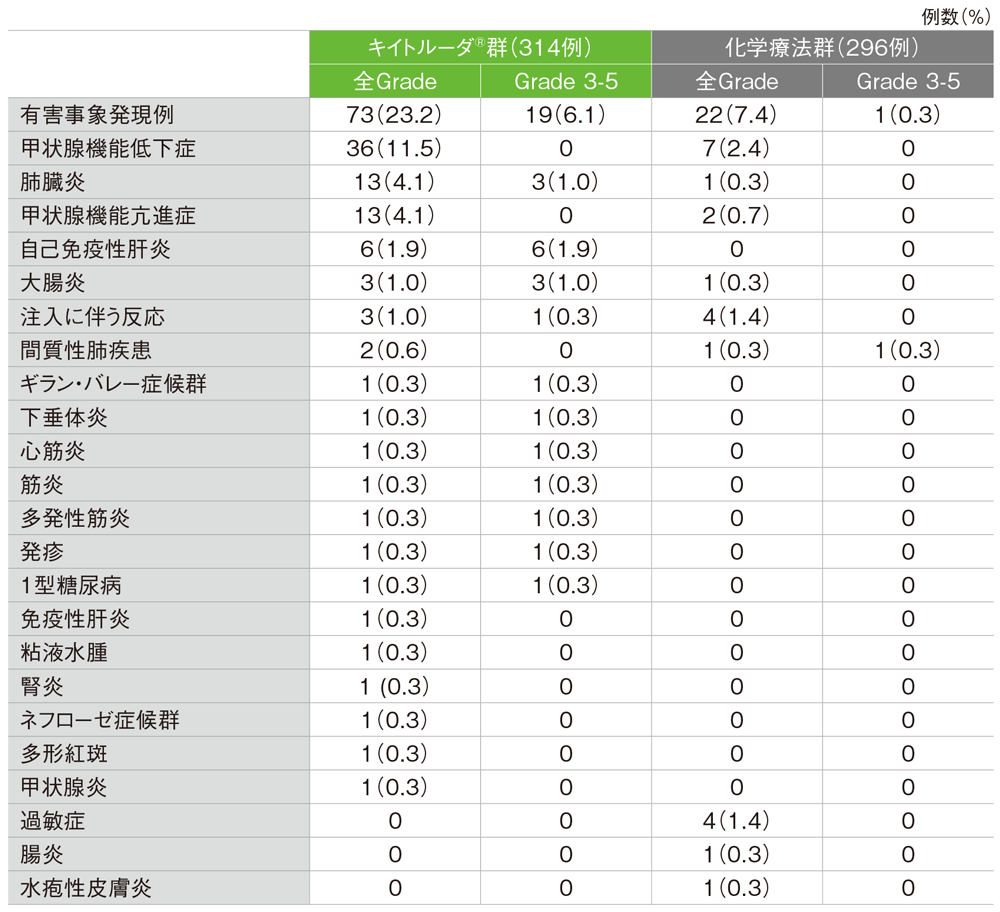
免疫関連など特に注目すべき有害事象
キイトルーダ®群の免疫関連など特に注目すべき有害事象は73/314例(23.2%)に認められました。2例以上にみられた免疫関連など特に注目すべき有害事象は甲状腺機能低下症36例(11.5%)、甲状腺機能亢進症、肺臓炎 各13例(4.1%)、自己免疫性肝炎6例(1.9%)、大腸炎、注入に伴う反応 各3例(1.0%)、間質性肺疾患2例(0.6%)でした。重篤な免疫関連など特に注目すべき有害事象は18例(5.7%)に認められ、2例以上にみられた重篤な免疫関連など特に注目すべき有害事象は肺臓炎7例(2.2%)、自己免疫性肝炎4例(1.3%)、大腸炎3例(1.0%)でした。免疫関連など特に注目すべき有害事象によるキイトルーダ®の投与中止は13例(4.1%)に認められ、その内訳は自己免疫性肝炎5例(1.6%)、肺臓炎3例(1.0%)、大腸炎、ギラン・バレー症候群、心筋炎、多発性筋炎、1型糖尿病 各1例(0.3%)でした。免疫関連など特に注目すべき有害事象による死亡は3例(1.0%)に認められ、その内訳は肺臓炎2例(0.6%)、心筋炎1例(0.3%)でした。
化学療法群の免疫関連など特に注目すべき有害事象は22/296例(7.4%)に認められました。2例以上にみられた免疫関連など特に注目すべき有害事象は甲状腺機能低下症7例(2.4%)、注入に伴う反応、過敏症 各4例(1.4%)、甲状腺機能亢進症2例(0.7%)でした。重篤な免疫関連など特に注目すべき有害事象は2例(0.7%)に認められ、その内訳は腸炎、間質性肺疾患 各1例(0.3%)でした。免疫関連など特に注目すべき有害事象による化学療法の投与中止は間質性肺疾患1例(0.3%)にみられました。本試験において免疫関連など特に注目すべき有害事象による死亡は、みられませんでした。
免疫関連など特に注目すべき有害事象(ASaT集団)
MedDRA/J v21.0、GradeはNCI CTCAE v4.0
関連コンテンツ
キイトルーダ®・悪性腫瘍関連領域情報
関連製品
