HbA1c低下効果(長期併用投与試験)
長期併用投与試験(国内第Ⅲ相臨床試験)
ベースライン(治療期0週時)から52週時までのHbA1c変化量(副次評価項目)
治療期52週時のHbA1c(7.0%未満)達成割合(三次評価項目)
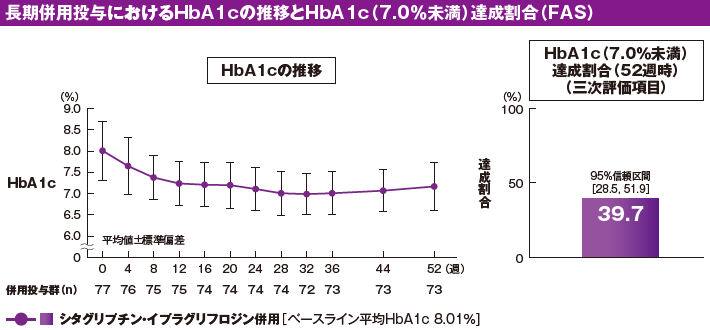
イプラグリフロジン追加投与による治療期52週時のベースラインからのHbA1c平均変化量[95%信頼区間]は−0.80%[−0.96, −0.65]でした(副次評価項目)。HbA1cの推移は以下のとおりでした。治療期52週時のHbA1c(7.0%未満)達成割合[95%信頼区間]は、39.7%[28.5, 51.9](29/73例)でした(三次評価項目)。
MSD株式会社:国内第Ⅲ相臨床試験 P849(承認申請時評価資料)
安全性(主要評価項目)[52週時]:副作用発現率は、24.7%(19/77例)であった。個々の副作用は、頻尿14.3%(11/77例)、口渇7.8%(6/77例)および便秘5.2%(4/77例)、膀胱炎、陰部ヘルペス、尿路感染、体重減少、筋骨格硬直、夜間頻尿および薬疹はいずれも1.3%(1/77例)に認められた。重篤な副作用および死亡は認められなかった。投与中止に至った副作用発現率は3.9%(3/77例)で、頻尿、夜間頻尿、薬疹がいずれも1.3%(1/77例)に認められた。
試験概要
目 的 :食事・運動療法に加えシタグリプチン50mg単剤治療で血糖コントロールが不十分な日本人2型糖尿病患者に、イプラグリフロジン50mgを1日1回52週間追加投与したときの安全性、忍容性および有効性を検討する。
対 象 :20歳以上で、食事・運動療法に加えシタグリプチン50mg1日1回単剤治療で血糖コントロールが不十分な日本人2型糖尿病患者(HbA1cが7.0%以上10.0%以下)77例
方 法 :スクリーニング期および観察期に非盲検下にてシタグリプチン50mgを1日1回朝(食前食後は問わない)、最大12週間経口投与した後、イプラグリフロジン50mgを追加でシタグリプチンと同時に1日1回朝(食前食後は問わない)、52週間経口投与した。
評価項目:
<安全性(主要評価項目)>
有害事象(低血糖を含む)、バイタルサイン(体重、血圧、脈拍)、臨床検査、心電図
<有効性(副次評価項目)>
ベースライン(治療期0週時)から52週時までのHbA1c変化量
<有効性(三次評価項目)>
(1) ベースライン(治療期0週時)から52週時までの空腹時血糖値変化量
(2) ベースライン(治療期0週時)から52週時までの体重変化量
(3) 治療期52週時のHbA1c(7.0%未満)達成割合
解析計画:有効性解析は、治療期52週時までの各時点でHbA1cのベースラインからの変化量を記述統計量および95%信頼区間により要約した。HbA1c7.0%未満達成数および割合、並びにClopper-Pearsonの方法に基づく割合の95%信頼区間を時点ごとに示した。欠測値は補完しなかった。安全性解析対象集団はASaT、有効性解析対象集団はFASとした。
ASaT(All Subjects as treated):治療期用治験薬を1回以上投与されたすべての被験者
FAS(Full Analysis Set):有効性評価に関する最大の解析対象集団
8. 重要な基本的注意(抜粋)
8.2 本剤投与中は、血糖値等を定期的に検査するとともに、経過を十分に観察し、常に投与継続の必要性について注意を払うこと。本剤を3ヵ月投与しても効果が不十分な場合、より適切と考えられる治療への変更を考慮すること。
「禁忌」含む注意事項等の情報はこちらをご参照ください。