海外第Ⅲ相試験<POLO試験>

*BRCA遺伝子変異陽性の治癒切除不能な膵癌における白金系抗悪性腫瘍剤を含む化学療法後の維持療法
膵癌:臨床成績:海外第Ⅲ相試験<POLO試験>
MSD Connect「リムパーザ®製品ページ」の一部は、本製品の製造販売元であるアストラゼネカ株式会社の医療関係者向け情報サイト「MediChannel」に遷移し、同サイト掲載資料のダウンロードで表示されます。ご了承のほどお願い申し上げます。
膵癌コンテンツ: 製品特徴 臨床成績 BRCA検査 作用機序 On Demand Lecture
承認時評価資料・社内資料(生殖細胞系列のBRCA遺伝子変異を有する転移性膵癌患者を対象としたオラパリブの海外第Ⅲ相試験, 2019)
Golan T, et al. N Engl J Med. 2019; 381: 317-27.
[利益相反:本試験はAstraZeneca社の支援により行われた。著者には、AstraZeneca社、MSD社より研究費、コンサルタント料等を受領している者が含まれる。]
試験概要
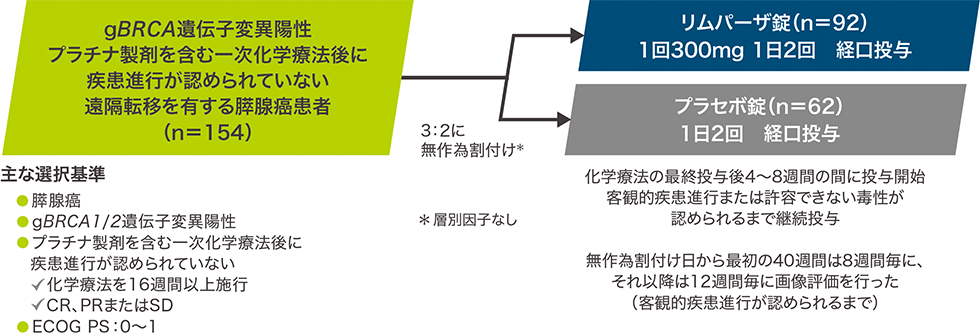
【目 的】gBRCA遺伝子変異陽性の遠隔転移を有する膵腺癌患者における単剤維持療法としてのリムパーザの有効性をプラセボと比較検討する。
【デザイン】無作為化二重盲検プラセボ対照多施設共同第Ⅲ相試験(優越性検証試験)
【対 象】gBRCA1/2遺伝子変異陽性で、プラチナ製剤を含む一次化学療法※1後に疾患進行が認められていない(CR、PRまたはSD)、遠隔転移を有する膵腺癌患者154例
※1:16週間以上施行
【方 法】プラチナ製剤を含む化学療法の最終投与後4~8週間の間にリムパーザまたはプラセボの投与を開始した。
リムパーザ錠(1回300mg)またはプラセボ錠を1日2回経口投与し、客観的疾患進行または許容できない毒性が認められるまで投与を継続した。
画像評価は、無作為割付け日から最初の40週間は8週間(±1週間)毎に、それ以降は客観的疾患進行が認められるまで12週間(±1週間)毎に行った。
【主要評価項目】無増悪生存期間(PFS)[改変RECISTガイドライン第1.1版(mRECIST v1.1)※2に基づく盲検下での独立中央評価]
※2:ベースライン時に無病状態(NED)であった患者を、新たな病変による疾患進行の評価が可能となるようRECIST v1.1を改変した
【副次評価項目】全生存期間(OS)、最初の後治療開始または死亡までの期間(TFST)、二次試験または死亡までの期間(PFS2)、2番目の後治療開始または死亡までの期間(TSST)、投与中止または死亡までの期間(TDT)、客観的奏効率(ORR:ベースライン時に測定可能病変が認められた患者を評価対象とし、最良総合効果がCRまたはPRであった患者の割合)[mRECIST v1.1に基づく盲検下での独立中央評価]、奏効期間(DOR)、病勢コントロール率(DCR)、EORTC QLQ-C30質問票から得た全般的HRQoLスコアのベースラインからの調整済み平均変化量など
【安全性評価項目】有害事象、身体所見、バイタルサイン、心電図検査、臨床検査
【解析計画】無作為割付けされた154例(リムパーザ群92例、プラセボ群62例)を最大解析対象集団とし、治験薬が1回以上投与された151例(リムパーザ群91例、プラセボ群60例)を安全性解析対象集団とした。
主要評価項目のPFSにおいて、プラセボ群に対するリムパーザ群の優越性を検証した。PFS、OS、TFST、PFS2、TSST、TDTは、Kaplan-Meier法を用いて生存関数を図示し、log-rank検定で群間比較を行った。
主要評価項目(PFS)と重要な副次評価項目(OS)に多重検定手順を用いた[まず全ての有意水準(両側5%)を用いてPFSを検定し、有意な結果が得られた場合にOSについて有意水準を再利用した]。他の評価項目については多重性の調整は行わず、有意水準両側5%にて検定し、名目上のp値を求めた。
あらかじめ規定されていた10項目[一次化学療法のレジメン(FOLFIRINOX、その他)、一次化学療法のタイプ(2剤併用、3剤併用)、一次化学療法の治療期間(6ヵ月以内、6ヵ月超)、一次化学療法の最良総合効果(CR/PR、SD)、胆管ステントの有無、測定可能病変の有無(あり、なし/NED)、Myriad検査におけるgBRCA遺伝子変異のタイプ(gBRCA1、gBRCA2)、無作為割付け時の年齢(65歳未満、65歳以上)、性別(男性、女性)、人種(白人)]についてPFSのサブグループ解析を実施した。
PFSの主要解析は、約87例のPFSイベントに達した時点で実施する計画とした(データカットオフ時のPFSイベント発現例数:104例)。
OSの中間解析はPFSの主要解析時点で実施し、最終解析は約106例のOSイベント(イベント発現割合:69%)に達した時点で実施予定である。
EORTC QLQ-C30の全般的HRQoLスコアのベースラインからの変化量は、反復測定混合モデル(MMRM)を用いて投与群別および来院別に解析した。
【治験期間】2014年12月16日~2019年1月15日(データカットオフ日)
患者背景(最大解析対象集団)
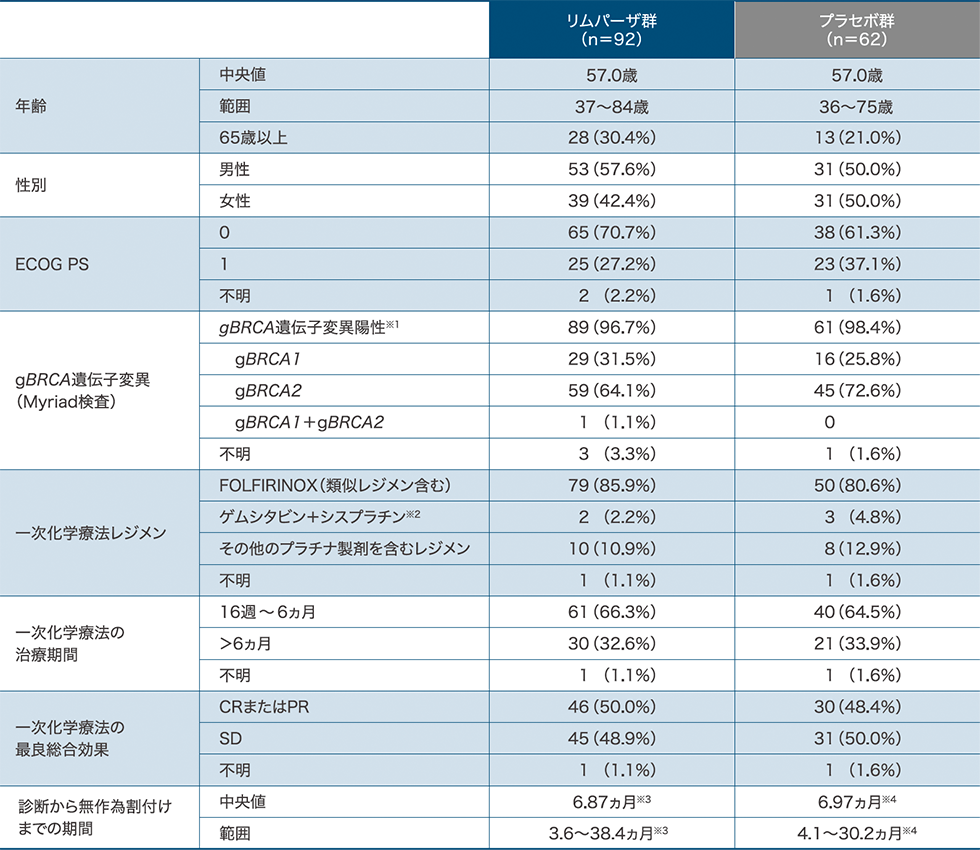
※1:Myriad BRACAnalysis®またはMyriad BRACAnalysis CDx®による検査で「病的変異」または「病的変異疑い」に該当 ※2:膵癌の適応は本邦未承認 ※3:n=91 ※4:n=61
4. 効能又は効果(一部抜粋)
BRCA遺伝子変異陽性の治癒切除不能な膵癌における白金系抗悪性腫瘍剤を含む化学療法後の維持療法
5. 効能又は効果に関連する注意(一部抜粋)
〈BRCA遺伝子変異陽性の治癒切除不能な膵癌における白金系抗悪性腫瘍剤を含む化学療法後の維持療法〉
5.14 本剤の手術の補助療法としての有効性及び安全性は確立していない。
5.15 白金系抗悪性腫瘍剤を含む化学療法で疾患進行が認められていない患者を対象とすること。
5.16 臨床試験に組み入れられた患者の病期、白金系抗悪性腫瘍剤を含む化学療法の投与期間等について、「17. 臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。
5.17 承認された体外診断用医薬品又は医療機器注)を用いた検査により、生殖細胞系列のBRCA遺伝子変異(病的変異又は病的変異疑い)を有することが確認された患者に投与すること。
注)承認された体外診断用医薬品又は医療機器に関する情報については、以下のウェブサイトから入手可能である:
https://www.pmda.go.jp/review-services/drug-reviews/review-information/cd/0001.html
無増悪生存期間(PFS):主要評価項目
最大解析対象集団において、リムパーザ群はプラセボ群に比べてPFSを有意に延長し(ハザード比[95%CI]:0.531[0.346~0.815]、p=0.0038、log-rank検定)、優越性が検証されました。
PFS中央値は、リムパーザ群が7.4ヵ月、プラセボ群が3.8ヵ月でした。
PFSのKaplan-Meier曲線(最大解析対象集団)
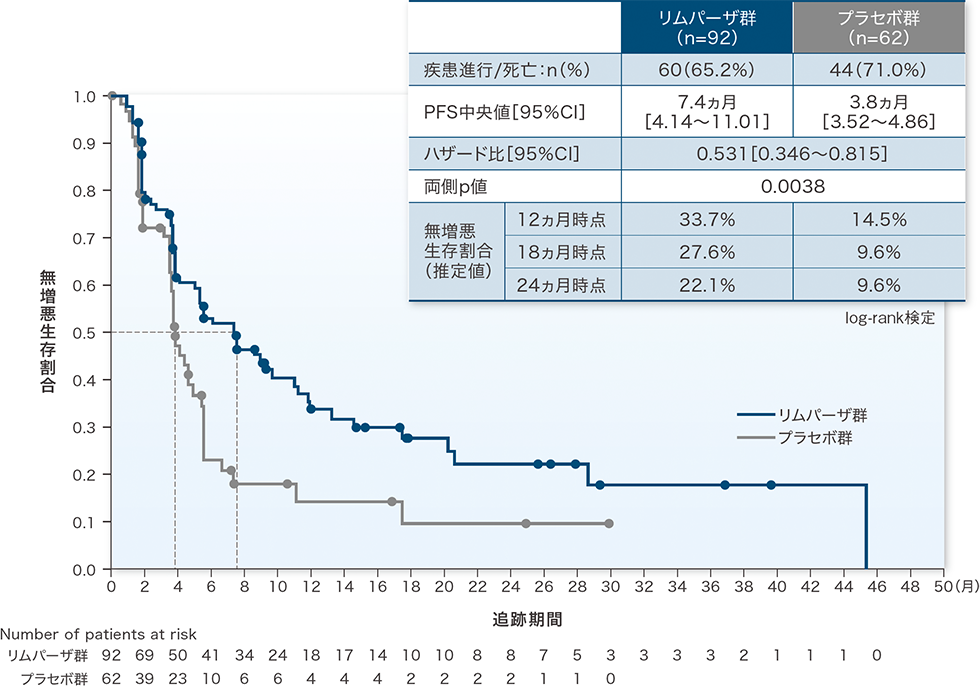
PFS:無作為割付け日から客観的疾患進行が最初に認められた日または死因を問わない死亡日(疾患進行がない場合)までの期間
mRECIST v1.1に基づく盲検下での独立中央評価
さまざまな患者集団におけるPFS:主要評価項目/サブグループ解析
PFSのサブグループ解析の結果、「年齢(無作為割付け時):65歳以上」を除く全てのサブグループにおいて、ハザード比の点推定値は1を下回っていた。
PFSのフォレストプロット
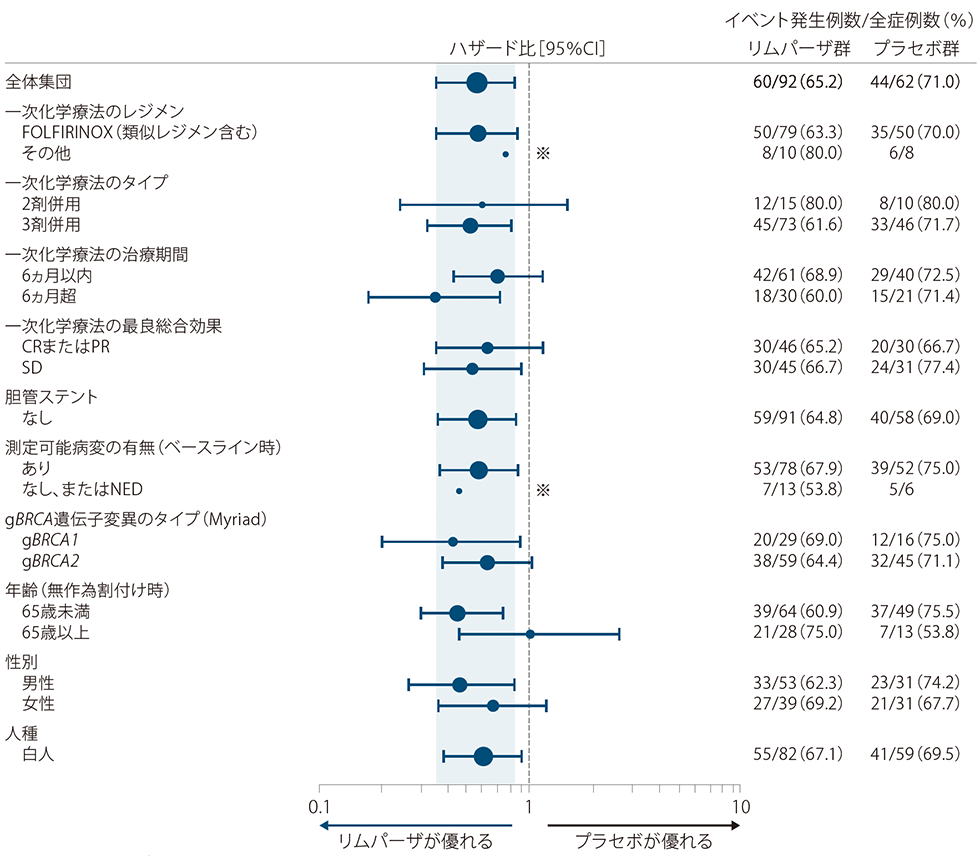
投与群、各サブグループ因子、投与群と各サブグループ因子の交互作用項を含めたCox比例ハザードモデル
※:プラセボ群の症例数が少数(10例未満)のため、ハザード比の95%CIは図示していない
mRECIST v1.1に基づく盲検下での独立中央評価
一次化学療法の最良総合効果(BoR)別のPFS:主要評価項目/サブグループ解析
一次化学療法のBoR別のPFSのハザード比[95%CI]は、CR/PR症例で0.62[0.35~1.12]、SD症例では0.50[0.29~0.87]でした。
PFS中央値は、リムパーザ群のCR/PR症例、SD症例はいずれも7.4ヵ月、プラセボ群のCR/PR症例は3.8ヵ月、SD症例は3.9ヵ月でした。
一次化学療法のBoR別のPFSのKaplan-Meier曲線(最大解析対象集団)
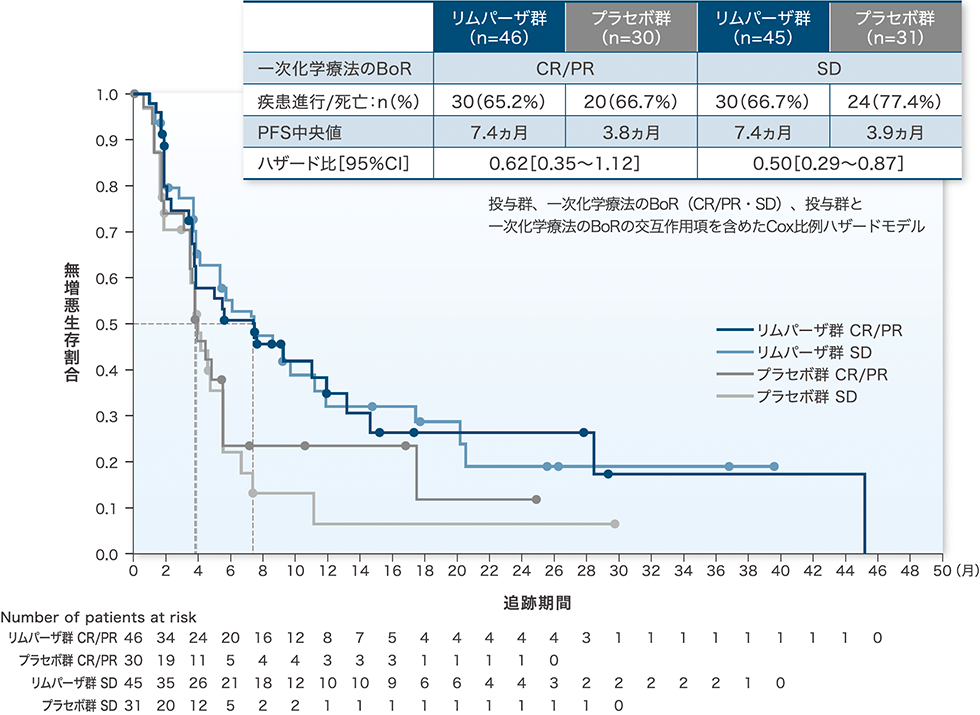
mRECIST v1.1に基づく盲検下での独立中央評価
後治療
データカットオフ時点で、リムパーザ群の48.9%(45/92例)、プラセボ群の74.2%(46/62例)が1回以上の後治療を受けていました。
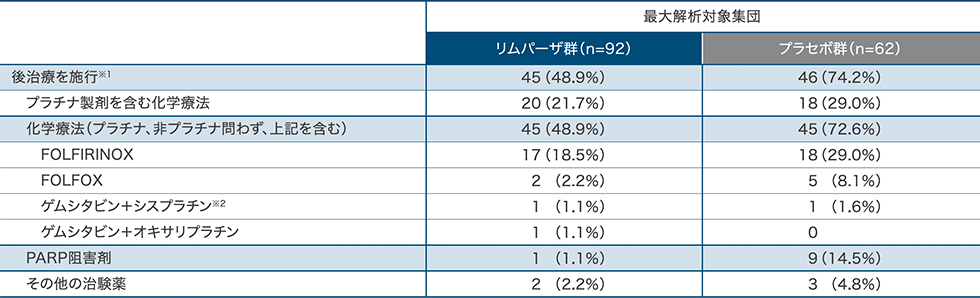
※1:後治療を複数回受けた患者を含む ※2:膵癌の適応は本邦未承認
全生存期間(OS)[中間解析]:副次評価項目
中間解析時点において、リムパーザ群とプラセボ群との間でOSに有意差は認められませんでした(ハザード⽐[95%CI]:0.906[0.563~1.457])。
本中間解析は、イベント発現割合:46%(71例のOSイベント)時点での解析であり、最終解析は約106例のOSイベント(イベント発現割合:69%)に達した時点で実施予定です。
OSのKaplan-Meier曲線(最大解析対象集団)
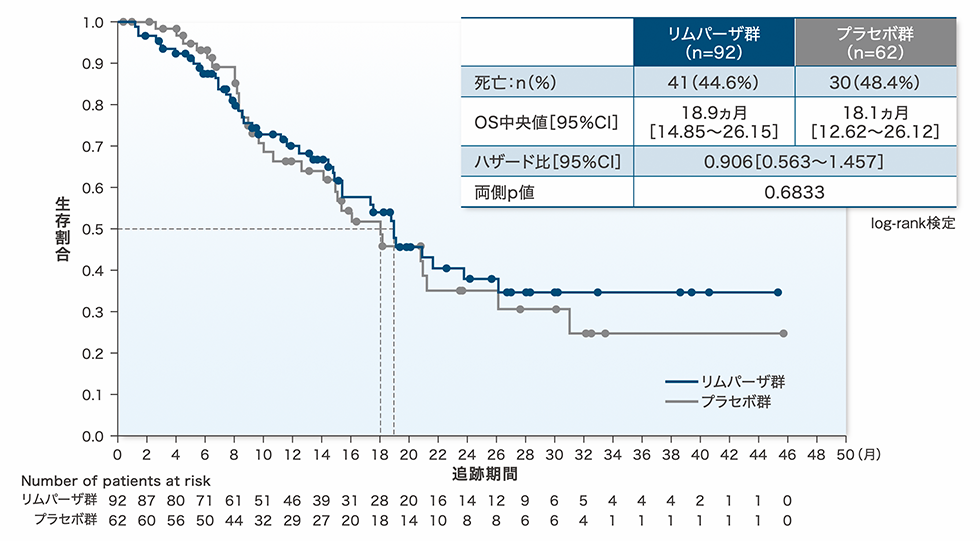
OS:無作為割付け日から死因を問わない死亡日までの期間
客観的奏効率(ORR)、奏効期間:副次評価項目
評価可能例(ベースライン時に測定可能病変が認められた患者)におけるORRは、リムパーザ群が23.1%(18/78例)、プラセボ群が11.5%(6/52例)でした。奏効例における奏効期間中央値[95%CI]は、リムパーザ群が24.9ヵ月[14.75~NC]、プラセボ群が3.7ヵ月[2.10~NC]でした。
NC:算出不能
ORR(評価可能例:ベースライン時に測定可能病変が認められた患者)、奏効期間
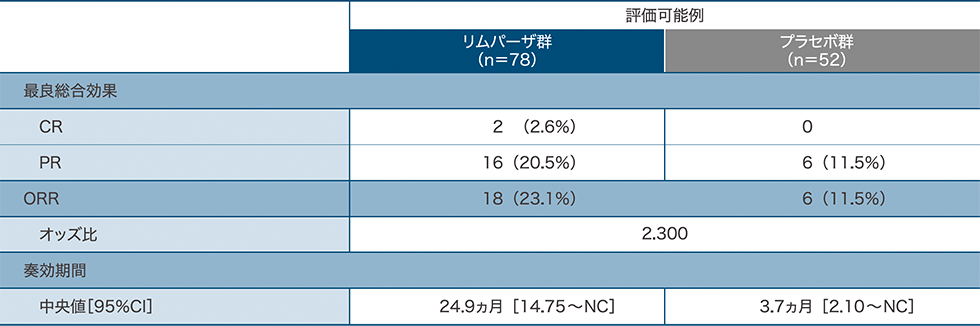
mRECIST v1.1に基づく盲検下での独立中央評価
有害事象(安全性解析対象集団)
有害事象は、リムパーザ群95.6%(87/91例)、プラセボ群93.3%(56/60例)に認められました。
主な有害事象(両群のいずれかで発現率20%以上)は、下表のとおりでした。
死亡に至った有害事象は、リムパーザ群、プラセボ群ともに認められませんでした。
重篤な有害事象は、リムパーザ群では22例(24.2%)、プラセボ群では9例(15.0%)に認められました。各群で2例以上に認められた重篤な有害事象は、リムパーザ群では貧血(6例、6.6%)、腹痛(3例、3.3%)、胆管炎(2例、2.2%)、プラセボ群では嘔吐(3例、5.0%)、発熱(2例、3.3%)でした。
投与中止に至った有害事象は、リムパーザ群では5例[5.5%(疲労2例、食欲減退、十二指腸穿孔、嘔吐、関節痛、筋肉痛、蛋白尿が各1例)]、プラセボ群では1例[1.7%(発熱1例)]に認められました。
主な有害事象
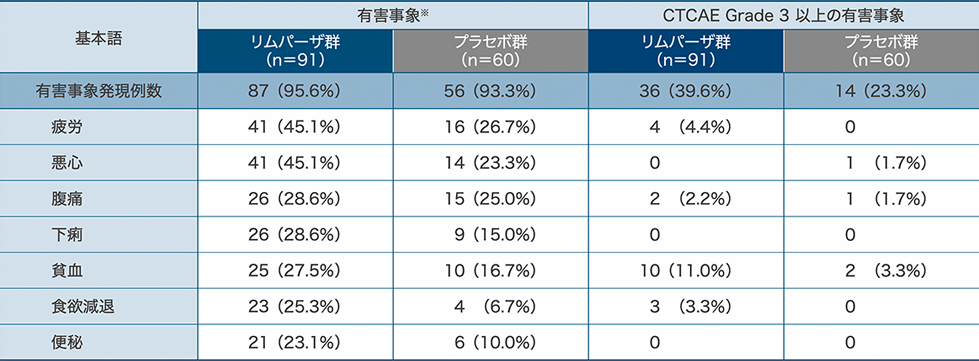
治験薬投与開始日から投与終了後30日以内に発現した有害事象を集計
※:両群のいずれかで発現率20%以上の有害事象
副作用発現時の処置
リムパーザ投与中は定期的に血液検査を行い、患者さんの状態を十分に観察してください。異常が認められた場合には、以下の基準を考慮して、休薬・減量または投与を中止するなどの適切な処置を行ってください。
骨髄抑制の発現時
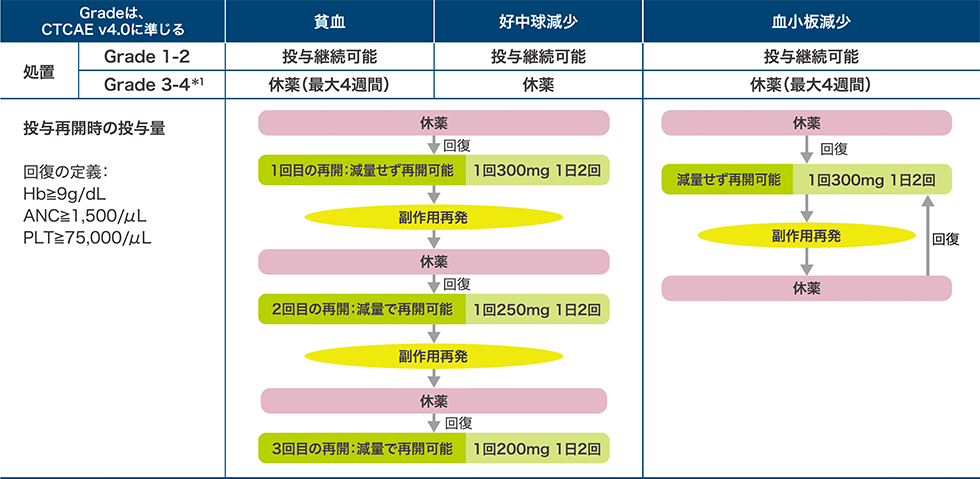
*1 Grade 3-4 貧血:Hb<8g/dL、Grade 3-4 好中球減少:ANC<1,000/μL、Grade 3-4 血小板減少:PLT<50,000/μL
骨髄抑制以外の副作用の発現時

*2 投与再開後に副作用が再発し、さらに休薬しても十分に管理できないと考えられる場合、減量または投与中止しなければならない。
添付文書の「副作用発現時の用量調節基準」より作図
添付文書の「副作用発現時の用量調節基準」は、SOLO2試験*3プロトコールの休薬期間や投与再開時の投与量を考慮し設定
*3 BRCA遺伝子変異を有する白金製剤感受性再発卵巣癌を対象としたオラパリブの国際共同第Ⅲ相試験
リムパーザの使用に際しては、適正使用のためのガイド、最新の添付文書および総合製品情報概要を熟読のうえ、適正な使用をお願いいたします。
なお、リムパーザの適正使用情報は、アストラゼネカ社の安全性情報サイト
(https://med.astrazeneca.co.jp/safety/LYN.html)にも掲載しています。
膵癌コンテンツ: 製品特徴 臨床成績 BRCA検査 作用機序 On Demand Lecture
リムパーザ®のほかのカテゴリ
関連コンテンツ
リムパーザ®・悪性腫瘍関連領域情報
関連製品
