PD-L1検査における精度管理のポイント
PD-L1検査における精度管理のポイント
PD-L1発現評価の一般的留意点1)
PD-L1発現の判定には、腫瘍組織の3枚の連続切片による評価が最も適切です(H&E染色、PD-L1染色、NCR染色)。最初の1枚にH&E染色を行い、適切な判定試料腫瘍組織検体かを見極めて、100個以上の腫瘍細胞があることを確認します。その上で、残りの2枚のPD-L1染色、NCR染色により判定を行います。
また、「ダコ Autostainer Link 48」による染色の実施回ごとにキット同梱のセルラインコントロールスライドをあわせて染色する必要があります。さらに施設内コントロール組織の染色による評価も必要です。
NCR:Negative Control Reagent(陰性コントロール試薬)
PD-L1染色の精度管理1)
キット同梱のセルラインコントロールスライドを観察し、試薬の性能に問題がないかを評価してください。キット同梱のセルラインコントロールスライドには、 PD-L1陽性対照および陰性対照のセルブロック切片が貼付されています。両方の細胞中の陽性細胞の割合、染色強度、および非特異的染色を評価します。コントロール検体の染色性が不十分だと判断された場合には、同ランで染色されたすべての組織検体結果を無効とみなします。キット同梱のセルラインコントロールスライドを、結果の解釈に使用しないでください。
PD-L1 IHC 22C3 pharmDx「ダコ」
セルラインコントロールスライド
●陽性コントロールの染色性
●陰性コントロールの染色性
施設内コントロール組織(トリプルネガティブ乳癌)スライド
●陽性コントロール標本の染色性
【染色強度】 0:陰性 1+:弱陽性 2+:中等度陽性 3+:強陽性
●陰性コントロール標本の染色性
陰性コントロール試薬(NCR)スライド
●陰性コントロール標本の染色性
検体の取り扱い
PD-L1検査および検体の取り扱いにおける留意点1)
適切なPD-L1検査を行うためには、技術的な差異が結果に影響するリスクをできる限り最小化し、精度を高めることが重要になります。治療薬に対応した特定の診断薬キットを正しく用いる、使用方法を遵守する、手技に習熟するなどの取り組みによって、ばらつきを少なくすることは可能です。
キイトルーダ®の投与に際しては、コンパニオン診断薬であるPD-L1 IHC 22C3 pharmDx「ダコ」(ASL48用)を用い、以下に示した点に留意して検査を行ってください。また、本IHC検査キットはアジレント社の「ダコAutostainer Link 48」を用いて最適化されているため、抗体に付随した自動染色装置を用いる必要があります。
本キットはFFPE標本に対し最適化されています。検体および染色標本作製については次のような点に注意して行ってください。また、固定までの時間、固定法、固定時間は記録に残すことをお勧めします。
FFPE:Formalin Fixed Paraffin Embedded(ホルマリン固定パラフィン包埋)
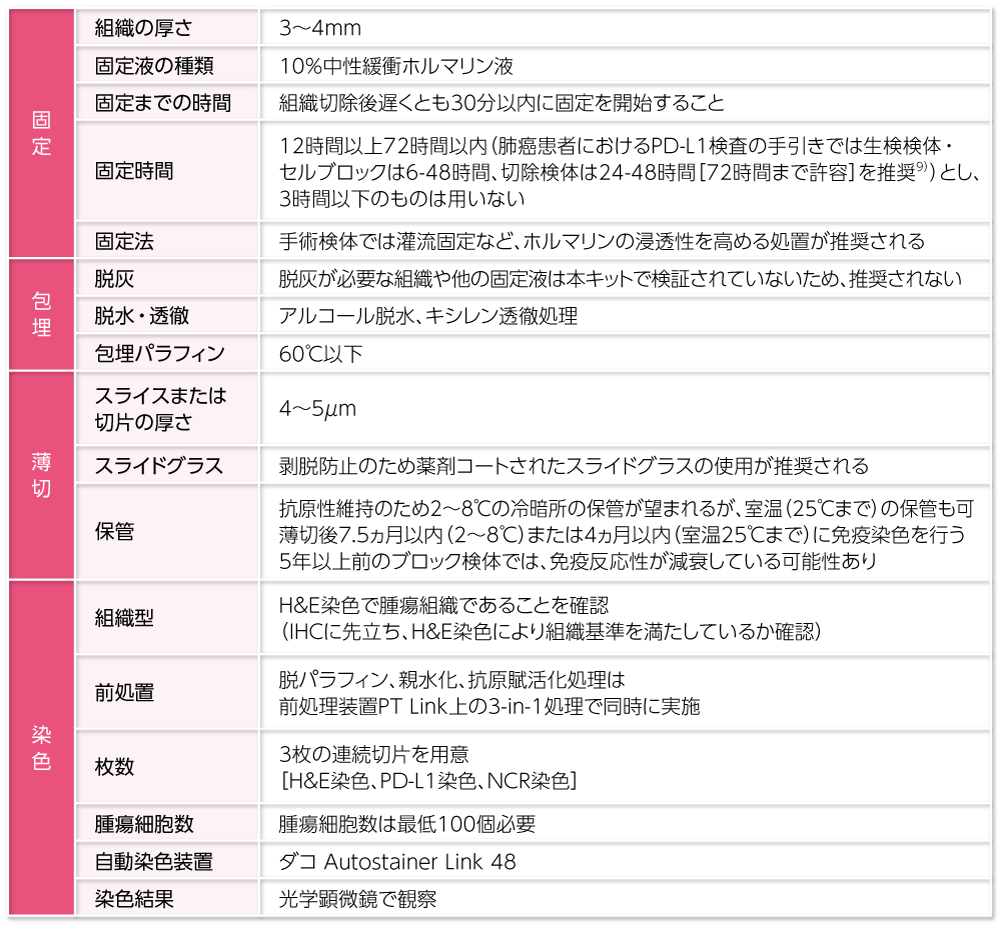
NCR:negative control reagent
【トリプルネガティブ乳癌組織検体処理にあたっての抗原賦活液について】
引用文献
1)PD-L1 IHC 22C3 pharmDx「ダコ」トリプルネガティブ乳癌染色結果判定マニュアル
2)日本肺癌学会編:バイオマーカー委員会編:肺癌患者におけるPD-L1検査の手引き 第2.0版