製品基本Q&A 600mg
製品基本Q&A
アイセントレス®錠600mg(ラルテグラビルカリウム)
製品情報
本剤の電子添文には、以下のとおり記載されています。
4. 効能又は効果
HIV感染症
5. 効能又は効果に関連する注意
5.1 本剤は抗HIV治療経験がないHIV感染患者、あるいはラルテグラビル400mg 1日2回と他の抗HIV薬でウイルス学的抑制が得られているHIV感染患者に使用すること。
5.2 本剤による治療にあたっては、患者の治療歴及び薬剤耐性検査結果を参考にすること。
HIVインテグラーゼは、HIV遺伝子にコードされたウイルス複製に必要な酵素であり、ラルテグラビルは、HIVインテグラーゼの触媒活性を阻害します。HIVインテグラーゼの阻害により、HIV感染初期において、HIVゲノムの宿主細胞ゲノムへの共有結合的挿入又は組込みが阻害されます。組み込まれなかったHIVゲノムは、感染性ウイルス粒子を新たに産生することができないため、ウイルスの感染拡大が阻止されます。なお、ラルテグラビルは、DNAポリメラーゼα、β、γを含むヒトホスホリルトランスフェラーゼに対し、顕著な阻害作用を示しませんでした。
<引用>
電子添文
600mg錠と400mg錠の製剤の大きな差異は、添加物を含む処方の違い、原薬の微粉砕化などがあります。結果として、600mg錠では製品規格条件における早い溶出性、高いバイオアベイラビリティや食事の影響が少ないこと示されましたが、その明確な理由までは判明していません(1)。
一般的にラルテグラビルのようなBCS II(*)に分類される化合物では、溶出性が吸収過程での律速段階のひとつの要因となることがあり、化合物のバイオアベイラビリティに影響することがあります。また、600mg錠での食事の影響は、ラルテグラビルの吸収過程に及ぼす食事の影響が更に複雑であると想定されています(1)。
(*)Biopharmaceutical Classification System class II (BCS II):高膜透過性/低溶解度
<引用>
(1)Krishna R et al. Clin Pharmacol Drug Dev. 2018;7(2):196-206.
健康成人における5日間の空腹時反復投与試験(291試験)において、ラルテグラビルは投与後速やかに吸収され、投与5日目におけるTmaxは、アイセントレス®1,200mg(600mg錠×2)1日1回投与群で2.00h及びアイセントレス®400mg 1日2回投与群で1.50hでした。
また、アイセントレス®400mg 1日2回投与群よりアイセントレス®1,200mg(600mg錠×2)1日1回投与群でAUCの幾何平均値が2.3倍(>処方量比:1200/800=1.5)、Cmaxの幾何平均値が6.0倍(>処方量比:1200/400=3)高く、トラフ濃度はアイセントレス®1,200mg(600mg錠×2)1日1回投与群の方がアイセントレス®400mg 1日2回投与群より低い値でした(1)。
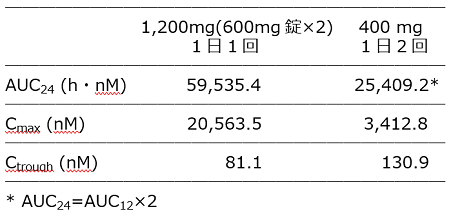
両群でラルテグラビルの血中濃度に違いは認められていますが、ONCEMRK試験の結果では、有効性及び安全性に違いはありませんでした(2)。
<引用>
(1)Krishna R et al. Clin Pharmacol Drug Dev. 2018;7(2):196-206.
(2)Cahn P et al. Lancet HIV. 2017;4(11):e486-e494.
有効性の低下はみられていません。
ONCEMRK試験におけるラルテグラビルの曝露量の四分位別の有効性解析において、アイセントレス®1,200mg(600mg錠×2)1日1回経口投与によりウイルス学的抑制が得られた患者の割合は、ラルテグラビルのトラフ濃度が最も低い四分位を含むすべてのトラフ濃度の四分位で高く、いずれも同程度でした。また、アイセントレス®400mg 1日2回経口投与との統合データに基づく四分位解析においても同様の結果が示されました。
これらのことから、ONCEMRK試験では、アイセントレス®1,200mg(600mg錠×2)1日1回経口投与及びアイセントレス®400mg 1日2回経口投与のいずれの投与群においても、すべてのトラフ濃度の四分位で有効性が最大反応を示す曝露量範囲に到達していることが示唆されました(1)。
<引用>
(1)アイセントレス錠600mg 申請資料概要 1.8.3.2.2
使用方法
本剤の電子添文には、以下のとおり記載されています。
6. 用法及び用量
通常、成人にはラルテグラビルとして1,200mg(本剤を2錠)を1日1回経口投与する。本剤は、食事の有無にかかわらず投与できる。なお、投与に際しては、必ず他の抗HIV薬と併用すること。
一般に高齢者では、肝、腎又は心機能が低下し、合併症を有している又は他の薬剤を併用している場合が多いので、注意して投与して下さい。
<引用>
電子添文
本剤の電子添文には、以下のとおり記載されています。
9. 特定の背景を有する患者に関する注意
9.5 妊婦
妊婦又は妊娠している可能性のある女性には治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
ラット及びウサギにおける高用量投与で、胎盤移行が認められている。また、ラットにおける高用量投与で、過剰肋骨が報告されている。
9.6 授乳婦
授乳を避けさせること。
動物実験(ラット)で乳汁中へ移行することが報告されている。ラルテグラビルがヒトの乳汁中に移行するか否かは不明である。乳汁を介してHIV母児感染の可能性がある。
小児等を対象とした臨床試験は実施していません。
<引用>
電子添文
過量投与によるデータは限られています。
ラルテグラビル1,800mg(600mg錠×3)1日1回の28日反復投与及びラルテグラビル800mg 1日2回の10日反復投与の高用量について、成人において検討しましたが、毒性は認められませんでした。また、2,400mgの偶発的投与が成人に認められましたが、毒性は認められませんでした。過量投与の場合には、標準的な支持処置(消化管からの未吸収物質の除去、心電図測定を含む臨床的モニタリング、必要に応じた支持療法など)を実施するのが適切です。血液透析によるラルテグラビル除去の程度は不明です。
<引用>
インタビューフォーム
気がついた時、すぐに1回分を飲んでください。ただし、次の通常服用する時間が近い場合には飲まずに、次の通常の服用時間に1回分を飲んでください。絶対に、2回分を一度に飲んではいけません。
<引用>
くすりのしおり
透析患者に対しアイセントレス®1,200mg (600mg錠×2) 1日1回投与を検討したデータはありません。電子添文には、「血液透析によるラルテグラビルの除去の程度は不明である。」と記載されています。
当初ラルテグラビル1日1回投与の用量として800mgを選択し、アイセントレス®800mg(400mg錠×2)1日1回経口投与とアイセントレス®400mg 1日2回経口投与の安全性及び有効性を、エムトリシタビン(FTC)及びテノホビルジソプロキシルフマル酸塩(TDF)併用下で比較した第Ⅲ相試験[071試験:QDMRK]を実施しました。
071試験において、48週時にHIV RNA量50コピー/mL未満を達成した患者の割合は、アイセントレス®800mg(400mg錠×2)1日1回経口投与(83.2%)よりもアイセントレス®400mg 1日2回経口投与(88.9%)の方が高く、アイセントレス®800mg(400 mg錠×2)1日1回経口投与の有効性が、アイセントレス®400mg 1日2回経口投与に対して非劣性であることを示せませんでした(1)。
これらのデータを解析した結果、ラルテグラビルのトラフ濃度が低い患者で治療失敗となるリスクがわずかに高まると予測されました。さらに、ラルテグラビルの有効性に対する曝露の影響を説明するために構築したウイルス力学モデルでの解析の結果、アイセントレス®1,200mg(600mg錠×2)1日1回経口投与は、アイセントレス®800mg(400mg錠×2)1日1回経口投与に比べラルテグラビルのトラフ濃度が増大して、アイセントレス®400mg 1日2回経口投与と同様の有効性を示し、アイセントレス®400mg 1日2回経口投与に対し非劣性を示す可能性が高いと予測されました(2)。
以上から、アイセントレス®1,200mg(600mg錠×2)1日1回経口投与の用法・用量を選択して、ONCEMRK試験(292試験)を実施し、アイセントレス®400mg 1日2回経口投与に対して非劣性が示されました。
<引用>
(1)Eron JJ Jr et al. Lancet Infect Dis.2011;11(12):907-915.
(2)アイセントレス錠600mg 申請資料概要1.8.3.2
電子添文の「5. 効能又は効果に関連する注意」に記載されているとおり、アイセントレス®400mg 1日2回と他の抗HIV薬でウイルス学的抑制が得られている方以外は、本剤への切り替えはできません。
(解説)
アイセントレス®錠600mgの承認申請に用いたデータでは、抗HIV治療経験がないHIV感染者におけるアイセントレス®1,200mg1日1回投与のアイセントレス®400mg1日2回投与に対する非劣性試験を検証したONCEMRK試験での両群のラルテグラビルの曝露量と有効性が検討された結果、添付文書の「5. 効能又は効果に関連する注意」が設定されており、アイセントレス®400mg 1日2回と他の抗HIV薬でウイルス学的抑制が得られている方以外の他剤からの切り替えは検討されていません。
<引用>
アイセントレス錠600mg 申請資料概要 1.8.2.4
アイセントレス®錠400mg 1日2回からアイセントレス®錠1,200mg(600mg錠×2)1日1回に切り替える場合、アイセントレス®錠400mg 1錠を服用後、次のアイセントレス®錠400mg 1錠を服用するタイミングで、代わりにアイセントレス®錠1,200mg(600mg錠×2)を服用することで切り替えが可能と考えられます。
【適応外】この情報には、承認されていない使用法の情報を含みます。
本剤のご使用にあたっては電子添文をご確認ください。
健康成人を対象とした第Ⅰ相臨床試験(290試験)において、400mg錠×3によるラルテグラビル1,200mg 1日1回経口投与では、600mg錠×2によるラルテグラビル1,200mg 1日1回経口投与と比較して、ラルテグラビルの曝露量は低く、食事内容によっては食後投与により更にラルテグラビルの血漿中曝露量を低下させることがあるため、600mg錠×2の代替として400mg錠×3を投与すると、同程度の有効性が得られない可能性が示唆されました。
また、海外第Ⅲ相臨床試験[ONCEMRK]では、アイセントレス®400mg錠(3錠)による1,200mg 1日1回経口投与の検討は行っていないことから、ラルテグラビルとして1,200mgを1日1回経口投与する際に、アイセントレス®600mg錠(2錠)の代替として400mg錠(3錠)を用いないようご注意ください。
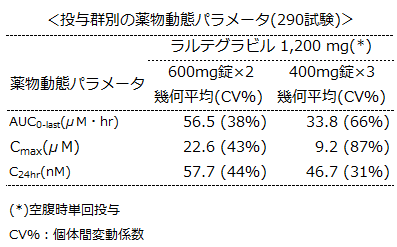
<引用>
(1)アイセントレス錠600mg 申請資料概要 2.7.1.2.1.1、2.7.1.3.2
(2)Krishna R et al. Clin Pharmacol Drug Dev. 2018;7(2):196-206.
アイセントレス®錠600mgについては、無包装状態(25℃/75%RH条件)での安定性試験の結果、2ヵ月までの安定性が確認されています。分包した場合は、2ヵ月以内にご使用いただくようお願いします。
他剤と一包化した際の安定性について検討していませんので、本剤を他剤と一包化することはおすすめしていません。
【適応外】
本剤を簡易懸濁して投与することは、承認外の用法となります。
簡易懸濁にて投与した際の薬物動態、有効性、安全性は検討していませんので、おすすめしていません。
簡易懸濁後の安定性データはありません。
【適応外】
本剤を粉砕して投与することは、承認外の用法となります。
粉砕して投与した際の薬物動態、有効性、安全性は検討していませんので、おすすめしていません。
粉砕後の安定性データはありません。
【適応外】
本剤を分割して投与することは、承認外の用法となります。
錠剤分割後の安定性について検討していませんので、おすすめしていません。
錠剤に割線はありません。
ONCEMRK試験においては、全例にテノホビルジソプロキシルフマル酸塩/エムトリシタビン(TDF/FTC)を併用下での安全性及び有効性を評価しています(1)。
しかし、電子添文の「用法及び用量」においては、「なお、投与に際しては、必ず他の抗HIV薬と併用すること。」とされており、他の抗HIV薬としてTDF/FTCを使用する規定はありません。
したがって、アバカビル/ラミブジン(ABC/3TC)も併用可能です。
<引用>
(1)Cahn P et al. Lancet HIV. 2017;4(11):e486-e494.
安全性
主な副作用は、悪心、腹痛、頭痛、下痢、嘔吐、浮動性めまいなどが報告されています。
<引用>
電子添文
電子添文の併用禁忌、併用注意には記載がありません。
マグネシウム、アルミニウム、鉄剤、亜鉛、サプリメント等とそれぞれ併用した際の影響についてはデータがなく不明です。
しかしながら、国内外のガイドライン(1)(2)において、アイセントレス®などインテグラーゼ阻害剤(INSTI)は、2価金属などの多価陽イオンを含む薬物、食品、又はサプリメントと相互作用を引き起こしてINSTIの吸収が低下する可能性が指摘されており、INSTIの食後服用の確認や服用間隔をあけるなど、併用には注意したほうがよいと考えられます。
電子添文では「水酸化マグネシウム及び水酸化アルミニウム含有制酸剤」及び「炭酸カルシウム含有制酸剤」が併用注意となっていますので、念のためウイルス量の推移にご注意ください。
<引用>
(1)厚生労働省研究班発行.抗HIV治療ガイドライン
(2)米国保健福祉省(DHHS)発行. HIVを保有する成人及び青少年における抗レトロウイルス薬の使用に関するガイドライン
電子添文の併用禁忌、併用注意には記載がありません。
酸化マグネシウムと併用した際の影響についてはデータがなく不明です。
しかしながら、国内外のガイドライン(1)(2)において、アイセントレス®などインテグラーゼ阻害剤(INSTI)は、2価金属などの多価陽イオンを含む薬物、食品、又はサプリメントと相互作用を引き起こしてINSTIの吸収が低下する可能性が指摘されており、INSTIの食後服用の確認や服用間隔をあけるなど、併用には注意したほうがよいと考えられます。
添付文書では「水酸化マグネシウム及び水酸化アルミニウム含有制酸剤」及び「炭酸カルシウム含有制酸剤」が併用注意となっていますので、念のためウイルス量の推移にご注意ください。
<引用>
(1)厚生労働省研究班発行.抗HIV治療ガイドライン
(2)米国保健福祉省(DHHS)発行. HIVを保有する成人及び青少年における抗レトロウイルス薬の使用に関するガイドライン
[併用注意]
アイセントレス®では薬物動態変化に対し、臨床的に意味のある変化であるかどうかを判断するための、Clinical boundが定められています。HIV RNA量との相関解析の結果、有効性の判断に最も適切であるとされたのがトラフ濃度であり、有効性の面からはCminを維持できるかどうかで判断されます。
アイセントレス®錠1,200 mg(600mg錠×2) 1日1回投与では、Cminの90%信頼区間の下限 >0.75(すなわち25%未満の減少)までが有効性に対し臨床的に意味のある影響を及ぼさない曝露量変化として許容しています(1)。
アイセントレス®錠1,200 mg(600mg錠×2) 1日1回投与では、同時及び12時間後の炭酸カルシウム含有制酸剤の併用においてラルテグラビルのCminの90%信頼区間の下限が0.75よりも低かったことから、本剤の有効性が減弱するおそれがあるため、本剤投与後12時間以内の炭酸カルシウム含有制酸剤との併用を併用注意に設定しています(2)(3)。
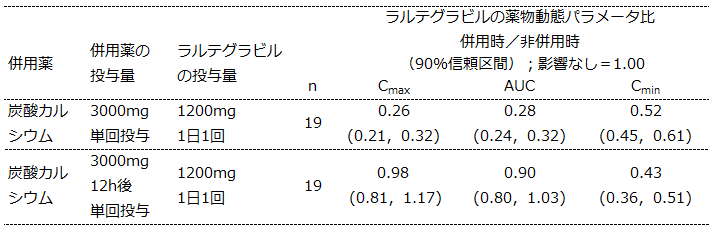
<引用>
(1)アイセントレス錠600mg 申請資料概要 2.7.2.3.3.1.2
(2)Krishna R et al. J Pharm Pharmacol. 2016;68(11):1359-1365.
(3)アイセントレス錠600mg 添付文書
アイセントレス®1,200mg(600mg錠×2)1日1回投与群とアイセントレス®400mg 1日2回投与群の安全性プロファイルは同様で、副作用の増加はみられませんでした。
<副作用の発現状況>
ONCEMRK試験における96週時までの結果において、臨床症状の副作用はアイセントレス®1,200mg 1日1回(QD)投与群で138例(26.0%)、 アイセントレス®400mg 1日2回(BID)投与群で71例(26.7%)にみられ、両群で同様のプロファイルでした。また、臨床検査値の副作用は、QD群で7例(1.3%)、BID群で6例(2.3%)であり、両群で同様のプロファイルで、QD群で新たな安全性の懸念は示されませんでした。
なお、QD群で頻度の高かった副作用は、悪心[QD群40例(7.5%)、BID群20例(7.5%)]、腹痛[QD群16例(3.0%)、BID群3例(1.1%)]、頭痛[QD群16例(3.0%)、BID群13例(4.9%)]、下痢[QD群13例(2.4%)、BID群7例(2.6%)]、嘔吐[QD群12例(2.3%)、BID群6例(2.3%)]、浮動性めまい[QD群12例(2.3%)、BID群9例(3.4%)]でした。
<血中濃度(曝露量)との関連>
ONCEMRK試験におけるラルテグラビルの曝露量(AUC0-24hr及びCmax)の四分位別の安全性解析では、48週時点におけるアイセントレス®1,200mg(600mg錠×2)1日1回投与の安全性プロファイルは、曝露量が最も高い四分位(AUC0-24hr:69~365μM・hr、Cmax:20.5~48μM)とそれ以外の四分位(AUC0-24hr:16.5~69μM・hr、Cmax:1.8~20.5μM)の患者間で顕著な違いは認められず、曝露量増加に関連した傾向もみられませんでした。したがって、アイセントレス®1,200mg(600mg錠×2)1日1回投与時の最も高い曝露量においても、安全性のリスクが上昇する可能性がないことが確認されました。
また、健康成人にアイセントレス®1,800mg(600mg錠×3)※1日1回を28日間反復経口投与した試験(293試験)では、アイセントレス®1,800mg(600mg錠×3)※1日1回反復投与での曝露量は、アイセントレス®1,200mg(600mg錠×2)1日1回投与と比較してやや高かったが、用量の増加に伴ってこれ以上曝露量は増加しないことが示唆され、その際の忍容性は概して良好であり、重篤な有害事象及び試験中止に至った有害事象は報告されませんでした。
※【注意!】承認された用量は、1,200mg(本剤を2錠)を1日1回経口投与です。
<引用>
(1)アイセントレス錠600mg 申請資料概要 1.8.3.2.3、1.5.3.4.1.3
[リファンピシン-併用注意]
リファンピシンとの併用により本剤の血漿中濃度が低下する可能性があり、有効性が減弱するおそれがあります。
併用する際は、注意してご使用ください。
アイセントレス®錠600mgを用いた検討は実施していませんが、アイセントレス®錠400mgを用いた臨床薬物相互作用試験の結果(1)より、アイセントレス®1200mg(600mg錠×2) 1日1回投与時でもUGT1A1の誘導作用を有するリファンピシンとの併用により、臨床的に意味のあるラルテグラビルの血漿中濃度の低下が起こると予測されます(2)。
<ガイドライン>
厚生労働科学研究の研究班による抗HIV治療ガイドラインでは、アイセントレス®400mg 1日2回投与に対し、『リファンピシンと併用する場合、ラルテグラビルを倍量すなわち800mg 1日2回※投与にするとAUC、Cmaxは維持されるので併用禁忌とはならないが、トラフ値が低値となる可能性があることを知っておかなければならない。リファブチンとラルテグラビルの併用は可能であり、ラルテグラビルは常用量でよい。』とされています(3)。
※800mg 1日2回:承認された用法・用量ではありません。
<引用>
(1)Wenning LA et al. Antimicrob Agents Chemother. 2009;53(7):2852-2856.
(2)インタビューフォーム Ⅷ.安全性(使用上の注意等)に関する項目 7. 相互作用
(3)厚生労働科学研究班発行. 抗HIV治療ガイドライン.
[併用注意]
アイセントレス®では薬物動態変化に対し、臨床的に意味のある変化であるかどうかを判断するための、Clinical boundが定められています。HIV RNA量との相関解析の結果、有効性の判断に最も適切であるとされたのがトラフ濃度であり、有効性の面からはCminを維持できるかどうかで判断されます。
アイセントレス®錠1,200 mg(600mg錠×2) 1日1回投与では、Cminの90%信頼区間の下限 >0.75(すなわち25%未満の減少)までが有効性に対し臨床的に意味のある影響を及ぼさない曝露量変化として許容しています(1)。
アイセントレス®錠1,200 mg(600mg錠×2) 1日1回投与では、12時間後のマグネシウム/アルミニウム含有制酸剤の併用においてラルテグラビルのCminの90%信頼区間の下限が0.75よりも低かったことから、本剤の有効性が減弱するおそれがあるため、本剤投与後12時間以内の水酸化マグネシウム/水酸化アルミニウム含有制酸剤との併用を併用注意に設定しました(2)(3)。

<引用>
(1)アイセントレス錠600mg 申請資料概要 2.7.2.3.3.1.2
(2)Krishna R et al. J Pharm Pharmacol. 2016;68(11):1359-1365.
(3)アイセントレス錠600mg 電子添文
[併用注意]
アイセントレス®1,200mg(600mg錠×2)1日1回の投与前12時間以内に水酸化マグネシウム/水酸化アルミニウム制酸剤を併用した際の影響は試験を実施していないためデータはありませんが、アイセントレス®400mg 1日2回の投与前後6時間での併用で同程度のトラフ濃度の低下がみられており(1)、アイセントレス®1,200mg(600mg錠×2)1日1回の投与前12時間以内の併用でもトラフ濃度が低下する可能性は否定できません。
ただし、併用禁忌ではありませんので、400mg 1日2回と同様に、医師のご判断で注意しての併用をお願いいたします。
<引用>
(1)アイセントレス錠400mg 電子添文
[併用注意]
アイセントレス®1,200mg 1日1回投与とカルバマゼピン、フェノバルビタール、フェニトインとの薬物相互作用試験は実施されておりませんが、UGTの誘導剤であり、臨床的に意味のあるラルテグラビルの血中濃度の低下が起こり、本剤の有効性が減弱するおそれがあるため、併用注意に設定されました(1)。
<引用>
(1)アイセントレス錠600mg 申請資料概要1.8.4、2.7.2.3.3.1.2
その他
ONCEMRK試験における主要評価項目の解析方法では、NC=F(Non Complete=Failure)法、つまり、ウイルス学的抑制が得られなかった患者だけでなく、理由を問わず早期中止によりウイルス学的データがない患者(未完了例)はすべて治療失敗例と定義しています。これは、FDAスナップショット法とも呼ばれ、抗HIV薬の臨床試験では標準的な手法です。
NC=F法における失敗例の11.1%のうち、48週時点で40コピー/mL以上であった患者は5.5%、ウイルス学的データがない患者は5.6%でした。
なお、効果不十分による中止例を失敗例とみなすObserved Failure(OF)法による解析では、48週時点でのアイセントレス®1,200mg(600mg 錠×2)1日1回の有効率(40コピー/mL未満の患者の割合)は94.2%でした。
<引用>
アイセントレス錠600mg 申請資料概要 2.5.4.2.4
ONCEMRK試験のウイルス学的失敗の定義は2つあります(1)。
1. ノンレスポンダー: 24週時までに一度もHIV-1 RNA <40コピー/mLを達成しなかった被験者
又は
2. リバウンダー(再上昇): 最初のHIV-1 RNA <40コピー/mL達成から少なくとも1週間経過後に、2回連続でHIV-1 RNA ≧40コピー/mLとなった被験者
<引用>
(1)Cahn P et al. Lancet HIV. 2017;4(11):e486-e494.
ONCEMRK試験のプロトコールで規定したウイルス学的失敗(PDVF)に対しウイルス耐性検査を実施しました(薬剤耐性検査の閾値に基づき、HIV RNA ≧500コピー/mLの被験者について中央検査機関で実施)。
また、早期中止時にHIV RNA≧500コピー/mLであった被験者も耐性検査(遺伝子型及び表現型解析)を実施しました。
<引用>
Cahn P et al. Lancet HIV. 2017;4(11):e486-e494.
<耐性検査実施数>
ONCEMRK試験の96週時におけるアイセントレス®1,200mg 1日1回(QD)投与群51例、アイセントレス®400mg 1日2回(BID)投与群26例の治療失敗例のうち、薬剤耐性検査の実施基準(薬剤耐性検査の閾値に基づき、HIV RNA 量500コピー/mL以上と定義)に該当し検査が実施されたのは、QD群の17例とBID群の8例でした。
<耐性出現例数>
薬剤耐性検査が実施されたQD群の17例とBID群の8例のうち、薬剤耐性が認められたのは、QD群では6/17例で1.1%[ラルテグラビル(RAL)とエムトリシタビン(FTC)に耐性:4例、FTCのみに耐性:2例]、BID群では3/8例で1.1%[RAL、FTC及びテノホビルジソプロキシルフマル酸塩(TDF)に耐性:1例、RALとFTCに耐性:1例、FTCとTDFに耐性:1例]でした。96週時のRALに対する耐性発現率は、QD群で0.8%(4/531例)、BID群で0.8%(2/266例)でした。
ONCEMRK試験において薬剤耐性発現はまれであり、本試験の薬剤耐性発現割合はRALの他の試験でみられた薬剤耐性発現割合の範囲の下限と同程度でした。また、薬剤耐性発現パターンは、抗HIV薬の治療経験がない患者及び抗HIV薬の治療経験がある患者を対象として海外で実施されたBID投与の第Ⅲ相臨床試験で報告されたものと類似していました。
<引用>
アイセントレス錠600mg 申請資料概要1.8.3.2.1
日本人は含まれていませんが、ONCEMRK試験においては、アジアの国(マレーシア、フィリピン、台湾、タイ)が参加しており、日本人と体格の近いアジア人においても有効性、忍容性に問題は認められませんでした(1)(2)。
<引用>
(1)アイセントレス錠600mg 申請資料概要2.5.5.3.1、2.5.4.2.4.5
(2)Cahn P et al. Lancet HIV. 2017;4(11):e486-e494.
ONCEMRK試験で用いられたアッセイ法(Abbott RealTime HIV-1 Assay)の検出下限から、主要評価項目におけるHIV-1 RNA量の基準を40コピー/mL未満に設定しました。
なお、ONCEMRK試験では補助評価項目として、HIV-1 RNA量 50コピー/mL未満及び 200コピー/mL未満を達成した患者の割合も解析しています。50コピー/mL未満の基準を設定している理由は、抗HIV療法(ART)の臨床試験で共通して使用される評価項目であり、過去の試験との比較のためと考えられます。
<引用>
Cahn P et al. Lancet HIV. 2017;4(11):e486-e494.