BENCHMRK-1、BENCHMRK-2試験
BENCHMRK-1、BENCHMRK-2試験
抗HIV治療経験患者を対象にした第Ⅲ相臨床試験(BENCHMRK 1、BENCHMRK 2試験注))(海外データ)1)~3)
[目 的]
対象患者におけるアイセントレス®(400mg 1日2回)のウイルス学的及び免疫学的効果、安全性を評価する。
[試験デザイン]
多施設共同、無作為化、二重盲検、プラセボ対照非劣性検証試験
[対 象]
HIV感染患者で、3クラスの抗HIV薬[ 核酸系逆転写酵素阻害剤(NRTI)、非核酸系逆転写酵素阻害剤(NNRTI)、プロテアーゼ阻害剤(PI)]の各々で1剤以上に耐性が確認され、血漿中HIV RNA量が1,000copies/mL以上である16歳以上の699例
[方 法]
アイセントレス®(400mg 1日2回)と最適基礎療法*1) OBT:optimized background therapy)又はプラセボとOBTのいずれかを96週間投与した。無作為化では、プロテアーゼ阻害剤に対する薬剤耐性の程度(1剤又は2剤以上)及びOBTでのenfuvirtide*2)使用の有無によって層別化した。OBTは、無作為化前に、薬剤耐性検査(遺伝子型解析/表現型解析)及び抗HIV治療歴に基づいて治験責任医師が選択した。
[評価項目]
主要評価項目:16週における血漿中HIV RNA量<400copies/mLの患者の割合
安全性評価
副次評価項目:16週における血漿中HIV RNA量(Log10 copies/mL)のベースラインからの平均変化量
16週におけるCD4リンパ球数のベースラインからの平均変化量
各時点(2, 4, 8, 12, 16, 24, 32, 40, 48, 60, 72, 84, 96週)における血漿中HIV RNA量< 50copies/mLの患者の割合 など
[解析計画]
主要評価項目である16週における血漿中HIV RNA量<400 copies/mLの患者の割合について、ウイルス学的効果に影響を与える可能性のある共変量(ベースラインの血漿中HIV RNA量、enfuvirtide治療未経験患者へのOBTでのenfuvirtide初回投与、OBTに含まれる表現型耐性検査において感受性を示したPIの有無、darunavir治療未経験患者へのOBTでのdarunavir初回投与、試験および治療法など)の補正後、ロジスティック回帰分析を行い、両側検定のP値がP<0.05のとき群間に有意差が認められるとした。
[有効性]
主要評価項目である16週における血漿中HIV RNA量<400copies/mLの患者の割合は、アイセントレス®群において77.3%( 355/459 例)、プラセボ投与群において41.8%( 99/237例)であり、ロジスティック回帰分析により算出したオッズ比の95%信頼区間の下限値が5.60と、1を上回ったことから、アイセントレス®群のプラセボ投与群に対する優越性が検証されました。※1
副次評価項目である16週における血漿中HIV RNA量のベースラインからの平均変化量は、アイセントレス®群及びプラセボ投与群においてそれぞれ-1.88 、-0.92 Log10 copies/mLでした。※2
また、16週におけるCD4陽性リンパ球数のベースラインからの平均変化量は、アイセントレス®群とプラセボ投与群においてそれぞれ+83.86 、+35.58cells/mm3でした。※2
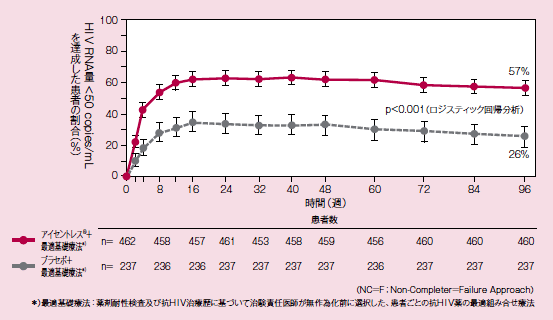
各時点(2, 4, 8, 12, 16, 24, 32, 40, 48, 60, 72, 84, 96週)における血漿中HIV RNA量<50 copies/mLの患者の割合は図のように推移しました。96週における血漿中HIV RNA量<50 copies/mLの患者の割合は、アイセントレス® 投与群では57%、プラセボ投与群では26%であり、アイセントレス®投与群の優越性が検証されました(両側検定、P<0.001)。※3
※1 未完了例=失敗例とした。ただし、規定した評価時点のデータが欠測であっても、その前後の来院ともHIV RNA量が<400copies/mL、又はHIV RNA量が<50copies/mLの場合は、当該欠測値を解析から除外した。
※2 効果不十分のために割り付けられた治療を中止した患者では、ベースライン値を評価値として扱うObserved Failure法を採用した(Observed Failure法:効果不十分による中止例=失敗例)。
※3 未完了例=失敗例とした。
BENCHMRK 1試験とBENCHMRK 2試験の併合データ:
投与群別の転帰(48 及び96 週時)(主要/副次評価項目)
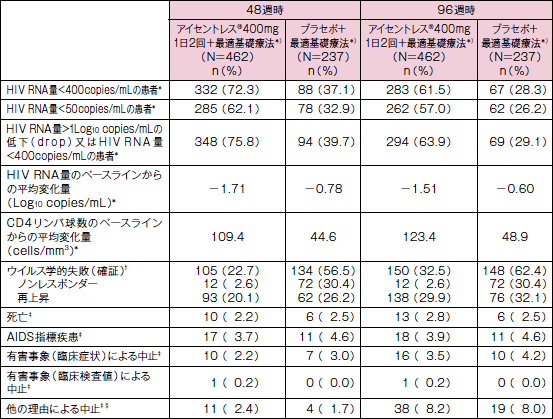
* 欠測値の取扱い方法:二者択一で評価を行う項目(患者割合の評価)については、未完了例=失敗例とした。ただし、規定した評価時点のデータが欠測であっても、その前後の来院ともHIV RNA量が<400copies/mL、又はHIV RNA量が<50copies/mLの場合は、当該欠測値を解析から除外した。HIV RNA量(Log10 copies/mL)のベースラインからの変化量及びCD4リンパ球数のベースラインからの変化量については、効果不十分のために割り付けられた治療を中止した患者では、ベースライン値を評価値として扱うObserved Failure法を採用した(Observed Failure法:効果不十分による中止例=失敗例)。
† ウイルス学的失敗:第16週までにHIV RNA量が>1.0Log10 copies/mLの低下をしなかった患者、又はHIV RNA量が<400copies/mLに達しなかった患者をノンレスポンダーと定義した。またウイルス量の再上昇は、1週間以上の間隔で2回連続的に行った測定において、(a)HIV RNA量がいったん<400copies/mLに到達後、>400copies/mLに上昇した患者又は(b)HIV RNA量がいったん到達した最低レベルより>1.0Log10 copies/mLの再増加をした患者と定義した。
‡ 48週時の結果は最低48週時のデータを含む。96週時の結果は、96週までのデータを含む。
§ 追跡不能、同意の撤回、服薬不良、治験実施計画書からの逸脱、その他の理由を含む。
N=各投与群の患者数
BENCHMRK 1試験とBENCHMRK 2試験の併合データ:
血漿中HIV RNA量<50copies/mLを達成した患者の割合の推移(95%信頼区間)(副次評価項目)
(未完了例=失敗例;NC=F法)
[安全性]
96週までの副作用発現率は、アイセントレス® 投与群で58 .4%(270/462 例)、プラセボ投与群で58 .6%(139/237例)でした。アイセントレス®投与群の主な副作用(発現率≧2%)は、頭痛22例(4.8%)、悪心19例(4.1%)、下痢15例(3.2%)、疲労15例(3.2%)、腹部膨満感10例(2.2%)でした。プラセボ投与群の主な副作用は、頭痛12例(5. 1%)、下痢12例(5. 1%)、悪心11例(4. 6%)、発熱6例(2. 5%)、嘔吐5例(2. 1%)でした。
重篤な副作用は、アイセントレス®投与群13例で中毒性腎炎、陰部ヘルペス、慢性腎不全、腎尿細管壊死、薬物性過敏症、急性腎不全、好中球減少症、腎不全および偶発的過量投与が各1件、心筋梗塞、肝炎、胃炎および貧血が各2件、過敏症が3件、プラセボ投与群9例で中毒性肝炎、エイズ関連認知症症候群、基底細胞癌、扁平上皮癌、悪性リンパ腫、高血糖症、腎不全、腎結石症、膵炎、好中球減少症および赤血球形成不全が各1件でした。試験薬の投与中止に至った副作用は、アイセントレス® 投与群6例で肝炎、肝腫大、高乳酸血症、腎不全、注射部位過敏症、注射部位反応および鼓腸が各1件、プラセボ投与群2例で悪心および赤血球形成不全が各1件でした。なお、試験期間中にアイセントレス®投与群で13例、プラセボ投与群で7例の患者が死亡し、うちプラセボ投与群の2例(エイズ関連認知症症候群および悪性リンパ腫が各1件)において薬剤との関連が認められました。
注)BENCHMRK:Blocking integrase in treatment Experienced patients with a Novel Compound against HIV:MeRcK, MK-0518
BENCHMRK 1及びBENCHMRK 2試験の試験デザインは同一であり、参加国が異なる。
BENCHMRK 1(350例):ヨーロッパ、アジア/太平洋沿岸諸国、ペルー
BENCHMRK 2(349例):南北アメリカ
※本試験計画時のもの
*1)最適基礎療法:薬剤耐性検査及び抗HIV治療歴に基づいて治験責任医師が無作為化前に選択した、患者ごとの抗HIV薬の最適組み合せ療法
*2)国内未承認薬ですが、承認時評価資料であることからデータを掲載しています。
1)承認時評価資料(海外第Ⅲ相試験:BENCHMRK1及び2)
2)Steigbigel RT, et al. N Engl J Med 2008;359(4):339-354.
(利益相反:Merck Sharp & Dohme Corp., a subsidiary of Merck & Co., Inc., N.J., U.S.A.が本試験に資金提供。Steigbigel、LoutfyはMerck Sharp & Dohme Corp., a subsidiary of Merck & Co., Inc., N.J., U.S.A.の委託研究者。Cooperは講師料、アドバイザー料を受領。Kumar、Clotetはコンサルタント料、講師料を受領。Eron、Schechterはコンサルタント料または講師料を受領。Markowitzはコンサルタント料、助成金を受領。Lennoxはコンサルタント料を受領。Gatellは助成金または講師料またはアドバイザー料を受領。Rockstroh、Katlamaは講師料またはアドバイザー料を受領。Yeniは助成金、アドバイザー料を受領。Lazzarinはアドバイザー料、コンサルタント料、講師料を受領。Zhao、Chen、Meibohm、Miller、Hazuda, DiNubile、Isaacs、Nguyen、Teppler、Mr. Ryan、Rhodes、Killar、Gilde、Strohmaier、NesslyはMerck Sharp & Dohme Corp., a subsidiary of Merck & Co., Inc., N.J., U.S.A.米国研究所員。)
3)Steigbigel RT, et al. Clin Infect Dis 2010;50(4):605-612.
(利益相反:Merck Sharp & Dohme Corp., a subsidiary of Merck & Co., Inc., N.J., U.S.A.が本試験に資金提供。Steigbigel、Cooper、Kumar、Eron、Schechter、Markowitz、Loutfy、Lennox、ClotetはMerck Sharp & Dohme Corp., a subsidiary of Merck & Co., Inc., N.J., U.S.A.の委託研究者。Steigbigel 、Cooper、Kumar、Eron、Schechter、Markowitz、Lennox、Gatell、Rockstroh、Katlama、Yeni 、Lazzarin、ClotetはMerck Sharp & Dohme Corp., a subsidiary of Merck & Co., Inc., N.J., U.S.A.から講師料、アドバイザー料またはコンサルタント料を受領。Cooper、Eron、Markowitz、Loutfy、Gatell、Lennox、Yeni、LazzarinはMerck Sharp & Dohme Corp., a subsidiary of Merck & Co., Inc., N.J., U.S.A.から研究助成を受けた。Zhao、Chen、Meibohm、Miller、Hazuda、DiNubile、Isaacs、Nguyen、Teppler、Ryan、Rhodes、Killar、Gilde、Strohmaier、Nessly、BarnardはMerck Sharp & Dohme Corp., a subsidiary of Merck & Co., Inc., N.J., U.S.A.米国研究所員。)
「禁忌」等その他の項目は、添付文書をご参照ください。