ONCEMRK試験
臨床成績
本剤は海外での臨床試験をもとに承認されたため、国内での臨床試験は実施していません。
海外第Ⅲ相臨床試験(ONCEMRK試験)
治療未経験HIV感染者を対象とした海外第Ⅲ臨床試験1)
1)承認時評価資料(海外第Ⅲ相臨床試験:ONCEMRK)
試験概要
目 的:
抗HIV治療未経験のHIV感染者を対象に、アイセントレス® 1,200mg(600mg錠×2)1日1回投与の有効性及び安全性をアイセントレス® 400mg 1日2回投与と比較検証する。
対 象:
抗HIV治療の経験がない18歳以上のHIV感染者797例(HIV RNA量≧1,000copies/mL)
方 法:
対象をアイセントレス® 1,200mg(600mg錠×2)1日1回投与群、アイセントレス® 400mg 1日2回投与群に2:1で無作為に割付け、どちらもテノホビル(TDF)300mg/エムトリシタビン(FTC)200mgを併用し、96週間治療を行った。
無作為化にあたっては、スクリーニング時のHIV RNA量及びB型、C型肝炎ウイルスの重複感染状況によって層別の割付を行った。
試験デザイン:
多施設共同、無作為化、二重盲検、実薬対照第Ⅲ相、非劣性検証試験

主要評価項目:
48週時におけるHIV RNA量<40copies/mLの患者の割合(検証的解析項目)
副次評価項目:
48週時におけるCD4陽性リンパ球数のベースラインからの変化量、96週時におけるHIV RNA量<40copies/mLの患者の割合
96週時におけるCD4陽性リンパ球数のベースラインからの変化量、48週時及び96週時における安全性及び忍容性
補助評価項目:
48週時及び96週時におけるHIV RNA量<50copies/mLの患者の割合
48週時及び96週時におけるHIV RNA量<200 copies/mLの患者の割合
解析計画:
各層(スクリーニング時のHIV RNA量≦100,000copies/mL又はHIV RNA量>100,000copies/mL)の投与群ごとの症例数の調和平均によって重み付けしたMantel-Haenszel法により、有効率の投与群間差の95%信頼区間を算出した。CD4細胞数の平均変化量の差の95%信頼区間は、t分布に基づいて求めた。
主要評価項目の有効率の投与群間差の95%信頼区間の下限が-10%を上回る場合には、アイセントレス® 1,200mg (600mg錠×2)1日1回投与は、アイセントレス® 400mg 1日2回投与に対して非劣性であるとした。主要評価項目・副次評価項目について、患者背景別(年齢、性別、スクリーニング時のHIV RNA量、ベースライン時の HIV RNA量、ベースライン時のCD4陽性リンパ球数、B型またはC型肝炎ウイルスへの重複感染の有無、人種及びHIVサブタイプ)にサブグループ解析を行った。
結果
48週時においてHIV RNA量<40copies/mLの患者の割合は、アイセントレス®1,200mg (600mg錠×2)1日1回投与群88.9%、アイセントレス®400mg 1日2回投与群88.3%であり、その群間差(95%信頼区間)は0.5(-4.2,5.2)と95%信頼区間の下限が-10%を上回ったことから、アイセントレス®1,200mg(600mg錠×2)1日1回投与はアイセントレス®400mg 1日2回投与に対して非劣性であることが検証されました。〔海外データ〕
●HIV RNA量<40copies/mLの患者の割合の推移(NC=F法†)( 非劣性試験、検証的解析結果、主要評価項目:48週時)

アイセントレス®1,200mg(600mg錠×2)1日1回投与群及びアイセントレス®400mg1日2回投与群のいずれも、ベースライン時のHIV RNA量にかかわらずウイルス学的抑制効果を示しました。〔海外データ〕
●主要評価項目のサブグループ解析:ベースライン時のHIV RNA量別にみた48週時におけるHIV RNA<40copies/mLの患者の割合(observed Failure法※)

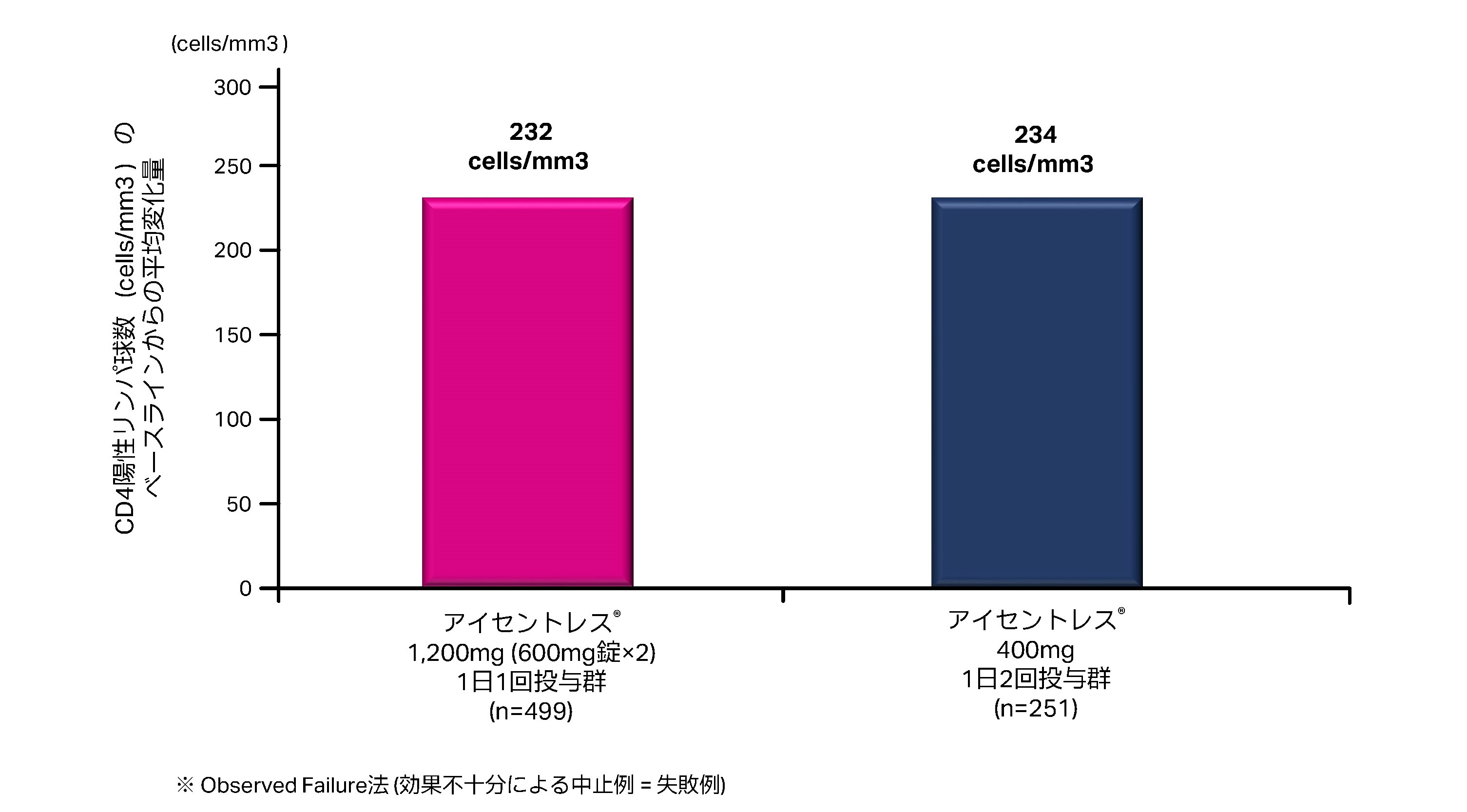
48週時においてCD4陽性リンパ球数のベースラインからの変化量は、アイセントレス®1,200mg(600mg錠×2)1日1回投与群で232cells/mm3、アイセントレス®400mg1日2回投与群で234cells/mm3でした。〔海外データ〕
●副次評価項目:48週時におけるCD4陽性リンパ球数のベースラインからの変化量(observed Failure法※)
安全性
96週時までの副作用発現率はアイセントレス®1,200mg(600mg錠×2)1日1回投与群では138/531例(26.0%)、アイセントレス®400mg 1日2回投与群では71/266例(26.7%)でした。また、臨床検査値異常の発現率はアイセントレス®1,200mg(600mg錠×2)1日1回投与群では7/531例(1.3%)、アイセントレス®400mg 1日2回投与群では6/266例(2.3%)でした。
2%以上に認められた主な副作用は、アイセントレス®1,200mg(600mg錠×2)1日1回投与群では悪心40例(7.5%)、腹痛16例(3.0%)、頭痛16例(3.0%)、下痢13例(2.4%)、嘔吐12例(2.3%)、浮動性めまい12例(2.3%)、アイセントレス®400mg 1日2回投与群では悪心20例(7.5%)、頭痛13例(4.9%)、浮動性めまい9例(3.4%)、下痢7例(2.6%)、嘔吐6例(2.3%)でした。本試験において、いずれの投与群でも患者の2%以上に報告された中等度又は重度の副作用はありませんでした。
重篤な副作用は、アイセントレス®1,200mg(600mg錠×2)1日1回投与群では頭痛1例、アイセントレス®400mg 1日2回投与群では一過性のHIV RNA量増加1例、嘔吐1例でした。
試験薬の投与中止に至った副作用は、アイセントレス®400mg 1日2回投与群で薬疹2例、血小板減少症2例であり、アイセントレス®1,200mg(600mg錠×2)1日1回投与群ではみられませんでした。試験薬の投与中止に至った臨床検査値の副作用はアイセントレス®1,200mg(600mg錠×2)1日1回投与群で血中CK上昇2例、ALT上昇2例、AST上昇2例であり、アイセントレス®400mg 1日2回投与群ではみられませんでした。