開発の経緯
開発の経緯
ロタウイルスは、5歳未満の乳幼児にみられる重度の下痢の主な原因であり、社会・経済的状態や衛生状態にかかわらず、世界中のほぼすべての小児が感染します1。

 ロタウイルスによる胃腸炎は、主に糞口経路で伝播すると考えられており2、感染すると糞便中に多量のウイルスが排出されます。さらに、ロタウイルスの感染力は強く、衛生状態の改善や社会基盤の整備のみによって感染伝播を制御することは難しいと考えられています3。そのため、死亡率および罹患率は発展途上国において非常に高いだけでなく、本邦を含む先進国においても罹患率および入院率は高く、医療資源に大きな影響を与えていました。
ロタウイルスによる胃腸炎は、主に糞口経路で伝播すると考えられており2、感染すると糞便中に多量のウイルスが排出されます。さらに、ロタウイルスの感染力は強く、衛生状態の改善や社会基盤の整備のみによって感染伝播を制御することは難しいと考えられています3。そのため、死亡率および罹患率は発展途上国において非常に高いだけでなく、本邦を含む先進国においても罹患率および入院率は高く、医療資源に大きな影響を与えていました。
また、ロタウイルス胃腸炎に対する特異的な抗ウイルス療法は開発されておらず、対症療法が中心となることから4、予防効果の高いロタウイルスワクチンの開発が求められました。
このような背景に加え、ロタウイルスによる最初の感染は主に血清型特異的な反応を誘発すること、また、異なる型に複数回感染を繰り返すことが示されており5、Merck Sharp & Dohme Corp., a subsidiary of Merck & Co., Inc., Whitehouse station, N. J., U.S.A.は、高頻度にみられるG1、G2、G3、G4およびP[8]型の再集合体ロタウイルス株を含有する5価経口弱毒生ロタウイルスワクチン、ロタテック®を開発しました。
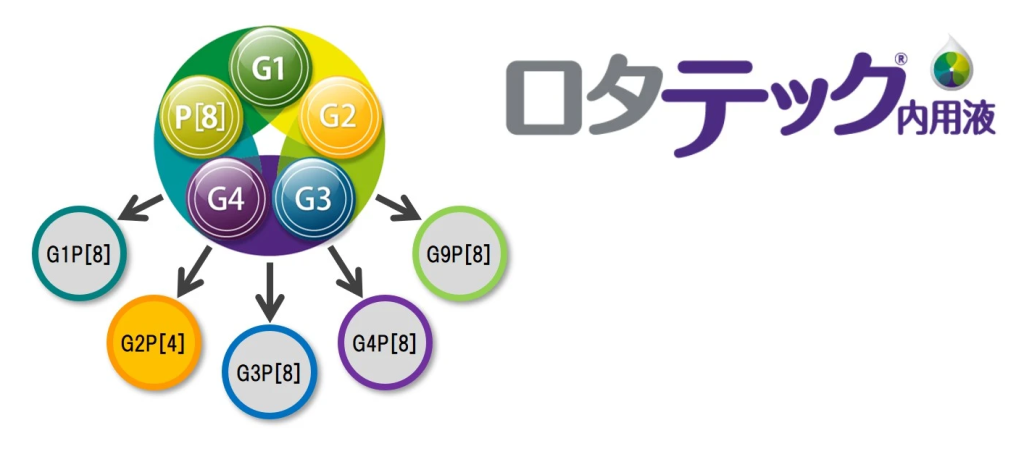
海外においては、第Ⅰ相および第Ⅱ相臨床試験、そして大規模臨床試験(006試験)を含む第Ⅲ相臨床試験により、安全性、免疫原性、有効性が検討され、世界120以上の国と地域で製造販売承認を取得しています(2020年7月現在)。また2006年には、米国の予防接種諮問委員会により、米国内の乳児に対する定期予防接種にロタテック®を含めることが推奨されました6。
本邦においては、海外臨床試験の結果から設定した用法・用量を用いて第Ⅲ相臨床試験(029試験)が実施され、日本人健康乳児に対する有効性および安全性が検討されました。これらの試験結果と海外臨床試験結果を基に承認申請を行い、2012年1月に製造販売承認を取得しました。
1.CDC. MMWR Recomm Rep 2009 ; 58(RR-2): 1-25.
2.Fischer TK et al. Vaccine 2004 ; 22(S): S49-S54.
3.谷口孝喜. 小児科診療 2007 ; 70(12): 2283-2287.
4.佐藤吉壮. 化学療法の領域 2007 ; 23(81): 17-24.
5.Velázquez FR et al. N Engl J Med 1996 ; 335(14): 1022-1028.
6.CDC. MMWR Recomm Rep 2006 ; 55(RR-12): 1-13.
【利益相反】
1.2.3.4.5 利益相反の記載は無かった。
6.MSD社のKuter B、Heaton Pが本報告書の一部についてのレビューおよび寄稿を行った。