安全性:腸重積症
安全性:腸重積症
ロタテック®製品基本Q&Aへ
2つの米国の大規模製造販売後安全性調査(019試験及びVaccine Safety Datalink:VSDプロジェクト)において、本剤接種後7日間又は30日間に腸重積症のリスクの増加は認められなかった4),5)。オーストラリアでの製造販売後調査において、1~3ヵ月齢の乳児で、本剤の初回接種後、主に7日間又は21日間に腸重積症の発症リスクの増加が報告されている6)。米国でSelf-Controlled Risk Interval(SCRI)デザインを用いて実施された疫学研究にて本剤接種後の腸重積症発症リスクが検討され、初回接種後22日から42日の期間に対し、初回接種後7日間又は21日間のリスク比(95%信頼区間)は、それぞれ9.1(2.2, 39)、4.2(1.1, 16)であった。また、初回接種後7日間又は21日間の10万接種あたりの腸重積症の発症は、それぞれ1.12例(95%信頼区間:0.33, 2.70)、1.54例(95%信頼区間:0.19, 3.22)の増加を認めた7)。[8.4参照]
ロタテック®電子添文より
4)Loughlin J, et al. Pediatr Infect Dis J. 2012; 31(3): 292-6.
5)Shui IM, et al. JAMA. 2012; 307(6): 598-604.
6)Buttery JP, et al. Vaccine. 2011; 29(16): 3061-6.
7)Yih WK, et al. N Engl J Med. 2014; 370: 503-12.
 「ロタテック®内用液」接種後の腸重積症の報告例~発売10年間の報告データのご紹介~
「ロタテック®内用液」接種後の腸重積症の報告例~発売10年間の報告データのご紹介~
当データは販売開始から10年間に、MSD株式会社が自発報告および製造販売後調査の症例として収集した腸重積症のデータです。
販売開始からの10年間において、ロタテック®は約681万接種回分がMSD株式会社から特約店へ出荷され、腸重積症の報告は195例※1,2であり、ブライトン分類※3レベル1の診断確定例は160例でした。
ロタテック®が1人3回接種されたと仮定すると、推定接種者数は約227万人※4となり、この推定接種者数を用いると、初回接種後では10万人あたり3.3例、初回接種後0-6日以内では1.8例が腸重積症と報告されました。
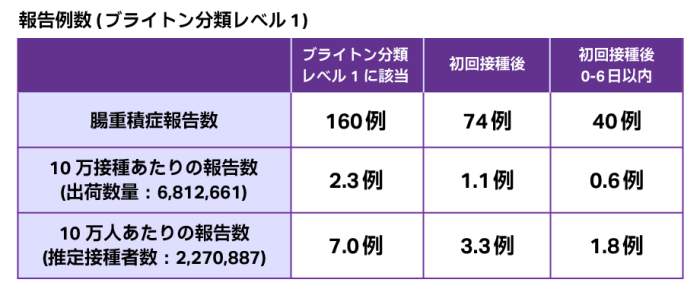
※1:因果関係が否定できる症例を除く
※2:自発報告は医療機関や規制当局から企業に報告されるものであり、報告バイアス(報告過多又は過小報告など)があります。よって、自発報告を元に算出された割合にはその精度に大きな制限があることに注意し、慎重に解釈する必要があります。
※3:ブライトン分類:予防接種後の副反応に関して、広く受け入れられる標準化された症例定義を作るために構成されたBrighton Collaboration(WHO やCDCのメンバーを含む)がまとめた“ブライトン標準化症例定義”の診断確実性レベルです。腸重積症では、3つのレベルに分類されており、レベル1 が最も診断確実性が高く、これらの定義を満たさない、もしくは情報不足で判断できない症例はレベル外としました。
※4:出荷数量から本ワクチンが1人3回接種されたと仮定し推計した数字であり、正確な接種者数ではありません。
対象期間:2012年7月20日~2022年6月30日
第85回厚生科学審議会 予防接種・ワクチン分科会 副反応検討部会(2022/10/7開催)資料2-21
ロタテック®内用液を接種した乳児における満1歳までの腸重積症の発症率を把握する目的で調査を実施しました。解析対象症例10,770例のうち13例(0.1%)に腸重積症(疑診を含む)が報告されました。対象症例の総観察期間※により算出した腸重積症の発現率は、159.1/10万人・年(95%CI:84.7~272. 0)でした。本調査におけるロタテック®接種後の腸重積症発現率は、国内における腸重積症の自然発症率に関するこれまでの報告と同様でした。
- 対象症例:ロタテック®の効能・効果を目的として、添付文書の用法・用量に従ってロタテック®の接種を新規に開始する乳児 10,770例
- 調査方法:プロスペクティブな連続調査方式
調査担当医師に当該医薬品の投与を開始する(または、開始した)症例を依頼症例数まで連続して(もれなく)調査票に記載してもらう方法 - 調査項目:被接種者背景情報(性別、生年月日など)、ロタテック®接種状況(本剤の接種回数、接種日)、満1歳までの観察の有無、観察期間中の腸重積症(疑診を含む)の発現有無
腸重積症(疑診を含む)を発現した場合:
症例背景の詳細、発現日、重篤性、処置、転帰、ブライトン分類に基づく診断確実性レベルと ロタテック®との因果関係の判定など - 観察期間:1回目接種日から、乳児が12カ月齢(満1歳)を超える日まで
結果
- 腸重積症の報告数:13例
- 発現率:159.1/10万人・年(95%CI:84.7~272.0)
※総観察期間は被接種者の初回接種日から満1歳までの日数の総計2,982,752日より算出
発現時期
| 初回接種後 | 2回目後 | 3回目後 |
| 2例※ | 1例 | 10例 |
※うち1例では、推奨接種時期を超えて(23週5日)で接種
接種後から発現までの日数
| 1週間以内 | 1カ月以内 | 1カ月以上 |
| 0例 | 2例 | 11例 |
転帰
- いずれの症例も調査担当医により重篤と判断されたが、回復(12例)または軽快(1例)
- 観血的整復:3例(いずれも3回目接種後3カ月以降の発現)
竹内紀子 他, Prog Med 2017;37(12):1493-1500.
【利益相反】本調査はMSD株式会社によって実施された。著者はすべてMSD株式会社の社員である。
国内での腸重積症の自然発生率1)
厚生労働科学研究班による全国9道県市での調査において、2007~2014年の国内の1歳未満の乳児における腸重積症の発生率は99.6/10万人・年(95%CI:93.6-105.9)と報告されています。
1)厚生労働科学研究班(研究代表者:大石和徳、研究分担者:砂川富正、研究協力者:神谷元、他)による全国9道県市での調査
予防接種・ワクチン分科会予防接種基本方針部会ワクチン評価に関する小委員会資料(2019年7月31日)
2. 接種不適当者(予防接種を受けることが適当でない者)の抜粋
2.4 腸重積症の既往のある者
2.5 腸重積症の発症を高める可能性のある未治療の先天性消化管障害(メッケル憩室等)を有する者
8. 重要な基本的注意の抜粋
8.4 被接種者の保護者に、本剤の接種後に腸重積症を示唆する症状(腹痛、反復性の嘔吐、血便排泄、腹部膨満感、高熱)を呈した場合には速やかに医師の診察を受けるよう事前に知らせること。2つの外国の大規模製造販売後調査では、本剤接種後7日間又は30日間に本剤と腸重積症の関連は認められなかったが、他の外国の製造販売後調査において、本剤の初回接種後、主に7日間又は21日間に腸重積症の発現リスクのわずかな増加が報告されている。[11.2、17.2.1参照]
11.副反応の抜粋
11.2 その他の副反応
胃腸障害(頻度不明):腸重積症注1)
注1)[ 8.4参照]
15. その他の注意の抜粋
15.1.3 本剤の腸重積症のリスクが外国で実施された大規模臨床試験(006試験:本剤群34,837例、プラセボ群34,788例)において検討されたが、プラセボ群と比較して腸重積症のリスクの増加は認められなかった。本試験では、接種後42日間に本剤群で6例、プラセボ群で5例[相対リスク(95%信頼区間):1.6(0.4, 6.4)]の腸重積症が発現した。初回接種後365日間では、本剤群で13例、プラセボ群で15例[相対リスク(95%信頼区間):0.9(0.4, 1.9)]の腸重積症が発現した。本剤接種後のいずれの期間においても、腸重積症の発現が著しく増加することはなかった。また、外国の大規模な医療費請求データベースを用いた本剤のプロスペクティブ市販後安全性観察研究においても、統計学的に有意な腸重積症の発症リスクの増加はなかった。本試験では、接種後30日間に本剤群で6例、他の既承認小児用ワクチン(DTaP:ジフテリアトキソイド、破傷風トキソイド及び沈降精製百日せきワクチン)群で5例[相対リスク(95%信頼区間):0.8(0.22,3.52)]の腸重積症が発現した。
17. 臨床成績の抜粋
17.2.1 腸重積症発症リスクに関する外国製造販売後調査及び疫学研究
2つの米国の大規模製造販売後安全性調査(019試験及びVaccine Safety Datalink:VSDプロジェクト)において、本剤接種後7日間又は30日間に腸重積症のリスクの増加は認められなかった4),5)。オーストラリアでの製造販売後調査において、1~3ヵ月齢の乳児で、本剤の初回接種後、主に7日間又は21日間に腸重積症の発症リスクの増加が報告されている6)。米国でSelf-Controlled Risk Interval(SCRI)デザインを用いて実施された疫学研究にて本剤接種後の腸重積症発症リスクが検討され、初回接種後22日から42日の期間に対し、初回接種後7日間又は21日間のリスク比(95%信頼区間)は、それぞれ9.1(2.2, 39)、4.2(1.1, 16)であった。また、初回接種後7日間又は21日間の10万接種あたりの腸重積症の発症は、それぞれ1.12例(95%信頼区間:0.33, 2.70)、1.54例(95%信頼区間:0.19, 3.22)の増加を認めた7)。[8.4参照]
ロタテック®電子添文より