DRIVE-AHEAD試験
本剤は海外での臨床試験成績をもとに承認されたため、国内での臨床試験は実施していません。
DRIVE-AHEAD試験で投与したドラビリン/ラミブジン/テノホビルジソプロキシルフマル酸塩の配合剤(DOR/3TC/TDF)※1及びエファビレンツ/エムトリシタビン/テノホビル ジソプロキシルフマル酸塩の配合剤(EFV/FTC/TDF)※2は、いずれも国内未承認薬ですが、承認時評価資料であることからデータを掲載しています。これらの各成分の国内承認用法及び用量については本ページ注釈又は各製品電子添文をご参照ください。
DRIVE-AHEAD試験
治療未経験のHIV-1感染症患者を対象とした海外第Ⅲ相二重盲検比較試験(海外データ)1)2)
1) Orkin C, et al. Clin Infect Dis 2019; 68(4): 535-544
(利益相反:Merck & Co., Inc., Rahway, N.J., U.S.A.が資金提供。共著者のLupinacci、Rodgers、Xu、Lin、Kumar、
Sklar、Nguyen、Hanna、Hwang、MartinはMerck & Co., Inc., Rahway, N.J., U.S.A.の社員。)
2) 承認時評価資料(海外第Ⅲ相試験:DRIVE-AHEAD試験)
[目的]
治療未経験のHIV-1感染症患者を対象に、DOR/3TC/TDF※1の有効性を、EFV/FTC/TDF※2と比較検証し、あわせて安全性を検討する。
[試験デザイン]
多施設共同、無作為化、二重盲検、実薬対照第Ⅲ相、非劣性検証試験

[対象]
治療未経験の18歳以上のHIV-1感染症患者(HIV-1 RNA量≥1,000copies/mL)728例(試験薬投与例)
[方法]
対象患者を、スクリーニング時のHIV-1 RNA量(≤100,000copies/mL vs >100,000copies/mL)及びB型又はC型肝炎感染の有無で層別し、DOR/3TC/TDF群又はEFV/FTC/TDF群に無作為に割付け、96週間治療を行った。
[評価項目]
主要評価項目:48週時におけるHIV-1 RNA量<50copies/mLの患者の割合
副次評価項目:96週時におけるHIV-1 RNA量<50copies/mLの患者の割合
48週時及び96週時におけるHIV-1 RNA量<40copies/mLの患者の割合
48週時及び96週時におけるCD4陽性リンパ球数のベースラインからの変化量 等
探索的評価項目:HIV-1 RNA量<200copies/mLの患者の割合、抗ウイルス薬耐性の発現 等
安全性評価項目:副作用、48週時におけるLDLコレステロール及びNon-HDLコレステロールのベースラインからの変化量 等
[解析計画]
有効率の群間差の95%信頼区間(95%CI)は、各層で投与群あたりの症例数の調和平均により重み付けした差を用いた層補正Mantel-Haenszel法により算出した。CD4陽性リンパ球数の平均変化量の差の95%CIは、t分布に基づいて求めた。
主要評価項目について、群間差(DOR/3TC/TDF群-EFV/FTC/TDF群)の95%CIの下限値が-10%を上回る場合に、EFV/FTC/TDF群に対するDOR/3TC/TDF群の非劣性が検証されるとした。主要評価項目について、ベースライン時のHIV-1 RNA量(>100,000又は≤100,000copies/mL)別にサブグループ解析を実施した。また、その他のベースライン時の患者背景因子別にサブグループ解析を実施した。
※1:EFV/FTC/TDFは、エファビレンツ600mg/エムトリシタビン200mg/テノホビル ジソプロキシルフマル酸塩300mgを含有する製剤で、国内未承認です。
各成分の国内承認用法及び用量(各製品電子添文より):
・エファビレンツ:通常、成人にはエファビレンツとして600mgを1日1回経口投与する。本剤は、食事の有無にかかわらず投与できる。なお、投与に際しては必ず他の抗HIV薬と併用すること。
・エムトリシタビン:通常、成人にはエムトリシタビンとして1回200mgを1日1回経口投与する。なお、投与に際しては必ず他の抗HIV薬と併用すること。
・テノホビル ジソプロキシルフマル酸塩:通常、成人にはテノホビル ジソプロキシルフマル酸塩として1回300mg(テノホビル ジソプロキシルとして245mg)を1日1回経口投与する。なお、投与に際しては必ず他の抗HIV薬と併用すること。
※2:DOR/3TC/TDFは、ドラビリン100mg/ラミブジン300mg/テノホビル ジソプロキシルフマル酸塩300mgを含有する製剤で、国内未承認です。
各成分の国内承認用法及び用量(各製品電子添文より):
・ドラビリン:通常、成人にはドラビリンとして100mgを1日1回経口投与する。本剤は、食事の有無にかかわらず投与できる。投与に際しては、必ず他の抗HIV薬と併用すること。
・ラミブジン:通常、成人には他の抗HIV薬と併用して、ラミブジンとして1日量300mgを1日1回又は2回(150mg×2)に分けて経口投与する。なお、年齢、体重、症状により適宜増減する。
・テノホビル ジソプロキシルフマル酸塩:通常、成人にはテノホビル ジソプロキシルフマル酸塩として1回300mg(テノホビル ジソプロキシルとして245mg)を1日1回経口投与する。なお、投与に際しては必ず他の抗HIV薬と併用すること。
有効性
■抗ウイルス効果
主要評価項目である48週時におけるHIV-1 RNA量<50copies/mLを達成した患者の割合(検証的解析項目)が、DOR/3TC/TDF※2群84.3%、EFV/FTC/TDF群80.8%であり、群間差3.5%(95%CI:-2.0, 9.0、Mantel-Haenszel法)の95%CIの下限値が-2.0と-10%を上回ったため、DOR/3TC/TDF群のEFV/FTC/TDF群に対する非劣性が検証されました。
HIV-1 RNA量<50copies/mLを達成した患者の割合の推移a(主要評価項目[検証的解析項目]:48週時) 1)2)
![HIV-1 RNA量<50copies/mLを達成した患者の割合の推移a(主要評価項目[検証的解析項目]:48週時)](https://www.msdconnect.jp/wp-content/uploads/sites/5/2021/02/pifeltro_drive-ahead_fig02.png)
a:FDA Snapshot法:理由を問わず、試験の中止を含めて全てのデータ欠損を治療失敗として扱った。
b:群間差の95%CIは、各層で投与群当たりの症例数の調和平均により重み付けした差を用いた層補正Mantel-Haenszel法により算出した。群間差(DOR/3TC/TDF群-EFV/FTC/TDF群)の95%CIの下限値が-10%を上回る場合に、EFV/FTC/TDF群に対するDOR/3TC/TDF群の非劣性が検証されるとした。
DOR/3TC/TDF群は、ベースライン時のHIV-1 RNA量にかかわらず、抗ウイルス効果を示しました。
48週時におけるHIV-1 RNA量<50copies/mLを達成した患者の割合a(主要評価項目のサブグループ解析) 1)
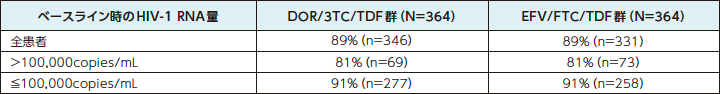
a:Observed Failure法:効果不十分のために試験薬投与を早期に中止し、欠測値[投与期間中に断続的に生じる欠測値を除く]のある症例を治療失敗例として扱った。
n:各カテゴリーに該当した患者数
■抗ウイルス効果及び免疫学的効果
DOR/3TC/TDF群の48週時及び96週時における抗ウイルス効果及び免疫学的効果は、以下のとおりでした。
48週時及び96週時の抗ウイルス効果及び免疫学的効果2)
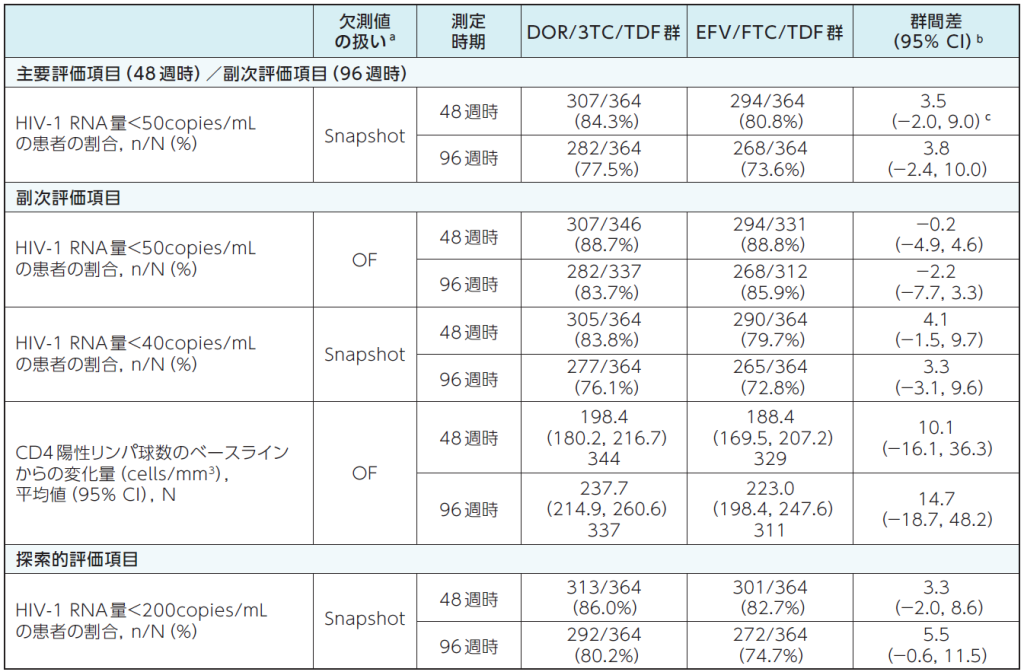
a:Snapshot:FDA Snapshot法:理由を問わず、試験の中止を含めて全てのデータ欠損を治療失敗として扱った。
OF:Observed Failure法:効果不十分のために試験薬投与を早期に中止し、欠測値(投与期間中に断続的に生じる欠測値を除く)のある症例を治療失敗例として扱った。
b:群間差の95%CIは各層で投与群当たりの症例数の調和平均により重み付けした差を用いた層補正Mantel-Haenszel法により算出した。CD4陽性リンパ球数の平均変化量の差の95%CIは、t分布に基づいて求めた。
c:群間差(DOR/3TC/TDF群-EFV/FTC/TDF群)の95%CIの下限値が-10%を上回る場合に、EFV/FTC/TDF群に対するDOR/3TC/TDF群の非劣性が検証されるとした。
安全性
■ 副作用
96週までの副作用発現率は、DOR/3TC/TDF 群で31.9%(116/364例)、EFV/FTC/TDF群で64.8%(236/364例)でした。
DOR/3TC/TDF群の主な副作用は、浮動性めまい25例(6.9%)、悪心18例(4.9%)及び異常な夢18例 (4.9%)でした。 EFV/FTC/TDF群の主な副作用は、浮動性めまい117例(32.1%)、異常な夢37例(10.2%)及び発疹31例 (8.5%)でした。
試験薬と関連のある死亡は、両群ともに認められませんでした。
重篤な副作用は、DOR/3TC/TDF群で無力症、不眠症及び悪夢が各1件1例、EFV/FTC/TDF群で高トリグリセリド血症、全身性皮疹、斑状皮疹、斑状丘疹状皮疹が各1例の計4例でした。
試験薬の投与中止に至った副作用は、DOR/3TC/TDF群の8例で脱毛症、疲労、注意力障害、うつ病、上腹部痛、 適応障害、嘔吐、無力症、不眠症、悪夢、腎障害及びビタミンD欠乏が各1件、EFV/FTC/TDF群の24例で全身性皮疹3件、発疹3件、浮動性めまい、不安が各2件、多形紅斑、紅斑性皮疹、不眠症、神経毒性、注意力障害、 そう痒性皮疹、斑状皮疹、うつ病、疲労、異常な夢、下腹部痛、悪心、抑うつ気分、睡眠障害、斑状丘疹状皮疹、頭痛、 傾眠、パーソナリティ障害及び薬物過敏症が各1件でした。
■〔参考情報〕脂質プロファイルへの影響
48週時におけるLDLコレステロール及びNon-HDLコレステロールのベースラインからの変化量は、DOR/3TC/TDF群で-1.6mg/dL及び-3.8mg/dL、EFV/FTC/TDF群でそれぞれ8.7mg/dL及び13.3mg/dLでした。
48週時における空腹時脂質のベースラインからの変化量2)
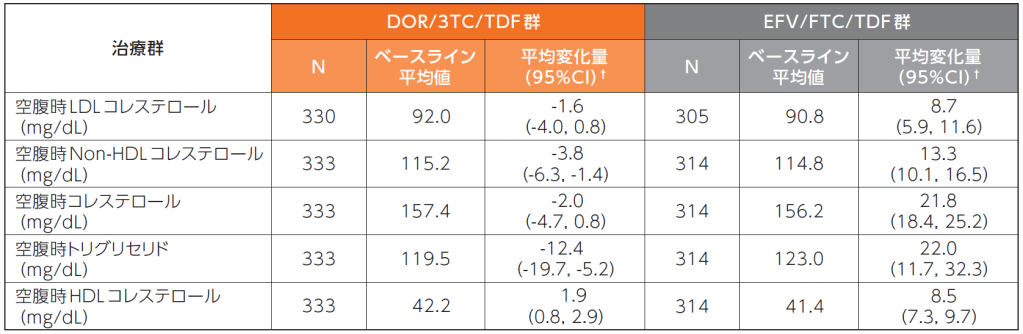
欠測値は、Last Observation Carried Forward(LOCF)法を用いて補完した。
†:群内の95%CIはt分布に基づいた。
ベースライン後データは、試験薬の投与開始から最終投与の14日後までの測定結果を対象とした。
N :ベースライン後の検査結果が1つ以上得られた患者の数