【胃癌】HER2陽性*の治癒切除不能な進行・再発胃癌の1次治療におけるキイトルーダ®+トラスツズマブ+化学療法の有効性・安全性ー国際共同第Ⅲ相試験 KEYNOTE-811試験ー
2025年5⽉、キイトルーダ®は、胃癌の1次治療において免疫チェックポイント阻害剤としては初めて、HER2陽性*・陰性に関わらず「治癒切除不能な進行・再発胃癌」 […]
承認時評価資料:国際共同第Ⅲ相試験(KEYNOTE-859試験)
OS中央値はキイトルーダ®+化学療法群で16.8ヵ月(95%CI: 11.7, 25.2)、化学療法群で13.3ヵ月(95%CI: 10.3, 15.8)でした。化学療法群に対するキイトルーダ®+化学療法群のOSのハザード比は0.71(95%CI: 0.44, 1.13)でした。
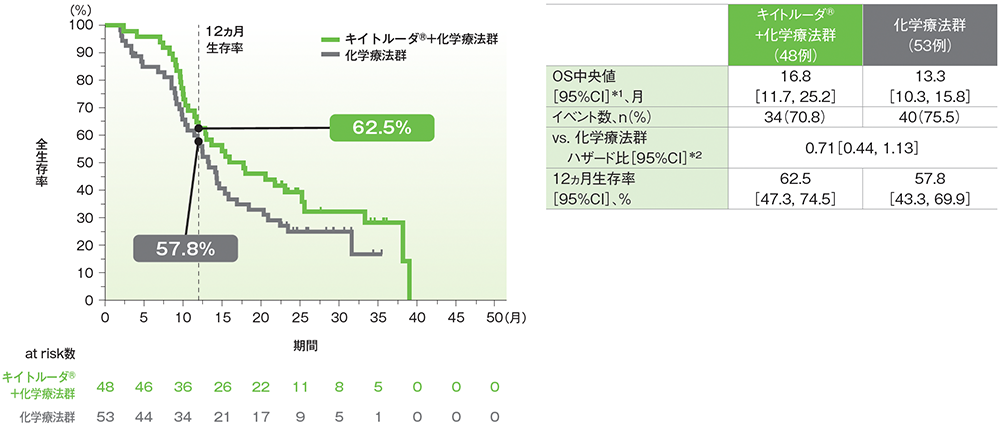
日本人ITT集団の追跡期間中央値:キイトルーダ®+化学療法群16.8ヵ月、化学療法群13.3ヵ月
データカットオフ日:2022年10月3日
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量としたCox比例ハザードモデルに基づいてハザード比を推定した
PFS中央値はキイトルーダ®+化学療法群で6.8ヵ月(95%CI: 4.0, 9.7)、化学療法群で6.7ヵ月(95%CI: 4.4, 7.0)でした。化学療法群に対するキイトルーダ®+化学療法群のPFSのハザード比は0.82(95%CI: 0.49, 1.36)でした。
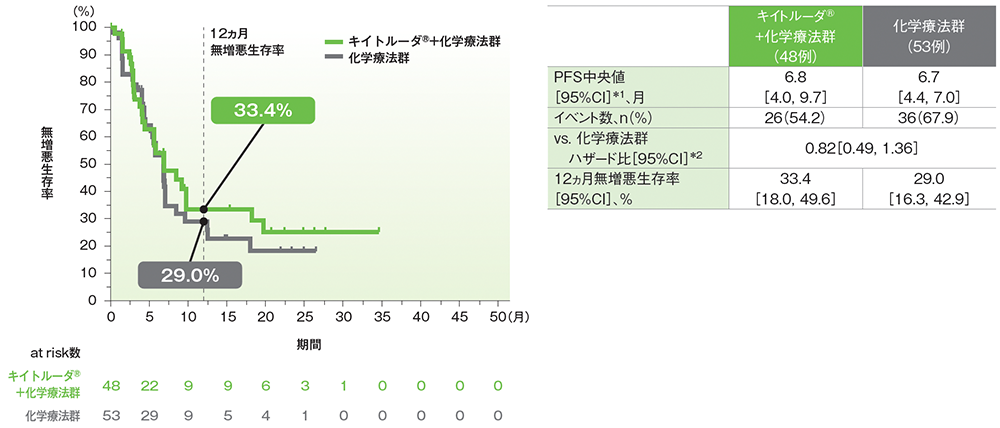
日本人ITT集団の追跡期間中央値:キイトルーダ®+化学療法群16.8ヵ月、化学療法群13.3ヵ月
データカットオフ日:2022年10月3日
RECIST 1.1に基づくBICR判定による評価
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量としたCox比例ハザードモデルに基づいてハザード比を推定した
ORRはキイトルーダ®+化学療法群で54.2%(95%CI: 39.2, 68.6)、化学療法群で56.6%(95%CI: 42.3, 70.2)でした。
■奏効率(ORR: CR+PR)及び最良総合効果
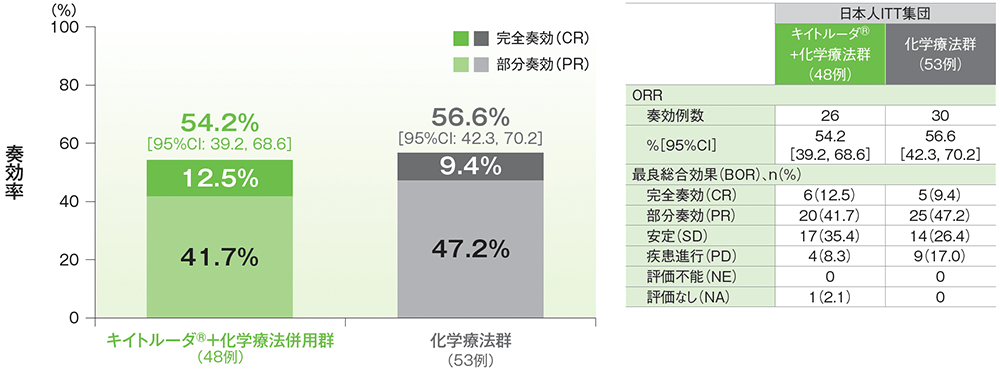
日本人ITT集団の追跡期間中央値:キイトルーダ®+化学療法群16.8ヵ月、化学療法群13.3ヵ月
データカットオフ日:2022年10月3日
RECIST 1.1に基づくBICR判定による評価
DOR中央値*1はキイトルーダ®+化学療法群で18.4ヵ月(範囲*2: 1.2+, 33.1+)、化学療法群で5.4ヵ月(範囲: 2.0+, 23.5+)でした。
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 「+」は最後の疾患評価までPDがみられなかったことを示す
■日本人ITT集団における奏効期間(DOR)のKaplan-Meier曲線
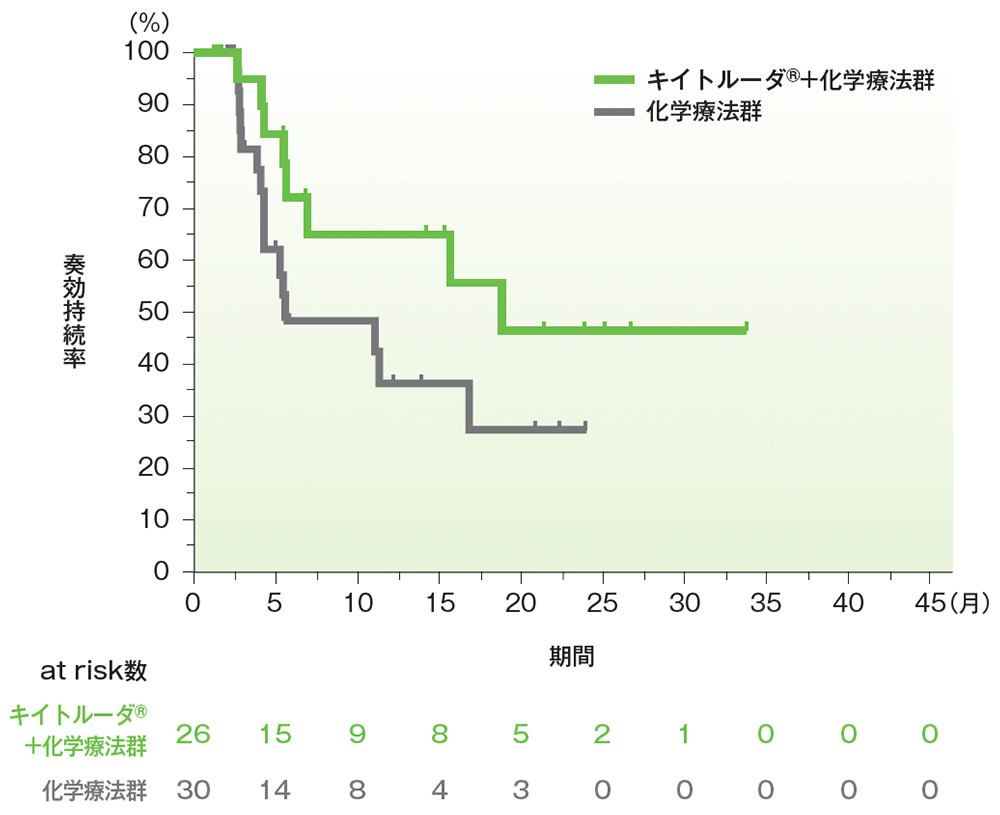
日本人ITT集団の追跡期間中央値:キイトルーダ®+化学療法群16.8ヵ月、化学療法群13.3ヵ月
データカットオフ日:2022年10月3日
RECIST 1.1に基づくBICR判定による評価
キイトルーダ®+化学療法群の副作用は48/48例(100.0%)に認められました。主な副作用(発現率20%以上)は、末梢性感覚ニューロパチー35例(72.9%)、好中球数減少21例(43.8%)、食欲減退19例(39.6%)、手掌・足底発赤知覚不全症候群18例(37.5%)、下痢、悪心 各17例(35.4%)、味覚不全15例(31.3%)、血小板数減少14例(29.2%)、倦怠感12例(25.0%)でした。
重篤な副作用は14例(29.2%)に認められました。2例以上にみられた重篤な副作用は、副腎機能不全、腸炎 各2例(4.2%)でした。
いずれかの治験薬で投与中止に至った副作用は、12例(25.0%)に認められました。2例以上にみられた投与中止に至った副作用は、末梢性感覚ニューロパチー4例(8.3%)、末梢性ニューロパチー、好中球数減少 各2例(4.2%)でした。
死亡に至った副作用は認められませんでした。
MedDRA/J v25.0
データカットオフ日:2022年10月3日
化学療法群の副作用は53/53例(100.0%)に認められました。主な副作用(発現率20%以上)は、末梢性感覚ニューロパチー39例(73.6%)、好中球数減少31例(58.5%)、手掌・足底発赤知覚不全症候群26例(49.1%)、食欲減退24例(45.3%)、悪心22例(41.5%)、倦怠感17例(32.1%)、血小板数減少15例(28.3%)、下痢、味覚不全 各14例(26.4%)でした。
重篤な副作用は9例(17.0%)に認められました。2例以上にみられた重篤な副作用は、食欲減退3例(5.7%)でした。
いずれかの治験薬で投与中止に至った副作用は、13例(24.5%)に認められました。2例以上にみられた投与中止に至った副作用は、末梢性感覚ニューロパチー5例(9.4%)、好中球数減少2例(3.8%)でした。
死亡に至った副作用は認められませんでした。
MedDRA/J v25.0
データカットオフ日:2022年10月3日
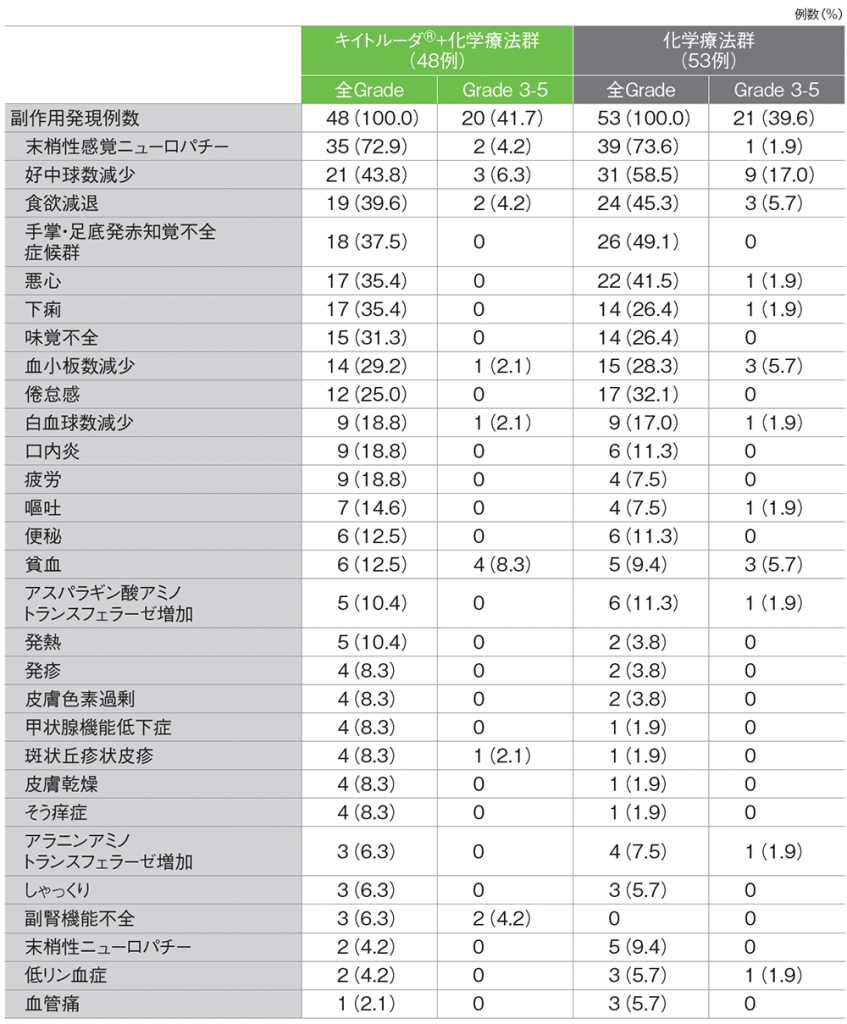
MedDRA/J v25.0、GradeはCTCAE v4.03
データカットオフ日:2022年10月3日
キイトルーダ®+化学療法群
キイトルーダ®+化学療法群の免疫関連など特に注目すべき有害事象は16/48例(33.3%)に認められ、発現率が3%以上であった免疫関連など特に注目すべき有害事象は、甲状腺機能低下症4例(8.3%)、副腎機能不全、大腸炎、Infusion Reactions、肺臓炎、重度の皮膚反応 各3例(6.3%)、下垂体炎2例(4.2%)でした。
MedDRA/J v25.0
データカットオフ日:2022年10月3日
化学療法群
化学療法群の免疫関連など特に注目すべき有害事象は5/53例(9.4%)に認められ、発現率が3%以上であった免疫関連など特に注目すべき有害事象は、肺臓炎2例(3.8%)でした。
MedDRA/J v25.0
データカットオフ日:2022年10月3日

2025年5⽉、キイトルーダ®は、胃癌の1次治療において免疫チェックポイント阻害剤としては初めて、HER2陽性*・陰性に関わらず「治癒切除不能な進行・再発胃癌」 […]

キイトルーダ®は2025年5月より、HER2陽性*・陰性に関わらず「治癒切除不能な進行・再発胃癌」患者の1次治療に対して投与が可能となりました。 本動画では、P […]


WEB講演会にアクセスし「このページは閲覧を制限しています」と表示された方は こちら>>
このサイトでは、医療用医薬品を適正にご使用いただくため、医師、歯科医師及び薬剤師などの医療関係者の方を対象に、主としてMSD株式会社の医療用医薬品に関する情報を提供しています。
下記の「はい」をクリックした場合、「MSD Connect ご利用規約」及び「ウェブサイトのご利用条件」を理解したうえで、内容に同意したものとみなします。
2024年11月にご利用規約を改訂致しました。上記リンクよりご確認ください。
あなたは医療関係者ですか?