使用成績調査
使用成績調査1)、2)
1)アイセントレス®錠400mg 再審査報告書(2019年12月19日)
2)Kuroishi N, et al. PLoS ONE 2019;14(1):236-248.(利益相反:MSD K.K., Tokyo, Japanが本研究に資金提供。Kuroishi、Watanabe、Ruzicka、Sakuma、HaraはMSD K.K., Tokyo, Japan元従業員。)
[目 的]
アイセントレス®錠400mgを投与されたHIV感染者を対象に、以下の事項を把握する。
(1) 未知の副作用(特に重要な副作用について)
(2) 医薬品の使用実態下における副作用の発生状況の把握
(3) 安全性、有効性等に影響を与えると考えられる要因
[対 象]
2008 年7月から2017年3月までに新たにアイセントレス® 錠400mgの投与を受けた日本人HIV感染者1,430例
安全性解析対象:1,420例
有効性解析対象:1,055例
[方 法]
全例調査方式
HIV 感染症治療薬製造・販売会社が共同で実施する製造販売後調査(HRD共同調査)の対象である33施設で全例調査を行った。
[評価項目]
安全性:投与期間中の有害事象 など
有効性:投与開始時及び投与期間中のHIV-1 RNA量(Log10 copies/mL)、 HIV-1 RNA量が50copies/mL未満の患者の割合、 CD4陽性リンパ球数
[解析計画]
各評価項目について、結果を記述的に要約した。
[安全性]
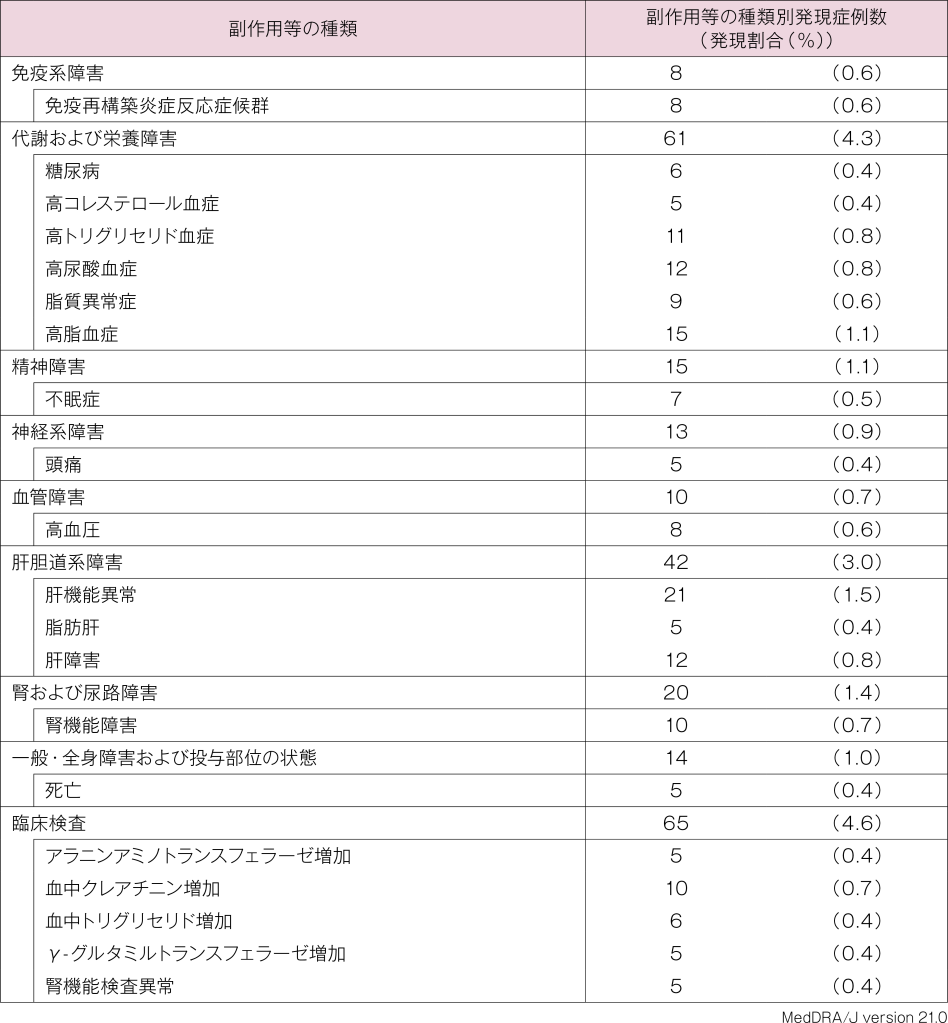
安全性解析対象1,420例中260例(18.3%)に415件の副作用が認められました。主な副作用(発現頻度1%以上)は、肝機能異常21件(1.5%)、高脂血症15件(1.1%)でした。再審査報告書に死亡例を含む重篤な副作用、 投与中止に至った副作用に関する記載はありませんでした。 本剤投与開始からの期間が「90日未満」、「90日以上180日未満」、「180日以上270日未満」、「270日以上 365日未満」及び「1年以上2年未満」における副作用発現割合はそれぞれ6.6%( 93/1,419例)、2.1%(28/1,345例)、1.8%(23/1,297例)、1.4%(17/1,239例)及び4.1%(49/1,186例)でした。
使用成績調査:主な副作用
[有効性]
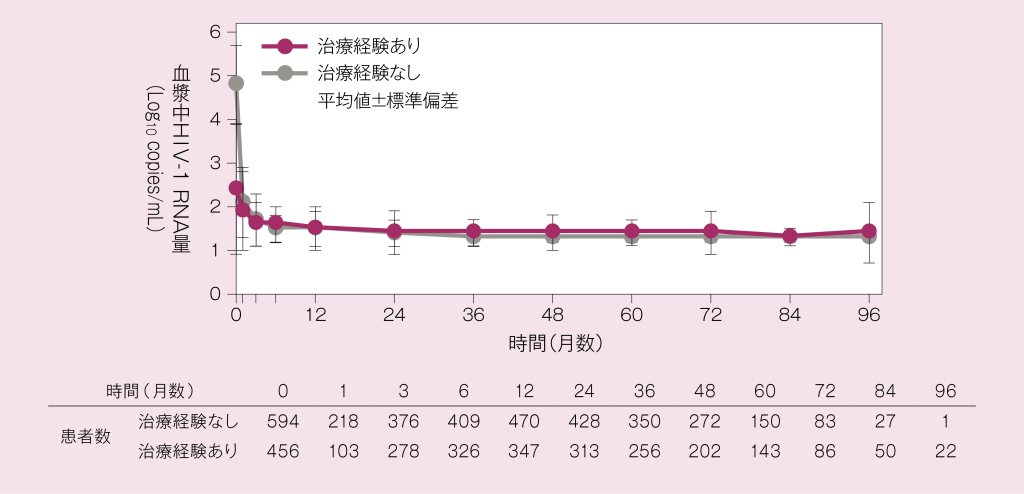
投与開始時及び投与期間中のHIV-1 RNA量は、未治療群と既治療群のそれぞれにおいて以下のように推移しました。
使用成績調査:HIV-1 RNA量の推移
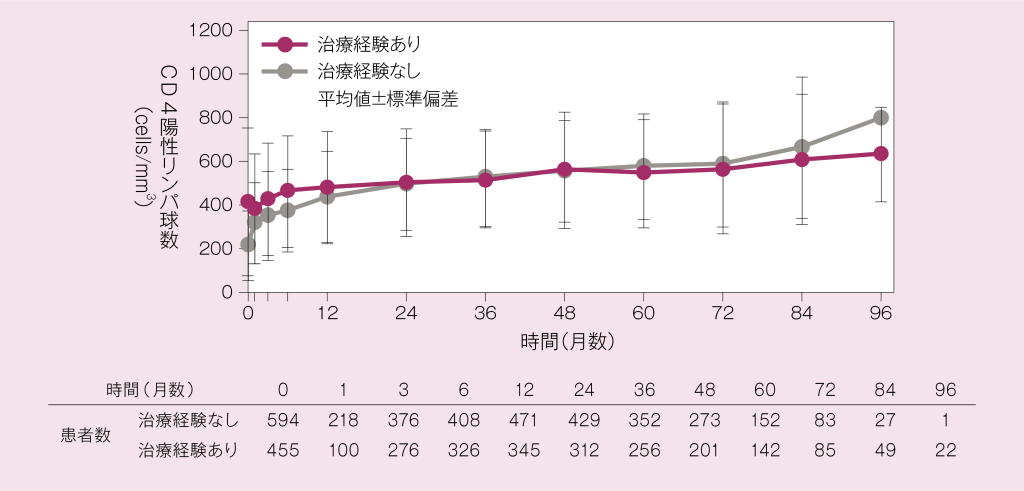
投与開始時及び投与期間中のCD4陽性リンパ球数は、未治療群と既治療群のそれぞれにおいて以下のように推移しました。
使用成績調査:CD4陽性リンパ球数の推移