薬物動態
薬物動態
1. 血中濃度
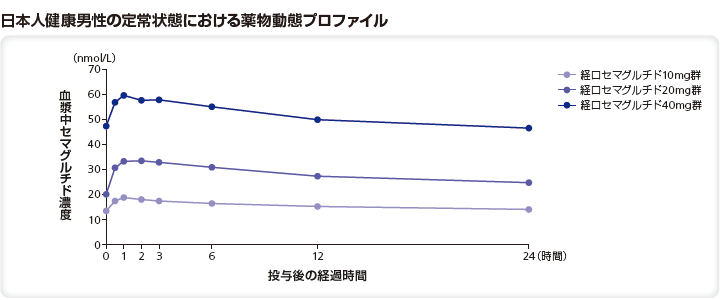
(1)健康成人における反復投与後の薬物動態(日本人及び外国人データ)1)
社内資料:リベルサス®錠 第1相臨床試験(NN9924-4140)(承認時評価資料)
対象:日本人及びコーカシアン健康成人男性48例(日本人24例、コーカシアン24例)
方法:1施設、反復投与、無作為割り付け、二重盲検、プラセボ対照、並行群間比較試験。SNACを含有する経口セマグルチド投与もしくはプラセボ投与に3:1の割合で無作為に割り付けた。経口セマグルチドは5mgから投与を開始し、その後「第1投与期間(Day 8~35)」では10mg、「第2投与期間(Day 36~63)」では20mg、「第3投与期間(Day 64~91)」では40mgを6時間以上の絶食及び2時間以上の絶飲後120mLの水で1日1回投与(投与後30分間絶食)した。
日本人健康男性17例に、経口セマグルチド各用量を28日間反復経口投与したときのセマグルチドの曝露量は、以下の通りであった。

(2)2型糖尿病患者における反復投与後の薬物動態(日本人及び外国人データ)2)
社内資料:リベルサス®錠薬物動態(6つの第3相臨床試験に基づく母集団薬物動態解析)(承認時評価資料)
対象:日本人及び外国人2型糖尿病患者2,431例(日本人531例)
方法:6つの第3相臨床試験(PIONEER 1/2/3/5/8/9)で得られたスパースサンプリングによる薬物動態データ(日本人531例を含む2,431例)に基づき、母集団薬物動態モデルを構築し、リベルサス®を投与した日本人2型糖尿病患者のシミュレーションに基づく薬物動態プロファイルを検討した。なお、各試験において、リベルサス®は空腹状態でその日の最初の食事の30分以上前に、コップ半分以下の水とともに1日1回服用するように説明された。
2型糖尿病患者を対象とした母集団薬物動態解析の結果、日本人患者におけるリベルサス®3mg、7mg及び14mgの1日1回経口投与後の定常状態の平均セマグルチド濃度は、それぞれ約3.6nmol/L、約8.4nmol/L及び約16.7nmol/Lと推定された。
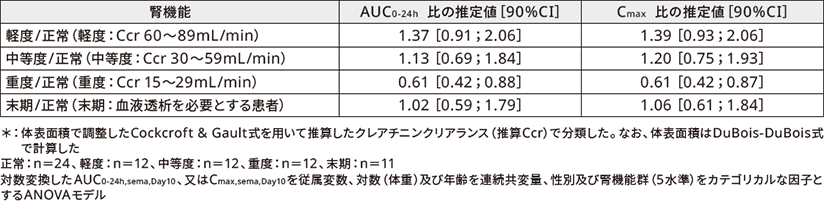
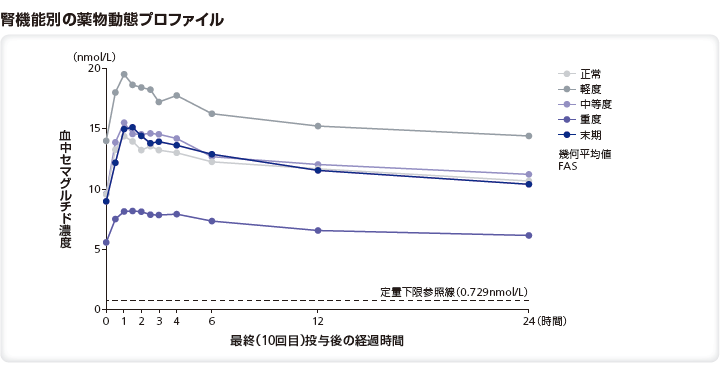
(3)腎機能障害患者における薬物動態(外国人データ)3)
社内資料:リベルサス®錠 第1相臨床試験(NN9924-4079)(承認時参考資料)
Granhall C et al.:Clin Pharmacokinet 57(12):1571-1580, 2018
本試験はノボ ノルディスク社のスポンサーシップにより実施された。
対象:正常な腎機能を有する者、又は、異なる程度の腎機能障害(軽度、中等度、重度、末期)を有する者71例
方法:多国籍、多施設共同、非盲検、反復投与、並行群間試験。SNACを含有する経口セマグルチドを10日間投与し(5mgを5日間投与後、10mgを5日間投与)、セマグルチドの曝露量などを検討した。
正常な腎機能を有する者、又は、異なる程度の腎機能障害を有する者(推算Ccr*による分類)に経口セマグルチドを10日間経口投与したときのAUC0-24h及びCmaxの比の推定値は以下の通りであった。
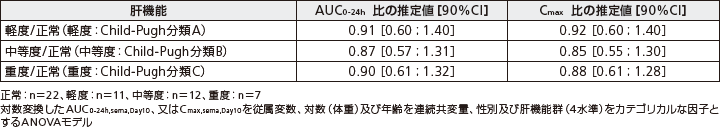
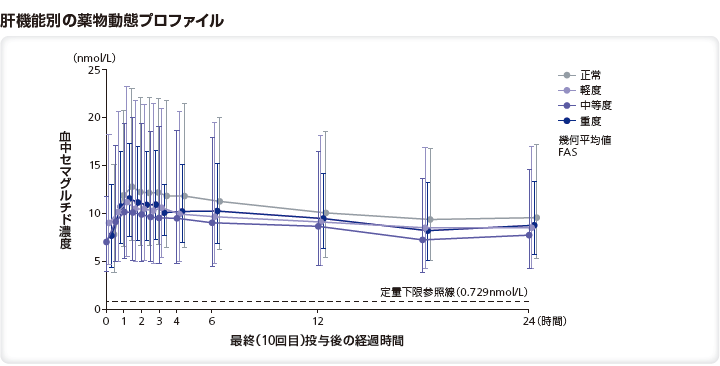
(4)肝機能障害患者における薬物動態(外国人データ)4)
社内資料:リベルサス®錠 第1相臨床試験(NN9924-4082)(承認時参考資料)
Bækdal TA et al.:J Clin Pharmacol 58(10):1314-1323, 2018
本試験はノボ ノルディスク社のスポンサーシップにより実施された。
対象:正常な肝機能を有する者、又は、異なる程度の肝機能障害(軽度、中等度、重度)を有する者56例
方法:多国籍、多施設共同、非盲検、反復投与、並行群間試験。SNACを含有する経口セマグルチドを10日間投与し(5mgを5日間投与後、10mgを5日間投与)、セマグルチド及びSNACの曝露量などを検討した。
正常な肝機能を有する者、又は、異なる程度の肝機能障害を有する者(Child-Pugh scoresに基づく分類)に経口セマグルチドを10日間経口投与したときのAUC0-24h及びCmaxの比の推定値は以下の通りであった。
2. 吸収/分布/代謝/排泄
吸収(外国人データ)5-8)
(1)バイオアベイラビリティ
経口セマグルチドは、セマグルチドの吸収を促進するサルカプロザートナトリウムを含有している。経口投与後にセマグルチドは主に胃で吸収される。経口セマグルチドを食事又は他の錠剤と同時に服用した場合にはセマグルチドの吸収は低下する。また、飲水量、経口セマグルチド服用後の絶食時間及びサルカプロザートナトリウムの投与量もセマグルチドの吸収に影響を及ぼす。
母集団薬物動態解析の結果に基づき、経口投与後のセマグルチドの絶対的バイオアベイラビリティは約1%と推定された。
(2)食事の影響
健康者を対象に、1日1回経口セマグルチド5mgを5日間投与後に経口セマグルチド10mgを5日間反復経口投与したときのセマグルチドの曝露量は絶食下投与では以下の通りであった。一方、食後投与した26例中14例ではいずれの時点でも定量下限を超える濃度は認められなかった。

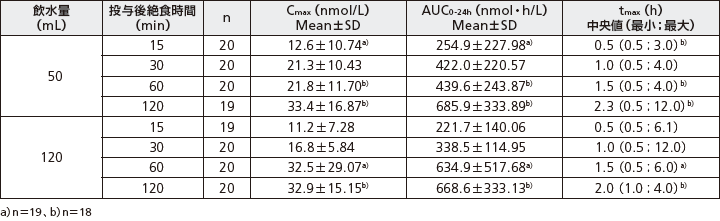
(3)絶食時間及び飲水量の影響
健康男性を対象に、1日1回経口セマグルチド10mgを10日間反復経口投与したときのセマグルチドの曝露量は投与後絶食時間、飲水量別では以下の通りであった。
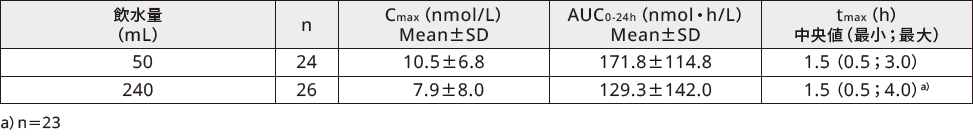
健康男性を対象に、経口セマグルチド10mgを単回経口投与(投与後4時間絶食、投与2時間後に水200mLを飲水)したときのセマグルチドの曝露量は、飲水量別では以下の通りであった。
分布(外国人データ及びin vitro)9) 10)
2型糖尿病患者における分布容積は約8Lと推定された。
セマグルチドの血漿中のアルブミンに対するin vitro 結合率は99%超であった。
代謝(外国人データ及びin vitro)11-13)
3Hでラベル化したセマグルチド0.5mgを健康男性7例に単回皮下投与した結果、セマグルチドはペプチド骨格のタンパク質分解及び脂肪酸側鎖のβ酸化により代謝されると推定された。
セマグルチドは、CYP分子種に対し、誘導(CYP1A2、CYP2B6及びCYP3A4/5)あるいは阻害作用(CYP1A2、CYP2B6、CYP2C8、CYP2C9、CYP2C19、CYP2D6及びCYP3A4/5)を示さなかった。
排泄(外国人データ及びin vitro)11) 14)
3Hでラベル化したセマグルチド0.5mgを健康男性7例に単回皮下投与した結果、最大56日までの総投与放射能に対する尿中及び糞中の放射能排泄率は53.0%及び18.6%であった。総投与放射能のうち、セマグルチド未変化体の尿中放射能排泄率は3.12%であった。
また、セマグルチドは、ヒトトランスポーター(P-gp、BCRP、OATP1B1、OATP1B3、OAT1、OAT3及びOCT2)に対し、阻害作用を示さなかった。
4. 効能又は効果
2型糖尿病
5. 効能又は効果に関連する注意
本剤の適用は、あらかじめ糖尿病治療の基本である食事療法、運動療法を十分に行ったうえで効果が不十分な場合に限り考慮すること。
6. 用法及び用量
通常、成人には、セマグルチド(遺伝子組換え)として1日1回7mgを維持用量とし経口投与する。ただし、1日1回3mgから開始し、4週間以上投与した後、1日1回7mgに増量する。なお、患者の状態に応じて適宜増減するが、1日1回7mgを4週間以上投与しても効果不十分な場合には、1日1回14mgに増量することができる。
7. 用法及び用量に関連する注意(抜粋)
7.1 本剤の吸収は胃の内容物により低下することから、本剤は、1日のうちの最初の食事又は飲水の前に、空腹の状態でコップ約半分の水(約120mL以下)とともに3mg錠、7mg錠又は14mg錠を1錠服用すること。また、服用時及び服用後少なくとも30分は、飲食及び他の薬剤の経口摂取を避けること。分割・粉砕及びかみ砕いて服用してはならない。[電子添文16.2.1-16.2.3参照]
AUC:血漿中濃度-時間曲線下面積 Cmax:最高血漿中濃度 CI:信頼区間 CV%:変動係数(%) FAS:最大の解析対象集団 SNAC:サルカプロザートナトリウム tmax:最高血漿中濃度到達までの時間
【参考文献】
- 社内資料:リベルサス®錠 第1相臨床試験(NN9924-4140)(承認時評価資料)
- 社内資料:リベルサス®錠薬物動態(6つの第3相臨床試験に基づく母集団薬物動態解析)(承認時評価資料)
- 社内資料:リベルサス®錠 第1相臨床試験(NN9924-4079)(承認時参考資料)
Granhall C et al.:Clin Pharmacokinet 57(12):1571-1580, 2018 - 社内資料:リベルサス®錠 第1相臨床試験(NN9924-4082)(承認時参考資料)
Bækdal TA et al.:J Clin Pharmacol 58(10):1314-1323, 2018 - 社内資料:リベルサス®錠薬物動態(6つの臨床薬理試験に基づく母集団薬物動態解析)(承認時評価資料)
- 社内資料:リベルサス®錠 第1相臨床試験(NN9924-4154)(承認時参考資料)
- 社内資料:リベルサス®錠 第1相臨床試験(NN9924-3794)(承認時参考資料)
Bækdal TA et al.:Diabetes Ther 12(7):1915-1927, 2021 - 社内資料:リベルサス®錠 第1相臨床試験(NN9924-3957)(承認時参考資料)
Bækdal TA et al.:Clin Pharmacol Drug Dev 10(5):453-462, 2021 - Marbury TC et al.:Clin Pharmacokinet 56(11):1381-1390, 2017
- Jensen L et al.:Diabetes Obes Metab 20(4):998-1005, 2018
- Jensen L et al.:Eur J Pharm Sci 104:31-41, 2017
- 社内資料:オゼンピック®皮下注 ヒト肝細胞を用いた in vitro 薬物動態学的相互作用試験(215048):承認時参考資料
- 社内資料:オゼンピック®皮下注 凍結ヒト肝細胞を用いた in vitro 薬物動態学的相互作用試験(214196):承認時参考資料
- 社内資料:オゼンピック®皮下注 ヒト肝細胞を用いた in vitro 薬物動態学的相互作用試験(215026):承認時参考資料