PIONEER 10:デュラグルチドとの比較検討試験
国内第3相臨床試験:PIONEER 10
日本人2型糖尿病患者を対象とした、経口糖尿病薬併用、デュラグルチドとの比較検討試験
社内資料:リベルサス®錠 第3相臨床試験(NN9924-4282)(承認時評価資料)
Yabe D et al.:Lancet Diabetes Endocrinol 8(5):392-406, 2020
本試験はノボ ノルディスク社のスポンサーシップにより実施された。
■試験概要

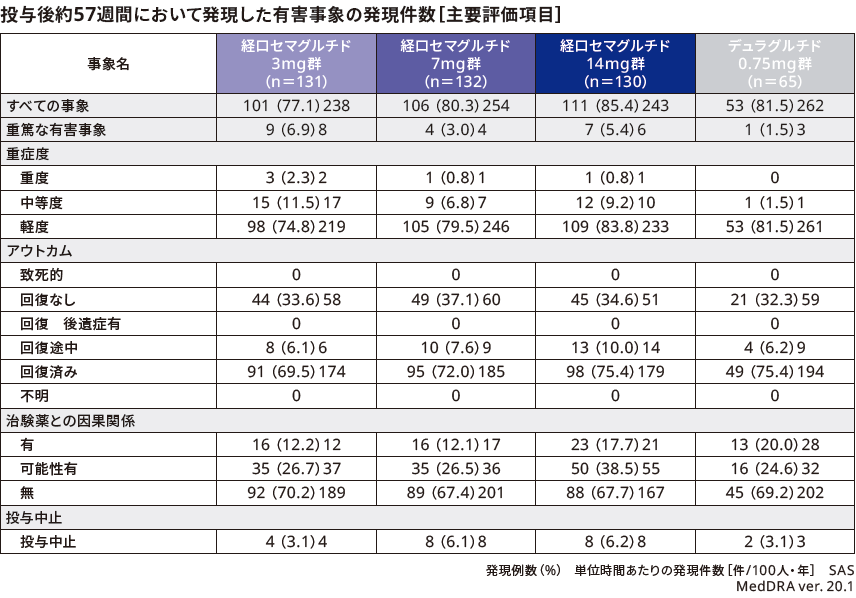
■安全性
有害事象の発現割合は、リベルサス®3mg群、7mg群、14mg群でそれぞれ77.1%(101/131例)、80.3%(106/132例)、85.4%(111/130例)、デュラグルチド0.75mg群で81.5%(53/65例)であり、最も高頻度で報告された有害事象はすべての群で上咽頭炎であり、リベルサス®3mg群、7mg群、14mg群でそれぞれ26.0%(34/131例)、29.5%(39/132例)、30.0%(39/130例)、デュラグルチド0.75mg群で29.2%(19/65例)であった。
重篤な有害事象としてリベルサス®3mg群で9例11件(直腸腺癌、大腸ポリープ、帯状疱疹、虫垂炎、腹膜炎、急性心筋梗塞、心臓アブレーション、脊椎手術、糖尿病網膜症、突発性難聴、虚血性脳梗塞、各1件)、7mg群で4例5件(結腸直腸癌、大腸ポリープ、肺炎、ショック、大腿骨頚部骨折、各1件)、14mg群で7例8件(前立腺癌、大腸腺腫、胃腸の炎症、骨髄炎、蜂巣炎、肩回旋筋腱板症候群、狭心症、良性前立腺肥大症、各1件)が、デュラグルチド0.75mg群で1例2件(狭心症、第二度房室ブロック、各1件)が認められた。また、投与中止に至った有害事象としてリベルサス®3mg群で4例5件(悪心、便秘、高アミラーゼ血症、高リパーゼ血症、直腸腺癌、各1件)、7mg群で8例11件(食欲減退3件、慢性胃炎、悪心、消化不良、腹痛、体重減少、前立腺特異性抗原増加、肝機能異常、高血圧、各1件)、14mg群で8例10件(体重減少2件、胃食道逆流性疾患、胃腸障害、腹部不快感、腹部膨満、慢性胃炎、嘔吐、味覚異常、食欲減退、各1件)が、デュラグルチド0.75mg群で2例2件(下痢、食欲減退、各1件)が認められた。
本試験では死亡例は報告されなかった。

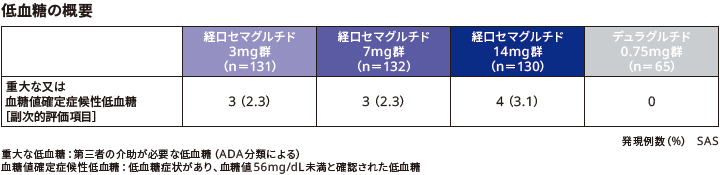
■低血糖
本試験において重大な又は血糖値確定症候性低血糖を発現した患者の割合は、リベルサス®3mg群、7mg群、14mg群でそれぞれ2.3%(3/131例)、2.3%(3/132例)、3.1%(4/130例)であった。デュラグルチド0.75mg群での発現はみられなかった。
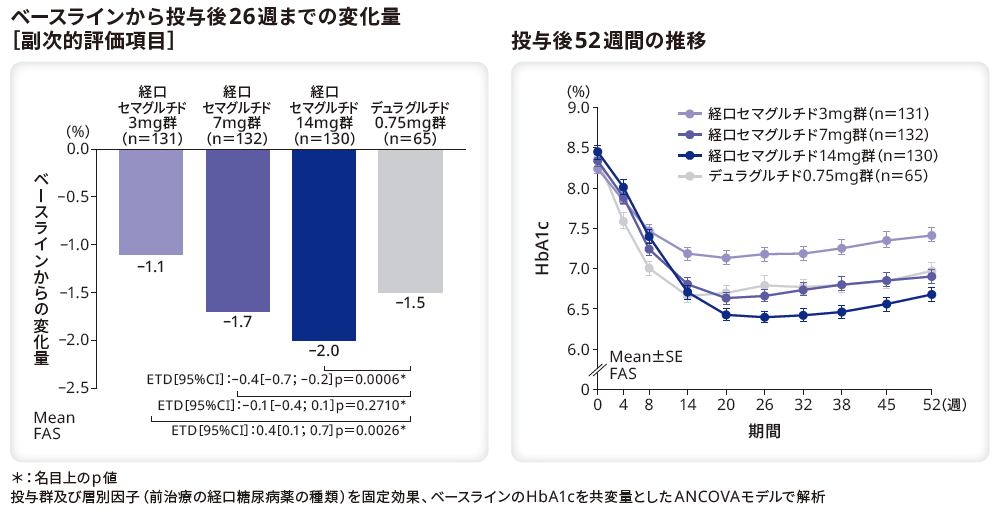
■HbA1cの変化量と推移
HbA1cのベースラインから投与後26週までの変化量のリベルサス®3mg群、7mg群、14mg群とデュラグルチド0.75mg群のETDはそれぞれ0.4%(95%CI[0.1;0.7]、p=0.0026*)、–0.1%(95%CI[–0.4;0.1]、p=0.2710*)、–0.4%(95%CI[–0.7;–0.2]、p=0.0006*)であり、デュラグルチド0.75mg群と比較してリベルサス®14mg群で有意に低下した。また、リベルサス®7mg群とデュラグルチド0.75mg群に有意差はなかった。一方、リベルサス®3mg群の変化量はデュラグルチド0.75mg群と比較して有意に小さかった。
ベースラインのHbA1cは、リベルサス®3mg群、7mg群、14mg群でそれぞれ8.2%、8.3%、8.4%、デュラグルチド0.75mg群で8.4%であった。投与後26週までのHbA1c変化量はリベルサス®3mg群、7mg群、14mg群でそれぞれ–1.1%、–1.7%、–2.0%、デュラグルチド0.75mg群で–1.5%であった。
*:名目上のp値
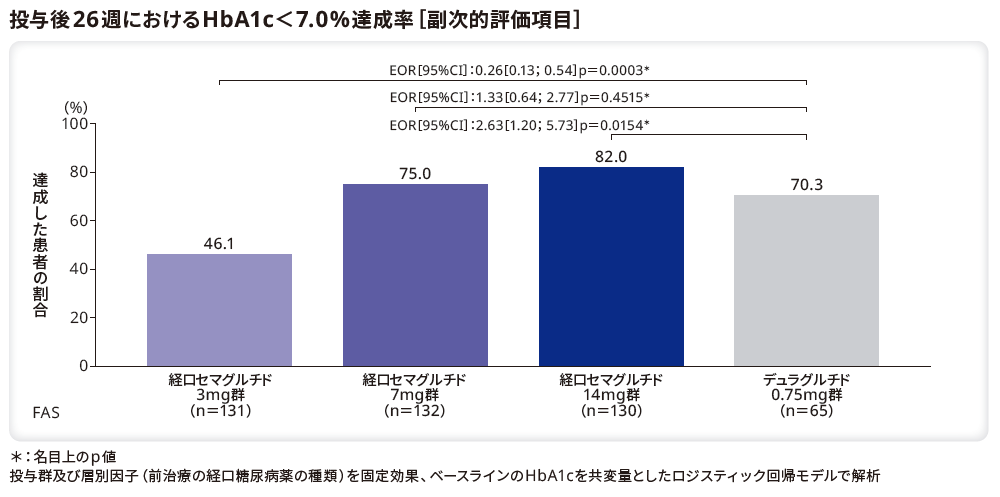
■HbA1c目標達成率
投与後26週にHbA1c目標値(7.0%未満)を達成した患者の割合は、リベルサス®14mg群でデュラグルチド0.75mg群と比較して有意に高かった(p=0.0154*)。リベルサス®7mg群とデュラグルチド0.75mg群の間には有意差はなかった(p=0.4515*)。一方、リベルサス®3mg群は、デュラグルチド0.75mg群と比較して有意に低かった(p=0.0003*)。
*:名目上のp値
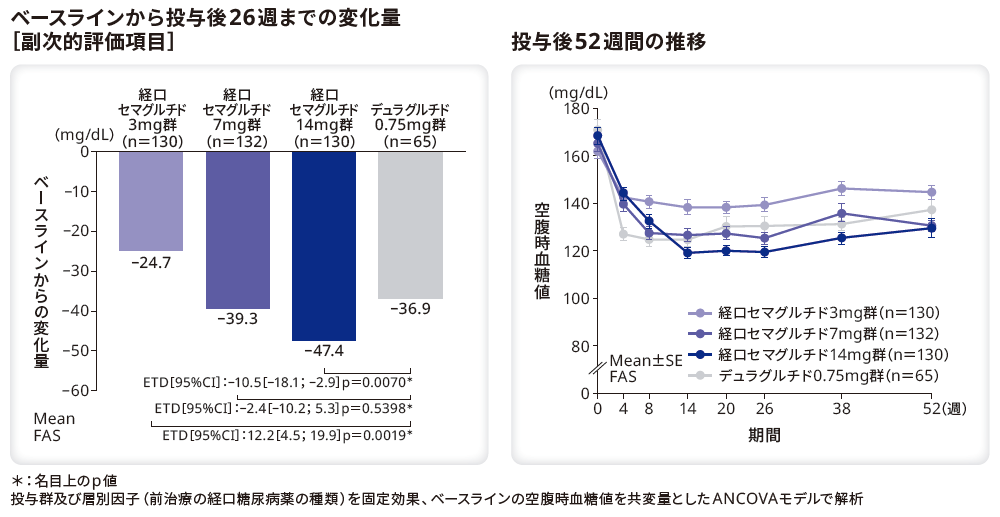
■空腹時血糖値の変化量と推移
空腹時血糖値のベースラインから投与後26週のリベルサス®3mg群、7mg群、14mg群とデュラグルチド0.75mg群のETDはそれぞれ12.2mg/dL(95%CI[4.5;19.9]、p=0.0019*)、–2.4mg/dL(95%CI[–10.2;5.3]、p=0.5398*)、–10.5mg/dL(95%CI[–18.1;–2.9]、p=0.0070*)であり、デュラグルチド0.75mg群と比較してリベルサス®14mg群で有意に低下した。また、リベルサス®7mg群とデュラグルチド0.75mg群に有意差はなかった。一方、リベルサス®3mg群の変化量は、デュラグルチド0.75mg群と比較して有意に小さかった。
ベースラインの空腹時血糖値は、リベルサス®3mg群、7mg群、14mg群でそれぞれ161.9mg/dL、165.3mg/dL、168.5mg/dL、デュラグルチド0.75mg群で171.1mg/dLであった。投与後26週までの空腹時血糖値の変化量はリベルサス®3mg群、7mg群、14mg群でそれぞれ–24.7mg/dL、–39.3mg/dL、–47.4mg/dL、デュラグルチド0.75mg群で–36.9mg/dLであった。
*:名目上のp値
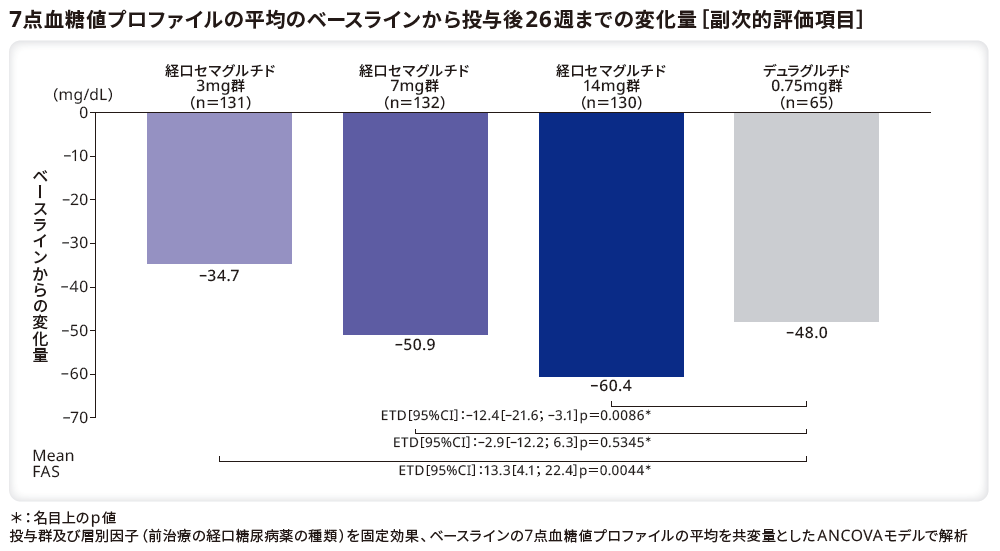
■7点血糖値プロファイル(SMBG)
7点血糖値プロファイルの平均のベースラインから投与後26週までの変化量のリベルサス®3mg群、7mg群、14mg群とデュラグルチド0.75mg群のETDはそれぞれ13.3mg/dL(95%CI[4.1;22.4]、p=0.0044*)、–2.9mg/dL(95%CI[–12.2;6.3]、p=0.5345*)、–12.4mg/dL(95%CI[–21.6;–3.1]、p=0.0086*)であり、デュラグルチド0.75mg群と比較してリベルサス®14mg群で有意な低下を示した。また、リベルサス®7mg群とデュラグルチド0.75mg群に有意差はなかった。一方、リベルサス®3mg群の変化量は、デュラグルチド0.75mg群と比較して有意に小さかった。
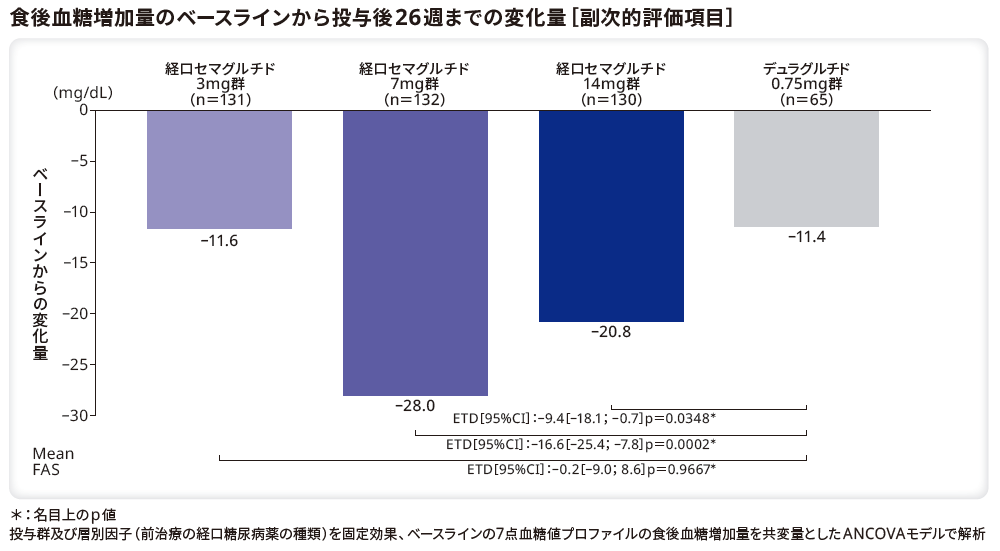
食後血糖増加量のベースラインから投与後26週までの変化量のリベルサス®3mg群、7mg群、14mg群とデュラグルチド0.75mg群のETDはそれぞれ–0.2mg/dL(95%CI[–9.0;8.6]、p=0.9667*)、–16.6mg/dL(95%CI[–25.4;–7.8]、p=0.0002*)、–9.4mg/dL(95%CI[–18.1;–0.7]、p=0.0348*)であり、デュラグルチド0.75mg群と比較してリベルサス®7mg群、14mg群で有意な低下を示した。一方、リベルサス®3mg群とデュラグルチド0.75mg群に有意差はなかった。
*:名目上のp値
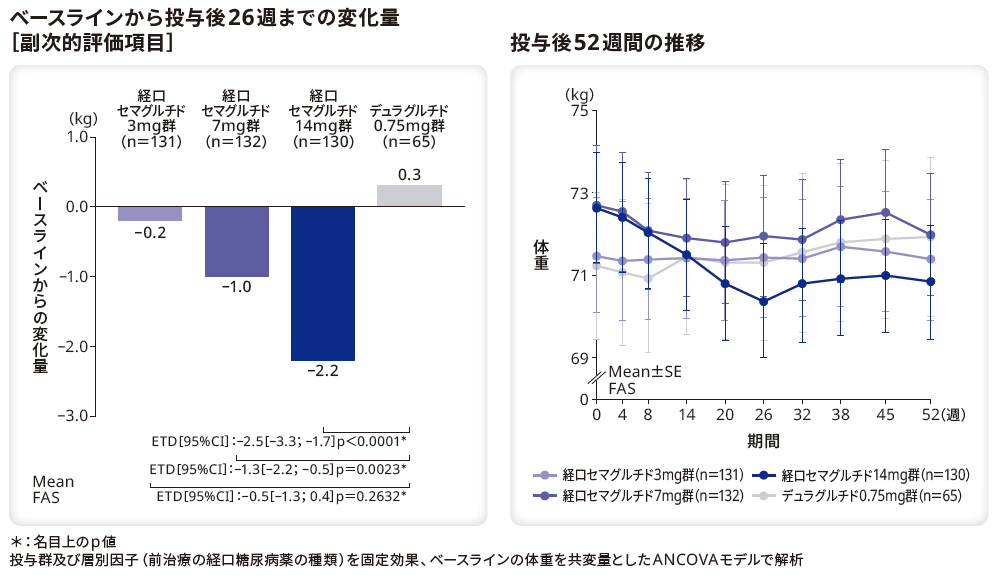
■<参考情報> 体重への影響
体重のベースラインから投与後26週までの変化量は、デュラグルチド0.75mg群と比較してリベルサス®7mg群及び14mg群で有意に低下し(それぞれp=0.0023*、p<0.0001*)、3mg群では有意差はなかった(p=0.2632*)。
*:名目上のp値
6. 用法及び用量
通常、成人には、セマグルチド(遺伝子組換え)として1日1回7mgを維持用量とし経口投与する。ただし、1日1回3mgから開始し、4週間以上投与した後、1日1回7mgに増量する。なお、患者の状態に応じて適宜増減するが、1日1回7mgを4週間以上投与しても効果不十分な場合には、1日1回14mgに増量することができる。
7. 用法及び用量に関連する注意(抜粋)
7.1 本剤の吸収は胃の内容物により低下することから、本剤は、1日のうちの最初の食事又は飲水の前に、空腹の状態でコップ約半分の水(約120mL 以下)とともに3mg錠、7mg錠又は14mg錠を1錠服用すること。また、服用時及び服用後少なくとも30分は、飲食及び他の薬剤の経口摂取を避けること。分割・粉砕及びかみ砕いて服用してはならない。[電子添文16.2.1-16.2.3参照]
α-GI:α-グルコシダーゼ阻害薬 ADA:米国糖尿病学会 CI:信頼区間 EOR:群間比の推定値 ETD:群間差の推定値 FAS:最大の解析対象集団 SAS:安全性解析対象集団 SGLT2阻害薬:ナトリウム-グルコース共輸送体2阻害薬 SMBG:血糖自己測定値 SU:スルホニルウレア薬 TZD:チアゾリジン薬
【禁忌を含む注意事項等情報】等はこちらをご参照ください。