臨床試験における耐性変異の発現
本剤は海外での臨床試験成績をもとに承認されたため、国内での臨床試験は実施していません。
DRIVE-AHEAD試験で投与したドラビリン/ラミブジン/テノホビルジソプロキシルフマル酸塩の配合剤(DOR/3TC/TDF)※1及びエファビレンツ/エムトリシタビン/テノホビル ジソプロキシルフマル酸塩の配合剤(EFV/FTC/TDF)※2、DRIVE-SHIFT試験及びDRIVE-BEYOND試験で投与したDOR/3TC/TDF配合剤※1は、いずれも国内未承認薬ですが、承認時評価資料であることからデータを掲載しています。これらの各成分の国内承認用法及び用量については本ページ注釈又は各製品電子添文をご参照ください。
臨床試験における耐性変異の発現
■ 治療未経験のHIV-1感染症患者(48週時)1)2)
DRIVE-FORWARD試験及びDRIVE-AHEAD試験のピフェルトロ®併用群a+DOR/3TC/TDF群(n=747)では、投与48週までの耐性解析対象集団b30例中7例に、耐性変異の発現が認められました。
48週時までの耐性変異の発現率(探索的評価項目) 1)2)

※逆転写酵素領域でのドラビリン耐性関連の変異は、A98G、V106I、V106A、V106M/T、Y188L、H221Y、P225H、F227C、F227C/R及びY318Y/Fの変異を1つ以上含んでいた。
a:背景治療としてTDF/FTC又はABC/3TCを投与
b:ウイルス学的失敗例又はウイルス学的失敗以外の理由による中止例のうち、HIV-1 RNA量>400copies/mLで、耐性データが得られた患者。 DRIVE-FORWARD試験及びDRIVE-AHEAD試験では、ウイルス学的失敗を、以下のノンレスポンダー又はリバウンダーが1週間以上の間隔で2回連続して測定された場合とした。
・ノンレスポンダー:24週時又は36週時のHIV-1 RNA量≥200copies/mL、又は48週時のHIV-1 RNA量≥ 50copies/mL
・リバウンダー:HIV-1 RNA量<50copies/mLを達成後にいずれかの時点でHIV-1 RNA量≥50copies/mL
N/A:該当なし
■ 治療未経験のHIV-1感染症患者(48~96週時)1)2)
DRIVE-FORWARD試験のピフェルトロ®併用群では、1例でV106A及びP225Hの耐性変異の発現が認められ、この変異によりドラビリンに対する感受性は95倍超の低下を示しました。
DRIVE-AHEAD試験のDOR/3TC/TDF群では耐性変異の発現は認められませんでした。
■(参考)国内NNRTI耐性変異保有率
2003年1月~2008年12月の間に日本で新規にHIV-1感染症と診断された2,573例の患者におけるNNRTI耐性変異の保有率は0.8%であり、K103Nが0.6%、K101E及びY181C/I/Vが0.1%、L100I、V106A/M、P225h及びP236Lは0%であった3)。なお、Y188L変異は解析された19種類のNNRTI耐性変異に含まれていたが、検出例は報告されなかった。
■ 治療経験のあるHIV-1感染症患者(48週時)4)
DRIVE-SHIFT試験のドラビリンへの切り替え(切替)群0~48週(n=447)及びベースライン治療継続(継続)群24~48週(n=209)では、DOR/3TC/TDFの投与期間中に遺伝子型又は表現型解析aにおいて、新たな耐性変異の発現は認められませんでした。
ベースライン時にNNRTI耐性変異(K103N、G190A又はY181C)を有していた24例(切替群:11例、継続群:13例)では、48週時又は試験中止時までにウイルス学的失敗bは認められませんでした。
48週までの耐性変異の発現率(追加評価項目)3)
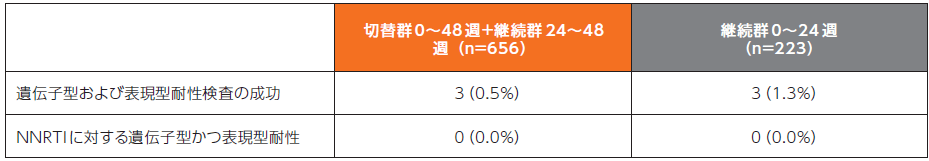
切替群:試験開始時にベースライン治療をDOR/3TC/TDFにすぐに切り替えて48週間投与
継続群:リトナビル又はコビシスタットを併用したプロテアーゼ阻害剤、もしくはコビシスタットを併用したエルビテグラビル、又はNNRTI、のいずれかにNRTI2剤を併用し24週間継続投与後、DOR/3TC/TDFに切り替えて24週間投与
a:ウイルス学的失敗例又はウイルス学的失敗以外の理由による中止例のうち、HIV-1 RNA量>400copies/mLであった患者を耐性検査の対象とした。
b:DRIVE-SHIFT試験では、ウイルス学的失敗を、1週間以上の間隔で2回連続してHIV-1 RNA量≥50copies/mLと定義した。
■ NNRTI耐性変異を有する治療未経験のHIV-1感染症患者(DRIVE-BEYOND試験)5)
逆転写酵素領域K103N、Y181C又はG190Aのいずれか一つのNNRTI耐性変異を有する治療未経験のHIV-1感染症患者10例を対象に、1日1回DOR/3TC/TDFを投与した非盲検単群試験を実施しました。9例が有効性解析の基準を満たしました(1例はスクリーニング時に中央検査機関においてK103Nの変異が確認されませんでした)。
その結果、8例(K103N:7例及びG190A:1例)は48週時までの試験を完了し、全員がウイルス学的抑制 (HIV-1 RNA量<50copies/mL)を達成しました。なお、48週時以前に中止した2例は、中止前にウイルス学的抑制を達成しました。試験期間中にその他の薬剤耐性変異を示した患者は認められませんでした。
海外第Ⅱ相臨床試験(DRIVE-BEYOND試験)(海外データ)5)6)
[目的]
特定のNNRTI変異を有する治療未経験のHIV-1感染症患者を対象に、DOR/3TC/TDFの有効性を非盲検で検討する。
[対象]
治療未経験の18歳以上のHIV-1感染症患者:試験薬投与例10例(当初目標組み入れ症例数60例)
[方法]
対象患者にDOR/3TC/TDFを1日1回投与し、96週間治療を行った。
[試験デザイン]
多施設共同、非盲検、前期第Ⅱ相試験
[評価項目]
主要評価項目:48週時におけるHIV-1 RNA量<50copies/mLの患者の割合
副次評価項目:96週時におけるHIV-1 RNA量<50copies/mLの患者の割合 等
安全性及び忍容性
[解析計画]
有効性と安全性は要約統計量と信頼区間(CI)で記述し、仮説検定は実施しなかった。95%CIはClopper & Pearson法により算出した。
※1:DOR/3TC/TDFは、ドラビリン100mg/ラミブジン300mg/テノホビル ジソプロキシルフマル酸塩300mgを含有する製剤で、国内未承認です。
各成分の国内承認用法及び用量(各製品電子添文より):
・ドラビリン:通常、成人にはドラビリンとして100mgを1日1回経口投与する。本剤は、食事の有無にかかわらず投与できる。投与に際しては、必ず他の抗HIV薬と併用すること。
・ラミブジン:通常、成人には他の抗HIV薬と併用して、ラミブジンとして1日量300mgを1日1回又は2回(150mg×2)に分けて経口投与する。なお、年齢、体重、症状により適宜増減する。
・テノホビル ジソプロキシルフマル酸塩:通常、成人にはテノホビル ジソプロキシルフマル酸塩として1回300mg(テノホビル ジソプロキシルとして245mg)を1日1回経口投与する。なお、投与に際しては必ず他の抗HIV薬と併用すること。
※2:EFV/FTC/TDFは、エファビレンツ600mg/エムトリシタビン200mg/テノホビル ジソプロキシルフマル酸塩300mgを含有する製剤で、国内未承認です。
各成分の国内承認用法及び用量(各製品電子添文より):
・エファビレンツ:通常、成人にはエファビレンツとして600mgを1日1回経口投与する。本剤は、食事の有無にかかわらず投与できる。なお、投与に際しては必ず他の抗HIV薬と併用すること。
・エムトリシタビン:通常、成人にはエムトリシタビンとして1回200mgを1日1回経口投与する。なお、投与に際しては必ず他の抗HIV薬と併用すること。
・テノホビル ジソプロキシルフマル酸塩:通常、成人にはテノホビル ジソプロキシルフマル酸塩として1回300mg(テノホビル ジソプロキシルとして245mg)を1日1回経口投与する。なお、投与に際しては必ず他の抗HIV薬と併用すること。
[結果]
主要評価項目である48週時におけるHIV-1 RNA量<50copies/mLの患者の割合は100%(8例中8例、95%CI:63.1, 100、Clopper & Pearson法)あった。96週時では100%(7例中7例、95%CI:59.0, 100、Clopper & Pearson法)であった。
[安全性]
96週までに10例中6例に副作用が認められた。2例以上に認められた副作用は腹部不快感及び疲労であった。重篤な副作用、投与中止に至った副作用、死亡はなかった。
1)承認時評価資料(海外第Ⅲ相試験:DRIVE-FORWARD試験)
2)Molina JM, et al. Lancet HIV 2018;5(5):e211-e220
(利益相反:Merck & Co., Inc., Rahway, N.J., U.S.A. が資金提供。
共著者のLai、Xu、Rodgers、Lupinacci、Kumar、Sklar、Nguyen、Hanna、Hwang はMerck & Co., Inc., Rahway,N.J., U.S.A. の社員。)
3)承認時評価資料(海外第Ⅲ相試験:DRIVE-AHEAD試験)
4)Orkin C, et al. Clin Infect Dis 2019;68(4): 535-544
(利益相反: Merck & Co., Inc., Rahway, N.J., U.S.A. が資金提供。
共著者のLupinacci、Rodgers、Xu、Lin、Kumar、Sklar、Nguyen、Hanna、Hwang、MartinはMerck & Co., Inc.,Rahway, N.J., U.S.A. の社員)
5)Hattori J, et al. Antiviral Res 2010;88(1): 72-79
6)承認時評価資料(海外第Ⅲ相試験:DRIVE-SHIFT試験)