KEYNOTE-158
本剤は、一部承認外の効能又は効果による臨床成績も含めた臨床データパッケージで評価され、承認されました。そのため、国内で承認されている効能又は効果と異なるデータも紹介しています。
臨床試験:国際共同第Ⅱ相試験KEYNOTE-158
承認時評価資料: 国際共同第Ⅱ相試験(KEYNOTE-158試験)
<KEYNOTE-158試験の各グループに組み入れられたがん種>
A:肛門癌(扁平上皮癌)、B:胆道癌(胆嚢及び胆管の腺癌、ただしファーター膨大部腫瘍を除く)、C:肺、虫垂、小腸、結腸、直腸及び膵臓由来の神経内分泌腫瘍(高分化型又は中分化型神経内分泌腫瘍)、D:子宮内膜癌(肉腫又は間葉系腫瘍を除く)、E:子宮頸癌(扁平上皮癌)、F:外陰癌(扁平上皮癌)、G:小細胞肺癌、H:中皮腫、I:甲状腺癌、J:唾液腺癌(肉腫又は間葉系腫瘍を除く)
試験概要
【目的】
化学療法歴*1のある進行・再発のTMB-High*2固形癌患者におけるキイトルーダ®の有効性及び安全性を検討する。
【デザイン】
国際共同非無作為化非盲検複数コホート第Ⅱ相試験
【対象】
化学療法歴*1のある進行・再発の固形癌患者(TMBスコアがない患者を含む)1,066例のうち、
TMB-High:有効性解析集団102例(日本人患者6例を含む)、安全性解析集団105例(日本人患者6例を含む)
非TMB-High:有効性解析集団689例(日本人患者71例を含む)
【方法】
事前規定された探索的バイオマーカーであるTMBをF1CDxにより測定し、TMB-High集団及び非TMB-High集団別に解析計画に従って解析した。なお、本試験ではキイトルーダ®200mgを3週間間隔(Q3W)で点滴静注した。投与開始後12ヵ月までは9週間毎、12ヵ月以降は12週間毎に画像検査による評価を行い、疾患進行(PD)又は許容できない有害事象の発現等による投与中止、もしくは最大35サイクルまで投与を継続した。
【評価項目】
主要評価項目:奏効率(overall response rate; ORR)
副次評価項目:奏効期間(duration of response; DOR)、無増悪生存期間(progression free survival; PFS)、全生存期間(overall survival; OS)、安全性
【判定基準】
ORR、DOR、PFSは、独立判定委員会(Independent Review Committee; IRC)がRECISTガイドライン1.1版に基づき評価した。
【解析計画】
解析対象集団:有効性解析集団はデータカットオフ日*3の26週間前までに本試験に組み入れられ治験薬を1回以上投与されたTMBスコアを有する患者、安全性解析集団はデータカットオフ日*3までに本試験に組み入れられ治験薬を1回以上投与されたTMB-Highを有する患者を対象として実施した。
有効性評価の統計手法:ORRについては二項分布に基づく正確法による95%信頼区間(CI)を算出した。
併せてがん種別、バイオマーカー別のサブグループ解析を実施した。DOR、PFS及びOSについてはKaplan-Meier法を用いて推定した。日本人集団については、治験実施計画書に記載されていないが、ORR、DOR、PFS及びOSについても算出し、評価資料として承認時に評価された。
*1 一次治療として標準的に実施されている化学療法並びに日常診療で用いられている手術及び放射線療法を含む治療に抵抗性又は不耐容の患者を組み入れることとされた
*2 F1CDxで算出されたTMBスコアが10mut/Mb以上と定義
*3 データカットオフ日は、2019年6月27日(10回目の中間解析)とした
キイトルーダ®の4. 効能又は効果、5. 効能又は効果に関連する注意は以下のとおりです。
4. 効能又は効果(抜粋)
がん化学療法後に増悪した高い腫瘍遺伝子変異量(TMB-High)を有する進行・再発の固形癌(標準的な治療が困難な場合に限る)
5. 効能又は効果に関連する注意(抜粋)
〈がん化学療法後に増悪したTMB-Highを有する進行・再発の固形癌(標準的な治療が困難な場合に限る)〉
5.26 十分な経験を有する病理医又は検査施設における検査により、TMB-Highが確認された患者に投与すること。検査にあたっては、関連学会のガイドライン等の最新の情報を参考に、先行の化学療法等によるTMB検査結果への影響及び検査に用いる検体の採取時期について確認し、承認された体外診断用医薬品又は医療機器を用いること。なお、承認された体外診断用医薬品又は医療機器に関する情報については、以下のウェブサイトから入手可能である:
https://www.pmda.go.jp/review-services/drug-reviews/review-information/cd/0001.html
5.27 本剤の一次治療における有効性及び安全性は確立していない。また、二次治療において標準的な治療が可能な場合にはこれらの治療を優先すること。
5.28 本剤の手術の補助療法における有効性及び安全性は確立していない。
5.29 臨床試験に組み入れられた患者のがん種等について、「17. 臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、本剤以外の治療の実施についても慎重に検討し、適応患者の選択を行うこと。[17.1.26参照]
患者背景
*1 全身化学療法による治療を受けなかった患者
*2 術前/術後補助療法の完了後12ヵ月間再発を認めなかった、又は根治的治療を受けた患者
*3 RECISTガイドライン1.1版に基づくIRCによる評価
*4 CPS:Combined positive score、PD-L1を発現しているがん細胞に加え、リンパ球やマクロファージといった免疫細胞もカウントし、その数をがん細胞の総数で除して100を乗じることで算出
有効性解析集団の追跡期間中央値:TMB-High集団 11.1ヵ月[範囲:0.5, 39.7]、非TMB-High集団 12.7ヵ月[範囲:0.4, 41.0]
安全性解析集団の追跡期間中央値:TMB-High集団 10.9ヵ月[範囲:0.5, 39.7]
(データカットオフ日:2019年6月27日)
主要評価項目:奏効率(overall response rate; ORR)
副次評価項目:奏効期間(duration of response; DOR)、無増悪生存期間(progression free survival; PFS)、全生存期間(overall survival; OS)、安全性
主要評価項目 奏効率(ORR)
- TMB-High集団におけるORRは29.4%(95%CI:20.8, 39.3)でした。
■奏効率(ORR)(有効性解析集団)
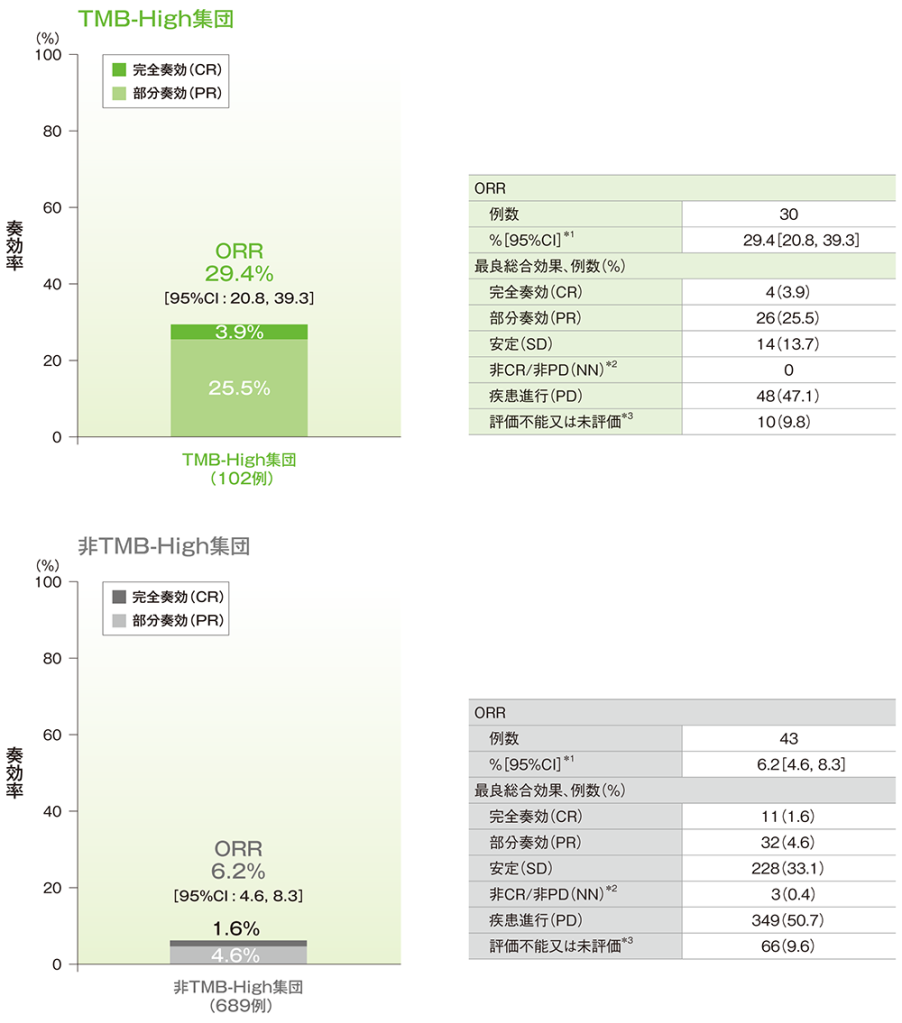
RECISTガイドライン1.1版に基づくIRCによる評価
*1 二項分布に基づく正確法
*2 中央判定で登録時点では測定病変なしとされ、治験薬投与後に非CR/非PDと評価された患者
*3 未評価:データカットオフ日において、IRCによるベースライン評価はあるが、ベースライン後の評価がない患者(スキャン後に脱落、中止又は死亡を含む)を集計した
(追跡期間中央値:TMB-High集団 11.1ヵ月[範囲:0.5, 39.7]、非TMB-High集団 12.7ヵ月[範囲:0.4, 41.0]、データカットオフ日:2019年6月27日)
■ベースラインからの腫瘍径(標的病変)の最大変化率(有効性解析集団)
(データカットオフ日:2019年6月27日)
サブグループ解析 がん種別の奏効率(ORR)
- TMB-High集団におけるがん種別の奏効率(ORR)は、高い順に、子宮内膜癌46.7%(95%CI:21.3, 73.4)、子宮頸癌31.3%(95%CI:11.0, 58.7)、小細胞肺癌29.4%(95%CI:15.1, 47.5)、外陰癌16.7%(95%CI:2.1, 48.4)、肛門癌7.1%(95%CI:0.2, 33.9)でした。神経内分泌腫瘍、唾液腺癌、甲状腺癌及び中皮腫においてTMB-Highの患者は10例未満でした。また、胆道癌においてTMB-Highの患者は0例でした。
■がん種別の奏効率(ORR)(有効性解析集団)
※症例数が10例未満の場合は、例数表記としている
RECISTガイドライン1.1版に基づくIRCによる評価
*1 胆道癌の集団ではTMB-Highの患者はいなかった
*2 二項分布に基づく正確法
(追跡期間中央値:TMB-High集団 11.1ヵ月[範囲:0.5, 39.7]、非TMB-High集団 12.7ヵ月[範囲:0.4, 41.0]、データカットオフ日:2019年6月27日)
サブグループ解析 バイオマーカー別の奏効率(ORR)
- TMB-High集団からMSI-Highを除外した非MSI-High集団のORRは28.4%(95%CI:18.9, 39.5)でした。
MSI-High集団のORRは50.0%(95%CI:23.0, 77.0)でした。 - TMB-HighかつPD-L1陽性(CPS≧1)集団で35.3%(95%CI:24.1, 47.8)、TMB-HighかつPD-L1陰性(CPS<1)集団で20.7%(95%CI:8.0, 39.7)でした。
■バイオマーカー別の奏効率(ORR)
※症例数が10例未満の場合は、例数表記としている
RECISTガイドライン1.1版に基づくIRCによる評価
*1 二項分布に基づく正確法
*2 TMB、PD-L1ステータスデータが利用できる症例
*3 TMB、MSIステータスデータが利用できる症例
*4 TMB、PD-L1、MSIステータスデータが利用できる症例
(データカットオフ日:2019年6月27日)
副次評価項目 奏効期間(DOR)
- TMB-High集団における奏効までの期間中央値は2.1ヵ月(範囲:1.3, 6.3)でした。
- TMB-High集団では、DOR中央値は未到達(範囲:2.2+, 34.8+)でした。
- TMB-High集団で奏効が認められた患者(30例)のうち、奏効が12ヵ月以上持続した患者*1は17例(66.6%)、24ヵ月以上持続した患者は15例(66.6%)でした。
■奏効期間(DOR)のKaplan-Meier曲線
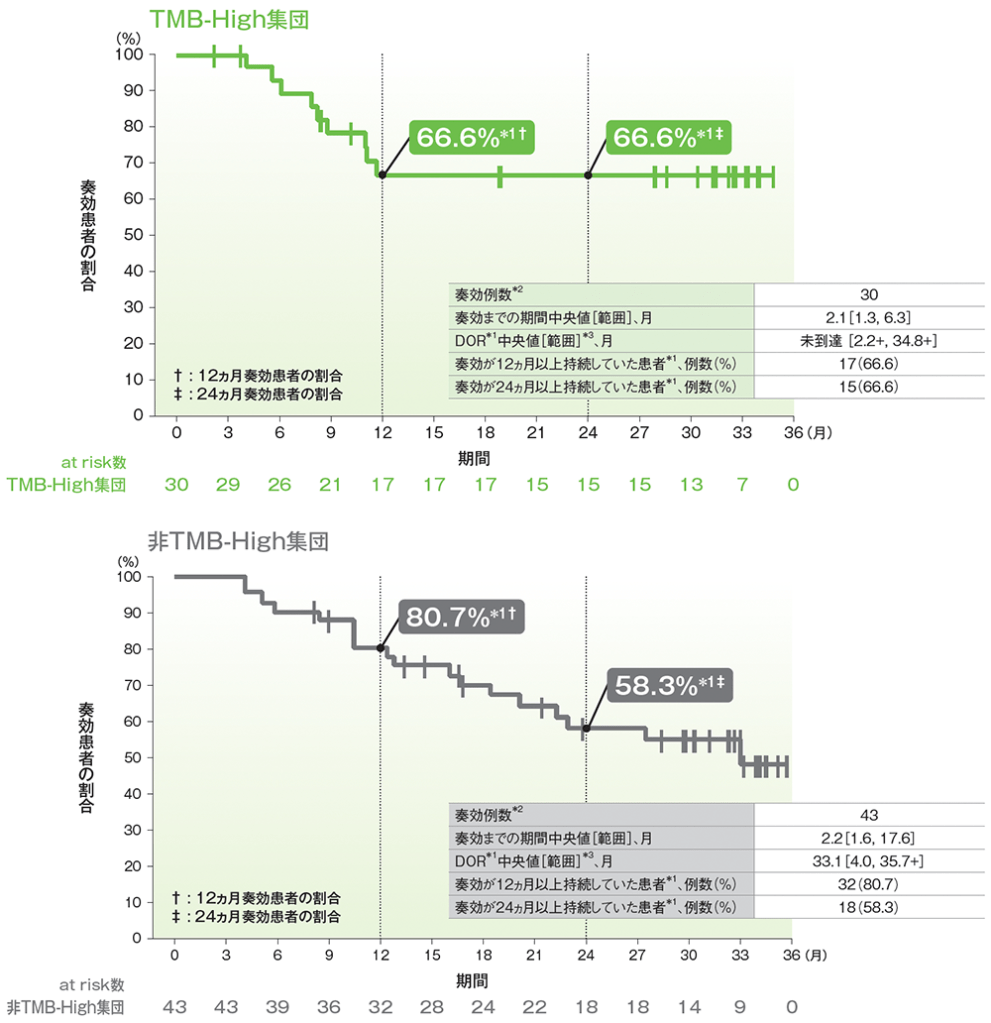
RECISTガイドライン1.1版に基づくIRCによる評価
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 RECISTガイドライン1.1版に基づくIRCによる評価において、完全奏効又は部分奏効を認めた症例数
*3 「+」は最後の疾患評価からPDがみられないことを示す
(データカットオフ日:2019年6月27日)
副次評価項目 無増悪生存期間(PFS)
- TMB-High集団におけるPFS中央値は2.1ヵ月(95%CI:2.1, 4.1)でした。
- TMB-High集団では、無増悪生存率は12ヵ月時点で26.4%、24ヵ月時点では21.6%でした。
■無増悪生存期間(PFS)のKaplan-Meier曲線(有効性解析集団)
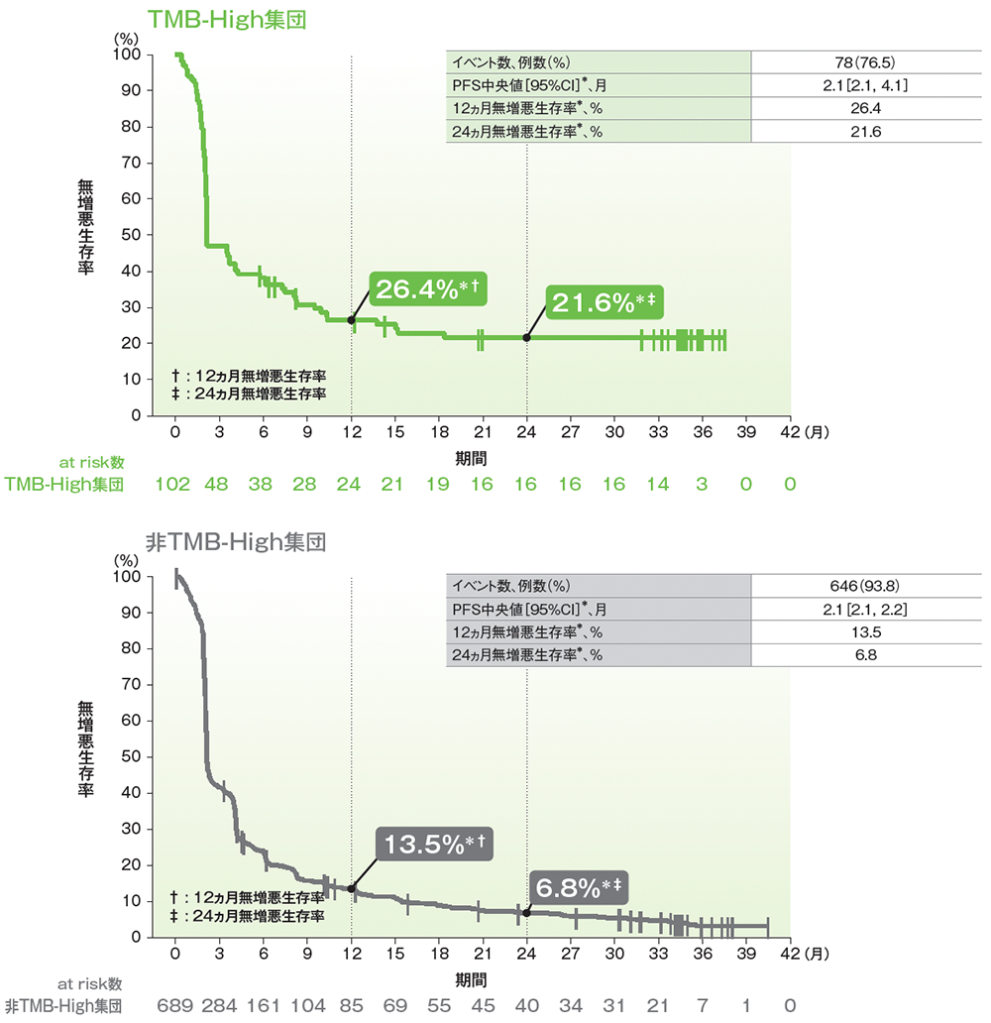
RECISTガイドライン1.1版に基づくIRCによる評価
* 打ち切りデータはproduct-limit (Kaplan-Meier)法に基づく
(追跡期間中央値:TMB-High集団 11.1ヵ月[範囲:0.5, 39.7]、非TMB-High集団 12.7ヵ月[範囲:0.4, 41.0]、データカットオフ日:2019年6月27日)
副次評価項目 全生存期間(OS)
- TMB-High集団におけるOS中央値は11.7ヵ月(95%CI:9.1, 19.1)でした。
- TMB-High集団では、全生存率は12ヵ月時点で49.6%、24ヵ月時点で34.3%でした。
■全生存期間(OS)のKaplan-Meier曲線(有効性解析集団)
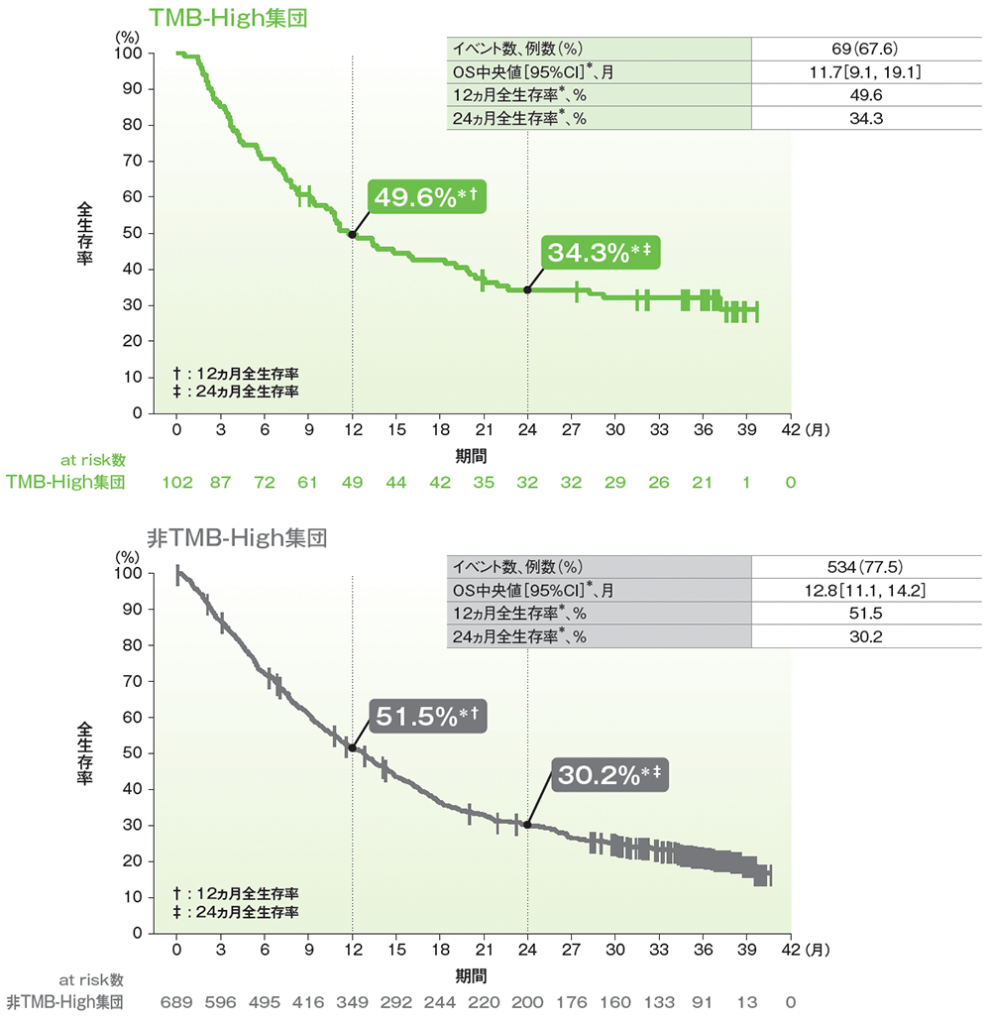
* 打ち切りデータはproduct-limit (Kaplan-Meier)法に基づく
(追跡期間中央値: TMB-High集団 11.1ヵ月[範囲:0.5, 39.7]、非TMB-High集団 12.7ヵ月[範囲:0.4, 41.0]、データカットオフ日:2019年6月27日)
安全性 主な副作用(安全性解析集団)
MedDRA/J v22.0
(追跡期間中央値:TMB-High集団 10.9ヵ月[範囲:0.5, 39.7]、データカットオフ日:2019年6月27日)
■主な副作用(発現率5%以上)(安全性解析集団)
MedDRA/J v22.0、GradeはCTCAE v4.03
(追跡期間中央値:TMB-High集団 10.9ヵ月[範囲:0.5, 39.7]、データカットオフ日:2019年6月27日)
安全性 主な免疫関連など特に注目すべき有害事象(安全性解析集団)
MedDRA/J v22.0
(追跡期間中央値:TMB-High集団 10.9ヵ月[範囲:0.5, 39.7]、データカットオフ日:2019年6月27日)
■免疫関連など特に注目すべき有害事象(1例以上の発現)(安全性解析集団)
MedDRA/J v22.0、GradeはCTCAE v4.03
(追跡期間中央値:TMB-High集団 10.9ヵ月[範囲:0.5, 39.7]、データカットオフ日:2019年6月27日)
国際共同第Ⅱ相試験<KEYNOTE-158試験>日本人集団(サブグループ解析)
■患者背景
※症例数が10例未満の場合は、例数表記としている
*1 RECISTガイドライン1.1版に基づくIRCによる評価
*2 CPS:Combined positive score、PD-L1を発現しているがん細胞に加え、リンパ球やマクロファージといった免疫細胞もカウントし、その数をがん細胞の総数で除して100を乗じることで算出
(追跡期間中央値:TMB-High集団 26.5ヵ月[範囲:7.0, 38.7]、非TMB-High集団 9.7ヵ月[範囲:1.1, 40.6]、データカットオフ日:2019年6月27日)
サブグループ解析 奏効率(ORR)
- 日本人TMB-High集団における奏効は6例中3例に認められました。
■奏効率(ORR)(日本人集団)(有効性解析集団)
RECISTガイドライン1.1版に基づくIRCによる評価
* 未評価:データカットオフ日において、IRCによるベースライン評価はあるが、ベースライン後の評価がない患者(スキャン後に脱落、中止又は死亡を含む)を集計した
(追跡期間中央値:TMB-High集団 26.5ヵ月[範囲:7.0, 38.7]、非TMB-High集団 9.7ヵ月[範囲:1.1, 40.6]、データカットオフ日:2019年6月27日)
サブグループ解析 奏効期間(DOR)
- 日本人TMB-High集団におけるDOR中央値は未到達(範囲:31.3+, 33.3+)でした。
- 日本人TMB-High集団で奏効が認められた3例中3例で、奏効が24ヵ月以上持続しました。
■奏効期間(DOR)(日本人集団)
RECISTガイドライン1.1版に基づくIRCによる評価
*1 RECISTガイドライン1.1版に基づくIRCによる評価において、完全奏効又は部分奏効を認めた症例数
*2 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*3 「+」は最後の疾患評価からPDがみられないことを示す
(データカットオフ日:2019年6月27日)
サブグループ解析 無増悪生存期間(PFS)
- 日本人TMB-High集団におけるPFS中央値は未到達(95%CI:1.6, NA)でした。
■無増悪生存期間(PFS)(日本人集団)(有効性解析集団)
※症例数が10例未満の場合は、例数表記としている
RECISTガイドライン1.1版に基づくIRCによる評価
* 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
(追跡期間中央値:TMB-High集団 26.5ヵ月[範囲:7.0, 38.7]、非TMB-High集団 9.7ヵ月[範囲:1.1, 40.6]、データカットオフ日:2019年6月27日)
サブグループ解析 全生存期間(OS)
- 日本人TMB-High集団におけるOS中央値は未到達(95%CI:7.0, NA)でした。
■全生存期間(OS)(日本人集団)(有効性解析集団)
※症例数が10例未満の場合は、例数表記としている
* 打ち切りデータはproduct-limit (Kaplan-Meier)法に基づく
(追跡期間中央値:TMB-High集団 26.5ヵ月[範囲:7.0, 38.7]、非TMB-High集団 9.7ヵ月[範囲:1.1, 40.6]、データカットオフ日:2019年6月27日)
安全性
主な副作用(日本人集団)(安全性解析集団)
MedDRA/J v22.0
(追跡期間中央値:TMB-High集団 26.5ヵ月[範囲:7.0, 38.7]、データカットオフ日:2019年6月27日)
■副作用(1例以上の発現)
MedDRA/J v22.0、GradeはCTCAE v4.03
(追跡期間中央値:TMB-High集団 26.5ヵ月[範囲:7.0, 38.7]、データカットオフ日:2019年6月27日)
安全性
免疫関連など特に注目すべき有害事象(日本人集団)(安全性解析集団)
MedDRA/J v22.0
(追跡期間中央値:TMB-High集団 26.5ヵ月[範囲:7.0, 38.7]、データカットオフ日:2019年6月27日)
■免疫関連など特に注目すべき有害事象(1例以上の発現)
MedDRA/J v22.0、GradeはCTCAE v4.03
(追跡期間中央値:TMB-High集団 26.5ヵ月[範囲:7.0, 38.7]、データカットオフ日:2019年6月27日)