【胃癌】HER2陽性*の治癒切除不能な進行・再発胃癌の1次治療におけるキイトルーダ®+トラスツズマブ+化学療法の有効性・安全性ー国際共同第Ⅲ相試験 KEYNOTE-811試験ー
2025年5⽉、キイトルーダ®は、胃癌の1次治療において免疫チェックポイント阻害剤としては初めて、HER2陽性*・陰性に関わらず「治癒切除不能な進行・再発胃癌」 […]
「警告・禁忌を含む注意事項等情報」等はこちらをご参照ください。
監修:
東京大学大学院医学系研究科 人体病理学・病理診断学
牛久 哲男 先生
近年、分子標的治療薬や免疫チェックポイント阻害薬の登場、またがん遺伝子パネル検査の保険収載に伴い、治療の適否や効果予測に関わる病理診断の重要性はますます高まっています。
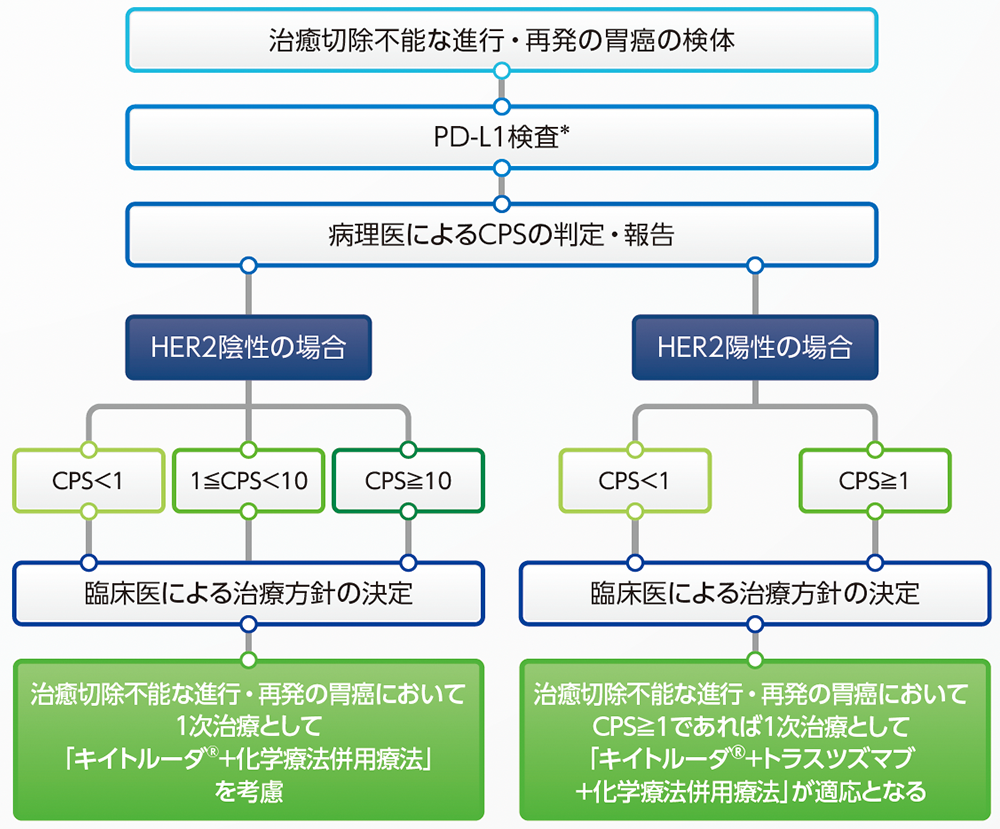
そのような状況下で、2024年5月にキイトルーダ®の「治癒切除不能な進行・再発の胃癌」に対する効能又は効果の追加が厚生労働省より承認され、2025年5月に医薬品添付文書改訂相談に基づき、臨床成績への国際共同第Ⅲ相試験(KEYNOTE-811試験:化学療法歴のないHER2陽性の治癒切除不能な進行·再発の胃又は食道胃接合部腺癌患者に対する1次治療)追加を含め電子添文が改訂されました。キイトルーダ®はT細胞機能を負に制御するPD-L1及びPD-L2のPD-1への結合を阻害する抗体であり、PD-L1を発現するがん細胞や炎症細胞が多い症例に抗腫瘍作用が期待されます。HER2陰性胃癌症例※への適応は、「コンプリメンタリー診断薬」、HER2陽性胃癌症例※への適応は、「コンパニオン診断薬」(PD-L1 IHC 22C3 pharmDx「ダコ」[Autostainer Link 48用])を用いた免疫染色標本のCombined Positive Score(CPS)によって判定されます。
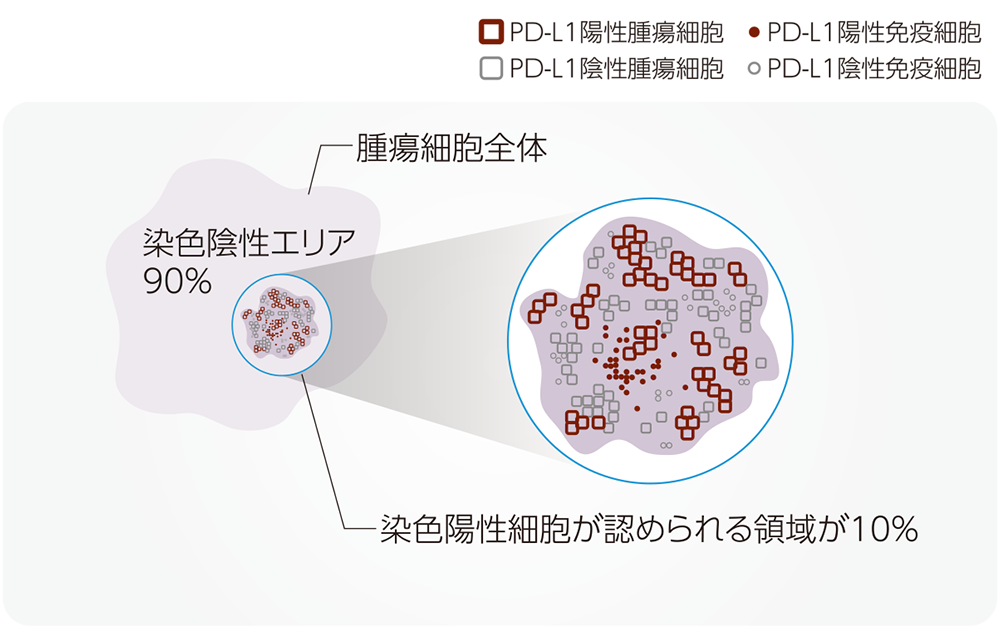
CPSは、腫瘍細胞に加えて、腫瘍浸潤免疫細胞(リンパ球、マクロファージ)も評価対象として陽性細胞率を算出するスコアです。本邦では、2019年に頭頸部癌の治療方針を選択するために導入され、現在では食道扁平上皮癌(2次治療以降)、進行又は再発の子宮頸癌、手術不能または再発のトリプルネガティブ乳癌の治療方針の選択にも使用されています。肺癌において使用されている、腫瘍細胞のみを評価するTumor Proportion Score(TPS)とは異なることに注意が必要です。
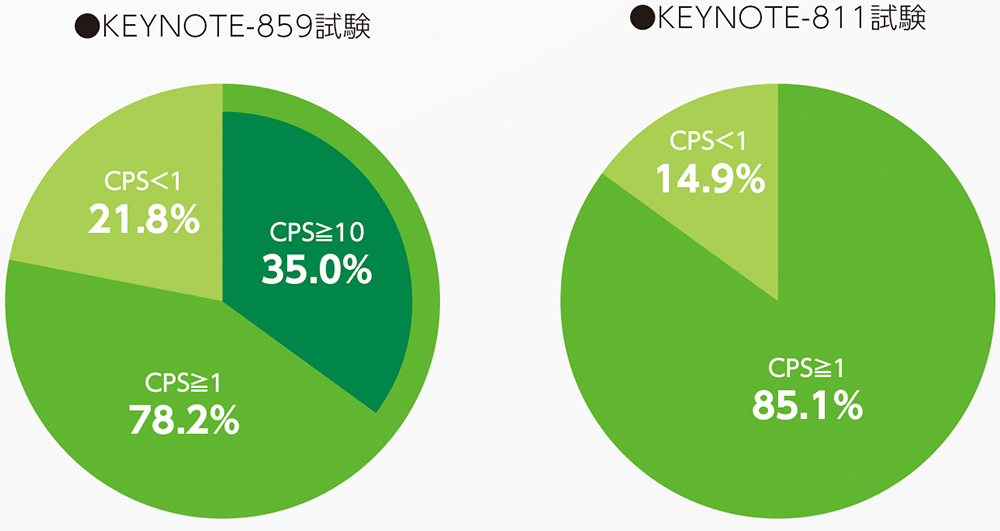
2024年5月の使用承認の根拠となった国際共同第Ⅲ相試験(KEYNOTE-859試験)では、CPS陽性(CPS≧1、CPS≧10)の症例、およびCPS陰性(CPS<1)症例を含む全集団(化学療法歴のないHER2陰性の治癒切除不能な進行・再発の胃癌患者)において、プラセボ併用群(プラセボ+化学療法併用療法)を対照としたキイトルーダ®併用群(キイトルーダ®+化学療法併用療法)の有効性を示す成績が得られた1,2)ことから、CPSの多寡にかかわらず使用可能となりました。
また、2025年5月の電子添文改訂の根拠となった国際共同第Ⅲ相試験(KEYNOTE-811試験)では、全体集団においてプラセボ併用群(プラセボ+トラスツズマブ+化学療法併用療法)を対照としたキイトルーダ®併用群(キイトルーダ®+トラスツズマブ+化学療法併用療法)の有効性が示され3-5)、さらに探索的に実施されたPD-L1発現状況別の解析結果を踏まえて、CPS≧1をカットオフとする評価が用いられることとなりました。
キイトルーダ®適応決定のためのPD-L1検査において、CPSについて十分にご理解いただくことは非常に重要であると考え、本サイトではCPSの計算方法や評価対象細胞の詳細についてページを割いて説明させていただいています。それと同時に、検体の取り扱い(固定・包埋・薄切・染色など)についても精度管理が求められることを忘れてはなりません。本サイトが、多くの施設におけるPD-L1検査の標準化につながり、キイトルーダ®が治癒切除不能な進行・再発の胃癌の治療に寄与することを希望します。
IHC:Immunohistochemistry(免疫組織化学法)
※コンパニオン診断薬は、特定の医薬品の有効性及び安全性が期待される患者を特定するために使用される体外診断用医薬品又は医療機器のうち、当該医薬品の使用にあたり不可欠なものです。一方、コンプリメンタリ―診断薬は、医薬品の有効性や安全性に対して参考になりますが、必須の検査ではありません。
1)承認時評価資料:国際共同第Ⅲ相試験(KEYNOTE-859試験)
2)Rha SY et al. Lancet Oncol 2023; 24: 1181-1195
本試験はMSD社の資金提供により行われた。著者にMSD社より顧問料などを受領している者が含まれる。著者にMSD社の社員が含まれる。
3)電子添文改訂時評価資料:国際共同第Ⅲ相試験(KEYNOTE-811試験)
4)Janjigian YY et al. Lancet 2023; 402: 2197-2208
5)Janjigian YY et al. Nature 2021; 600: 727-730
本試験はMSD社の資金提供により行われた。著者にMSD社より顧問料などを受領している者が含まれる。著者にMSD社の社員が含まれる。
5. 効能又は効果に関連する注意(抜粋)
<治癒切除不能な進行・再発の胃癌>
5.33 本剤の術後補助療法における有効性及び安全性は確立していない。
5.34 本剤の有効性は、PD-L1発現率(CPS)により異なる傾向が示唆されている。
5.34.1 HER2陰性の治癒切除不能な進行・再発の胃癌に対して本剤を投与する場合には、CPSについて、「17. 臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。[17.1.35参照]
5.34.2 HER2陽性の治癒切除不能な進行・再発の胃癌に対して本剤を投与する場合には、CPSについて、「17. 臨床成績」の項の内容を熟知し、十分な経験を有する病理医又は検査施設における検査により、PD-L1の発現が確認された患者に投与すること。検査にあたっては、承認された体外診断用医薬品又は医療機器を用いること。なお、承認された体外診断用医薬品又は医療機器に関する情報については、以下のウェブサイトから入手可能である:https://www.pmda.go.jp/review-services/drug-reviews/review-information/cd/0001.html[17.1.36参照]
5.33 本剤の術後補助療法における有効性及び安全性は確立していない。
5.34 本剤の有効性は、PD-L1発現率(CPS)により異なる傾向が示唆されている。
5.34.1 HER2陰性の治癒切除不能な進行・再発の胃癌に対して本剤を投与する場合には、CPSについて、「17. 臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。[17.1.35参照]
5.34.2 HER2陽性の治癒切除不能な進行・再発の胃癌に対して本剤を投与する場合には、CPSについて、「17. 臨床成績」の項の内容を熟知し、十分な経験を有する病理医又は検査施設における検査により、PD-L1の発現が確認された患者に投与すること。検査にあたっては、承認された体外診断用医薬品又は医療機器を用いること。なお、承認された体外診断用医薬品又は医療機器に関する情報については、以下のウェブサイトから入手可能である:https://www.pmda.go.jp/review-services/drug-reviews/review-information/cd/0001.html[17.1.36参照]
他の抗悪性腫瘍剤との併用において、通常、成人には、ペムブロリズマブ(遺伝子組換え)として、1回200mgを3週間間隔又は1回400mgを6週間間隔で30分間かけて点滴静注する。
7.12 併用する他の抗悪性腫瘍剤は「17. 臨床成績」の項の内容を熟知し、国内外の最新のガイドライン等を参考にした上で、選択すること。[17.1.35、17.1.36参照]
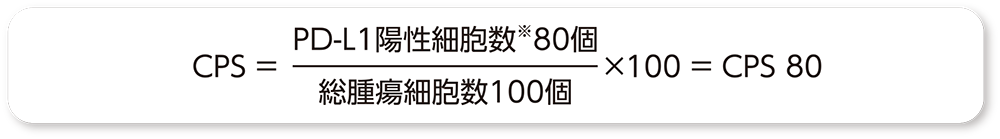
PD-L1の発現状況の指標であるCPSは、PD-L1を発現しているがん細胞及びリンパ球やマクロファージといった免疫細胞をカウントし、その数をがん細胞の総数で除し100を乗じることで算出されます。CPSはTPSと異なり、浸潤癌巣で判定します。

PD-L1検査は、「治癒切除不能な進行・再発の胃癌」の治療開始前に実施が考慮されます。
*PD-L1 IHC 22C3 pharmDx「ダコ」(ASL48用)によるPD-L1検査
5.効能又は効果に関連する注意(抜粋)
<治癒切除不能な進行・再発の胃癌>
5.33 本剤の術後補助療法における有効性及び安全性は確立していない。
5.34 本剤の有効性は、PD-L1発現率(CPS)により異なる傾向が示唆されている。
5.34.1 HER2陰性の治癒切除不能な進行・再発の胃癌に対して本剤を投与する場合には、CPSについて、「17. 臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。[17.1.35参照]
5.34.2 HER2陽性の治癒切除不能な進行・再発の胃癌に対して本剤を投与する場合には、CPSについて、「17. 臨床成績」の項の内容を熟知し、十分な経験を有する病理医又は検査施設における検査により、PD-L1の発現が確認された患者に投与すること。検査にあたっては、承認された体外診断用医薬品又は医療機器を用いること。なお、承認された体外診断用医薬品又は医療機器に関する情報については、以下のウェブサイトから入手可能である:https://www.pmda.go.jp/review-services/drug-reviews/review-information/cd/0001.html[17.1.36参照]
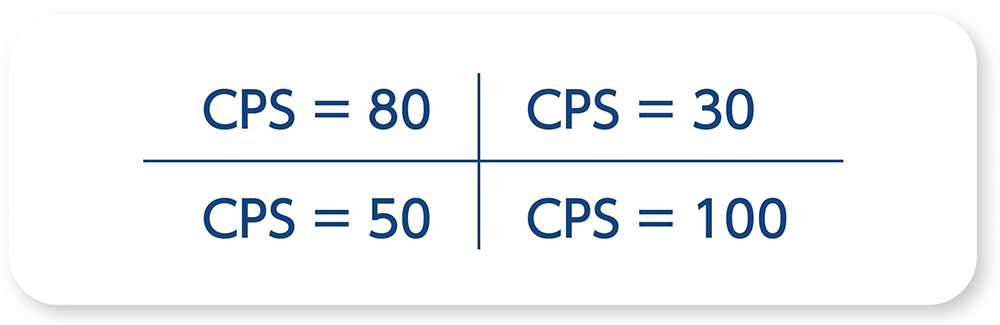
HER2陰性の胃癌では国際共同第Ⅲ相試験(KEYNOTE-859試験)で用いられたカットオフ値(CPS<1、1≦CPS<10、CPS≧10)に基づいて治療方針が検討される場合があり、CPSにかかわらずキイトルーダ®+化学療法併用療法が使用可能です。HER2陽性の胃癌では、PD-L1検査を行い、国際共同第Ⅲ相試験(KEYNOTE-811試験)で用いられたカットオフ値(CPS<1、CPS≧1)に基づいて、CPS≧1が確認された場合に、キイトルーダ®+トラスツズマブ+化学療法併用療法が使用可能です。

CPSの算出には、以下に示す計算式を用います。
CPSはTPSと異なり、浸潤癌巣で判定します。

※:CPSの評価において、分子あるいは分母に組み入れる細胞あるいは除外する細胞の種類については、こちらをご参照ください。

参考:TPS(Tumor Proportion Score)の計算式

Ⅳ期非小細胞肺癌におけるPD-L1検査では、TPSが指標として用いられており、腫瘍細胞のみが評価対象細胞となっています。
CPSの評価において、計算式の分子あるいは分母に組み入れる細胞あるいは除外する細胞の種類は以下の表に示す通りです。また、各種細胞におけるPD-L1の染色像については、こちらをご参照ください。
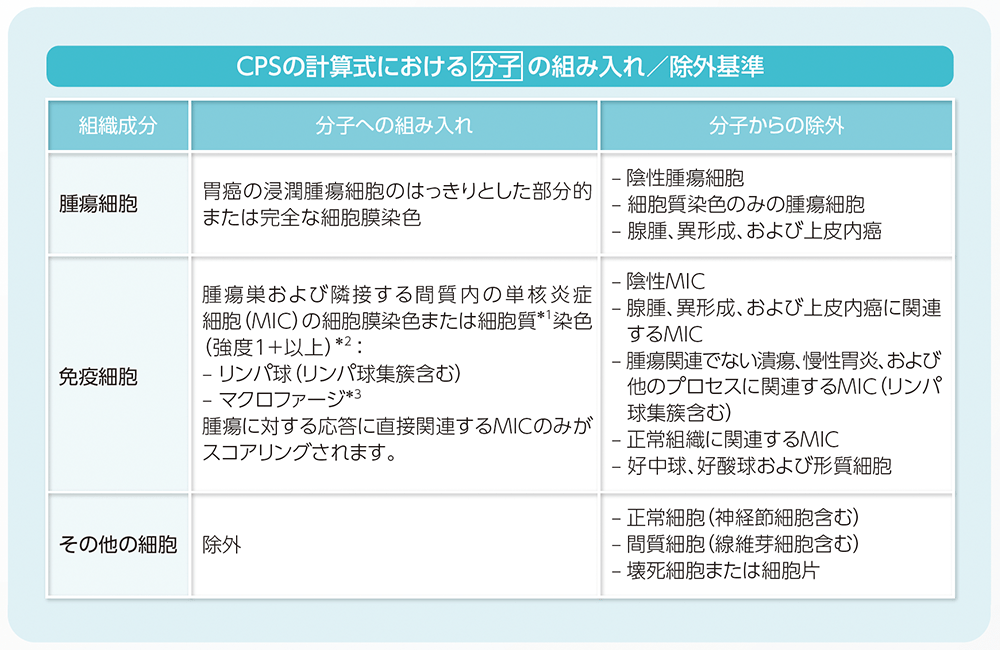
*1 MICでは、細胞質に対する細胞核の比率が高いため、多くの場合細胞膜染色と細胞質染色とは判別不能です。
このため、MICの細胞膜染色または細胞質染色はCPSの分子に含めます。
*2 隣接するMICは腫瘍と同じ20倍視野内にあると定義されます。しかし、腫瘍に対する反応に直接関連しないMICは除外されます。
*3 マクロファージと組織球は同じ細胞と考えられます。
①染色陽性細胞が認められる領域におけるCPSを算出する。
※:腫瘍細胞、リンパ球、マクロファージを含む
②すべての腫瘍領域におけるCPSを算出する(染色陽性細胞が認められる領域が全体を占める割合を除する)。


①陽性細胞数が等しくなるように腫瘍領域を複数の領域に分け、各領域におけるCPSを算出する。
②分けた領域数を考慮してCPSを算出する(本例は4領域に分けられている)。

引用文献
1)承認時評価資料:国際共同第Ⅲ相試験(KEYNOTE-859試験)
2)Rha SY et al. Lancet Oncol 2023; 24: 1181-1195
本試験はMSD社の資金提供により行われた。著者にMSD社より顧問料などを受領している者が含まれる。著者にMSD社の社員が含まれる。
3)電子添文改訂時評価資料:国際共同第Ⅲ相試験(KEYNOTE-811試験)
4)Janjigian YY et al. Lancet 2023; 402: 2197-2208
5)Janjigian YY et al. Nature 2021; 600: 727-730
本試験はMSD社の資金提供により行われた。著者にMSD社より顧問料などを受領している者が含まれる。著者にMSD社の社員が含まれる。
6)PD-L1 IHC 22C3 pharmDx「ダコ」胃癌染色結果判定マニュアル
7)PD-L1 IHC 22C3 pharmDx「ダコ」(Code No. SK006)電子添文

2025年5⽉、キイトルーダ®は、胃癌の1次治療において免疫チェックポイント阻害剤としては初めて、HER2陽性*・陰性に関わらず「治癒切除不能な進行・再発胃癌」 […]

キイトルーダ®は2025年5月より、HER2陽性*・陰性に関わらず「治癒切除不能な進行・再発胃癌」患者の1次治療に対して投与が可能となりました。 本動画では、P […]




WEB講演会にアクセスし「このページは閲覧を制限しています」と表示された方は こちら>>
このサイトでは、医療用医薬品を適正にご使用いただくため、医師、歯科医師及び薬剤師などの医療関係者の方を対象に、主としてMSD株式会社の医療用医薬品に関する情報を提供しています。
下記の「はい」をクリックした場合、「MSD Connect ご利用規約」及び「ウェブサイトのご利用条件」を理解したうえで、内容に同意したものとみなします。
2024年11月にご利用規約を改訂致しました。上記リンクよりご確認ください。
あなたは医療関係者ですか?