国際共同第Ⅲ相試験:KEYNOTE-826試験
子宮頸癌:国際共同臨床試験成績
国際共同第Ⅲ相試験<KEYNOTE-826試験>
承認時評価資料:国際共同第Ⅲ相試験(KEYNOTE-826試験)
Colombo N et al. N Engl J Med 2021; 385: 1856-1867
本試験はMSD社の資金提供により行われた。著者のうち、Sarper Toker、Kan Li、Stephen M Keefeは同社の社員である。
試験概要
【目的】
化学療法未治療(放射線増感剤としての使用は除く)の手術又は放射線療法による根治治療の対象とならない進行又は再発の子宮頸癌患者におけるキイトルーダ®と化学療法±ベバシズマブ併用群と、プラセボと化学療法±ベバシズマブ併用群の有効性及び安全性を比較検討する。
【デザイン】
国際共同無作為化二重盲検第Ⅲ相試験[優越性試験][第1回中間解析結果(データカットオフ日:2021年5月3日)]
【対象】
化学療法未治療の手術又は放射線療法による根治治療の対象とならない進行又は再発の子宮頸癌患者617例(日本人57例を含む)
【方法】
キイトルーダ®と化学療法±ベバシズマブ併用群(以下、キイトルーダ®併用群:キイトルーダ®200mg+パクリタキセル175mg/m2+シスプラチン50mg/m2又はカルボプラチンAUC5に相当する量±ベバシズマブ15mg/kgを3週間間隔(Q3W)で点滴静注)又はプラセボと化学療法±ベバシズマブ併用群(以下、プラセボ併用群:プラセボ+パクリタキセル175mg/m2+シスプラチン50mg/m2又はカルボプラチンAUC5に相当する量±ベバシズマブ15mg/kgをQ3Wで点滴静注)に1:1の割合で無作為に割り付けた。画像診断を無作為割り付けから54週時までは9週間間隔、その後は12週間間隔で実施又は臨床的に必要な場合はより頻回に行い、疾患進行、許容できない有害事象の発現等による投与中止又は投与完了まで継続した(キイトルーダ®及びプラセボ投与は最大35サイクル、パクリタキセル及びシスプラチン、カルボプラチン投与は最大6サイクル)*1。
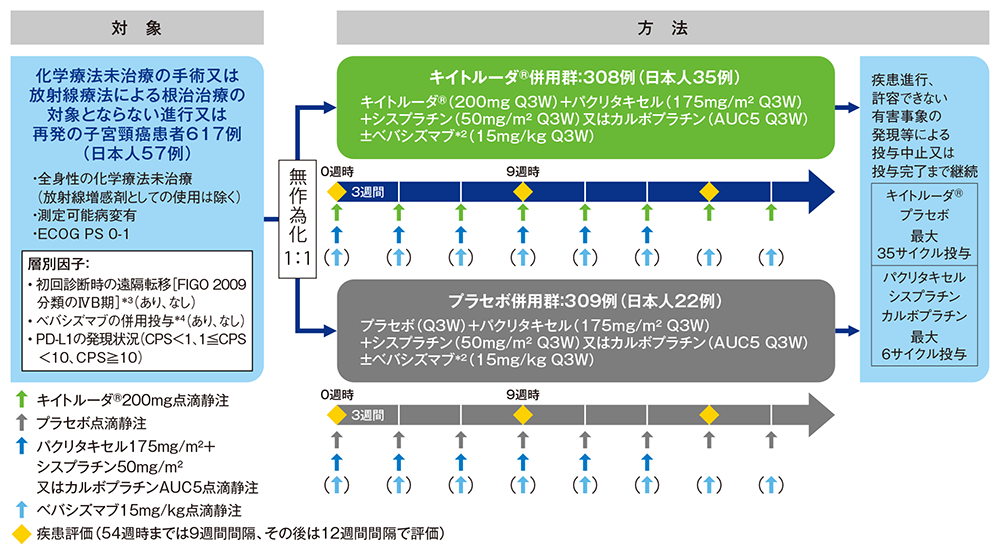
*1 パクリタキセル及びシスプラチン、カルボプラチンは、臨床的ベネフィットが継続し、投与が許容可能な患者は、治験依頼者と協議のうえ、6サイクルを超える投与が許容されることもある
*2 ベバシズマブは、疾患進行又は許容できない有害事象の発現まで投与可能とした
*3 FIGO 2009分類では傍大動脈リンパ節転移はⅣB期に含まれるが、FIGO 2018分類では傍大動脈リンパ節転移はⅣB期に含まれない
本治験では、初回診断時の傍大動脈リンパ節転移を遠隔転移として扱う
*4 ベバシズマブの併用投与の有無は無作為化割り付け前の治験担当医師選択によるもの
【評価項目】
主要評価項目:全生存期間(overall survival:OS)※及び無増悪生存期間(progression free survival:PFS)※
副次評価項目:奏効率(overall response rate:ORR)、奏効期間(duration of response:DOR)、12ヵ月PFS率及び安全性など
探索的評価項目:EuroQoL EQ-5D-5Lなど
※検証的解析項目
【判定基準】
主要評価項目のPFS、副次評価項目のORR、DOR及び12ヵ月PFS率は治験担当医師がRECISTガイドライン1.1版に基づき評価した。EuroQoL EQ-5D-5Lなどを用いて健康関連QOLに関する患者報告アウトカム(patient reported outcome:PRO)が評価された。
【解析計画】
解析対象集団:有効性はITT集団*5、健康関連QOLはPRO FAS集団*6、安全性はAPaT集団*7を解析対象とした。
有効性評価の統計手法:OS、PFS及び12ヵ月PFS率はKaplan-Meier法を用いて生存曲線を推定した。OS及びPFSの群間比較は層別ログランク検定を用いて評価し、投与群を共変量とした層別Cox比例ハザードモデルを用いて、ハザード比及びその95%信頼区間を算出した。ORRの群間比較には層別Miettinen and Nurminen法を用いた。層別ログランク検定、層別Cox比例ハザードモデル及び層別Miettinen and Nurminen法の層別因子には、無作為割り付けに用いた層別因子を用いた。また、層別Cox比例ハザードモデルを用いて、初回診断時の遠隔転移の有無(あり、なし)、ベバシズマブ併用投与の有無(あり、なし)、PD-L1の発現状況(CPS*8<1、1≦CPS<10、CPS≧10)、年齢(65歳未満、65歳以上)、人種(白人、白人以外)、ECOG PS(0、1)別のサブグループ解析を実施した。日本人集団は、全体集団と同様の解析手法により解析したが、層での調整については行わなかった。
健康関連QOLに関するPRO評価の統計手法:EQ-5D-5L VASスコア悪化までの期間はKaplan-Meier法を用いて生存曲線を推定し、投与群を共変量とした層別Cox比例ハザードモデルを用いて、ハザード比及びその95%信頼区間を算出した。層別Cox比例ハザードモデルの層別因子には、無作為割り付けに用いた層別因子を用いた。
仮説:本試験では6つの仮説[H1:PD-L1発現陽性(CPS≧1)患者のPFS、H2:全体集団のPFS、H3:PD-L1発現陽性(CPS≧10)患者のPFS、H4:PD-L1発現陽性(CPS≧1)患者のOS、H5:全体集団のOS、H6:PD-L1発現陽性(CPS≧10)患者のOS]検定のいずれかで有意差が示された場合、成功したものとみなした。
多重性の調整:本試験では2回の有効性の中間解析を事前に計画し、PFSは2回目の中間解析を最終解析とし、OSは2回の中間解析及び最終解析を実施することとした。全体集団、PD-L1発現陽性(CPS≧1)患者及びPD-L1発現陽性(CPS≧10)患者でのOS及びPFSの全体の有意水準は片側2.5%となるように厳密に制御した。これらの多重性の調整には、Maurer & Bretzのgraphical approachを用いた。まず、有意水準をH1に片側0.4%、H3に片側0.1%、H4に片側1.6%、H6に片側0.4%を配分する。H1が統計学的に有意であった場合、有意水準をH2に再配分し、H2が統計学的に有意であった場合、有意水準をH3に再配分する。H3が統計学的に有意であった場合、有意水準をH4及びH6に5割ずつ再配分する。H4が統計学的に有意であった場合、有意水準をH5に再配分し、H5が統計学的に有意であった場合、有意水準をH6に再配分する。H6が統計学的に有意であった場合、有意水準をH1及びH3に5割ずつ再配分する。中間解析と最終解析における有意水準の配分には、α消費関数を用いた。
*5 ITT(intention to treat)集団:無作為化されたすべての患者
*6 PRO FAS(full analysis set)集団:1回以上治験薬を投与され、かつ、1つ以上のPRO評価がある患者
*7 APaT(all participants as treated)集団:無作為化され治験薬を1回以上投与されたすべての患者
*8 CPS(combined positive score):PD-L1発現陽性細胞数(腫瘍細胞、リンパ球及びマクロファージ)を総腫瘍細胞数で除し、100を乗じた数値
5. 効能又は効果に関連する注意(抜粋)〈進行又は再発の子宮頸癌〉
5.30 本剤の有効性は、PD-L1発現率(CPS)により異なる傾向が示唆されている。CPSについて、 「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。[17.1.27参照]
5.31 本剤の術後補助療法における有効性及び安全性は確立していない。
シスプラチンの用法及び用量は以下のとおりです。
6. 用法・用量(抜粋)〈シスプラチン通常療法〉
子宮頸癌には、A法を標準的用法・用量とし、患者の状態によりE法を選択する。
A法:シスプラチンとして15~20mg/m2(体表面積)を1日1回、5日間連続投与し、少なくとも2週間休薬する。これを1クールとし、投与を繰り返す。
E法:シスプラチンとして70~90mg/m2(体表面積)を1日1回投与し、少なくとも3週間休薬する。これを1クールとし、投与を繰り返す。
カルボプラチンの用法及び用量は以下のとおりです。
6. 用法及び用量(抜粋)
<頭頸部癌、肺小細胞癌、睾丸腫瘍、卵巣癌、子宮頸癌、悪性リンパ腫、非小細胞肺癌>
通常、成人にはカルボプラチンとして、1日1回300~400mg/m2(体表面積)を投与し、少なくとも4週間休薬する。これを1クールとし、投与を繰り返す。なお、投与量は、年齢、疾患、症状により適宜増減する。
患者背景(ITT集団)
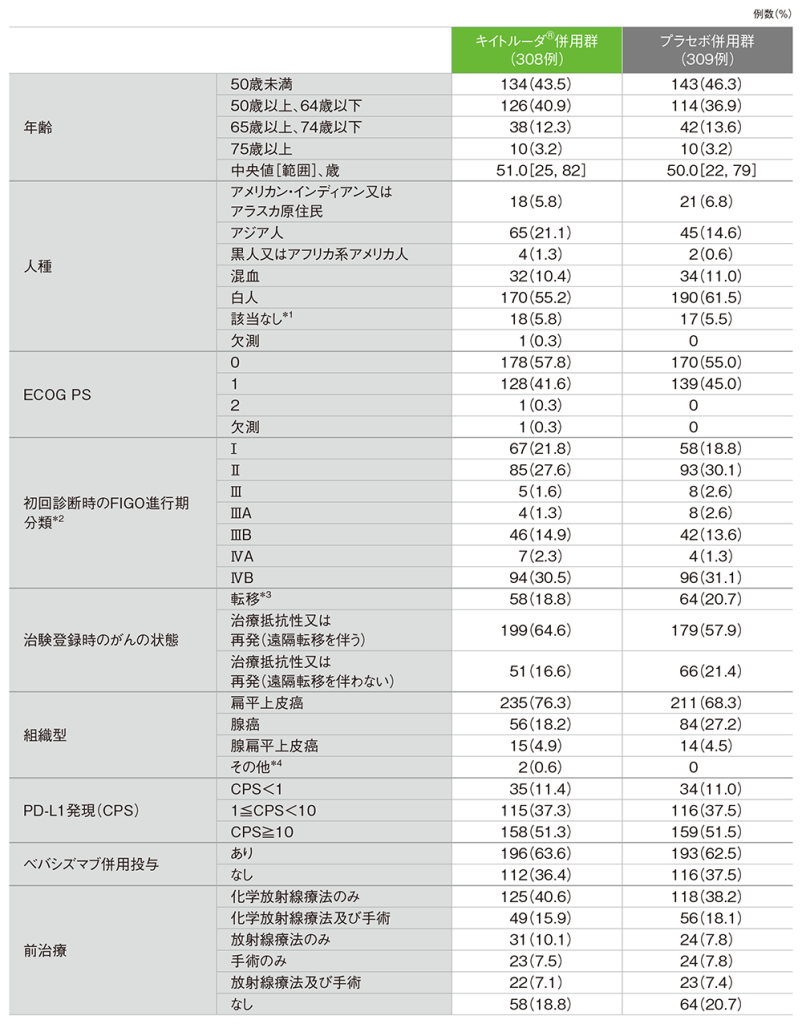
*1 法律により人種の申告が不可であった患者
*2 FIGO 2009/NCCN 2017 基準によって定義された
*3 子宮頸癌に対するいかなる治療も受けていない、遠隔転移を有する(ステージⅣB期)患者。傍大動脈リンパ節転移のある患者を含む(注)
*4 epidermoid carcinoma、undifferentiated carcinoma 各1例を含む
注: FIGO 2009分類では傍大動脈リンパ節転移はⅣB期に含まれるが、FIGO 2018分類では傍大動脈リンパ節転移はⅣB期に含まれない
本治験では、初回診断時の傍大動脈リンパ節転移を遠隔転移として扱う
主要評価項目:全生存期間(OS)(優越性試験)
■全体集団における全生存期間: OS
OSのKaplan-Meier曲線(ITT集団)
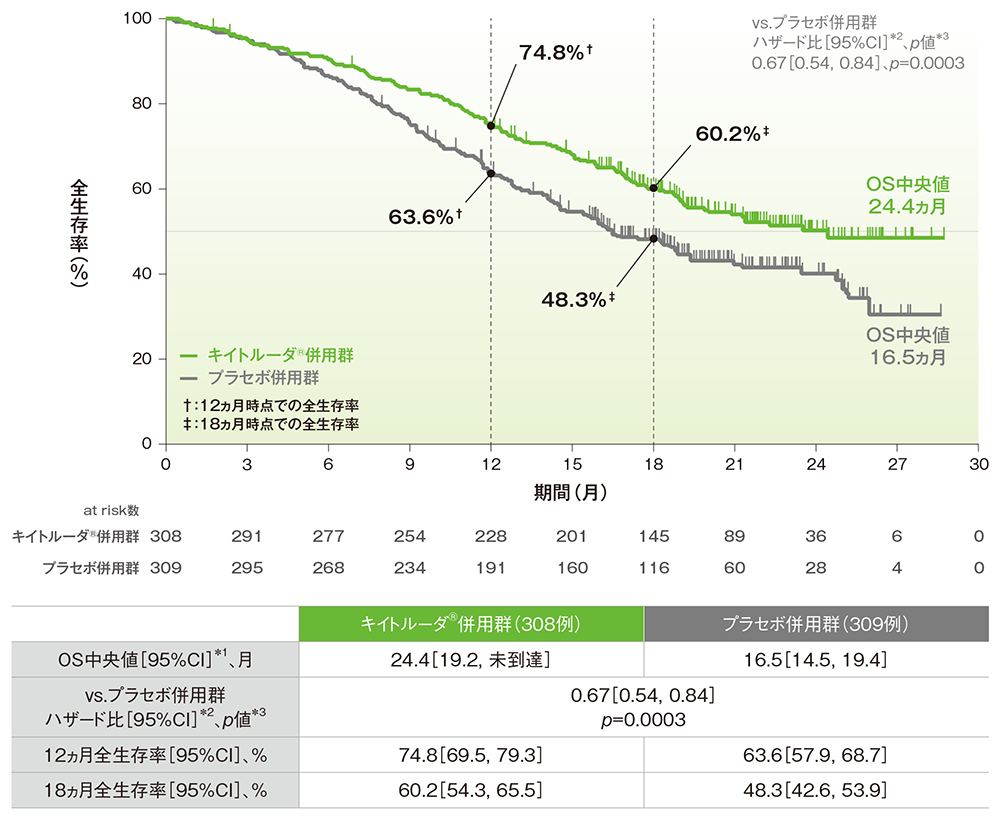
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、無作為化に用いた層別因子[初回診断時の遠隔転移(あり、なし)、ベバシズマブの併用投与(あり、なし)、PD-L1の発現状況(CPS<1、1≦CPS<10、CPS≧10)]を層別因子とした層別Cox比例ハザードモデルに基づく
*3 無作為化に用いた層別因子を層別因子とした層別ログランク検定[片側]、有意水準α=0.0049074(検証的解析結果)
(追跡期間中央値:キイトルーダ®併用群 18.2ヵ月、プラセボ併用群 16.3ヵ月、データカットオフ日:2021年5月3日)
■PD-L1発現陽性(CPS≧1)患者における全生存期間:OS
OSのKaplan-Meier曲線(ITT集団)
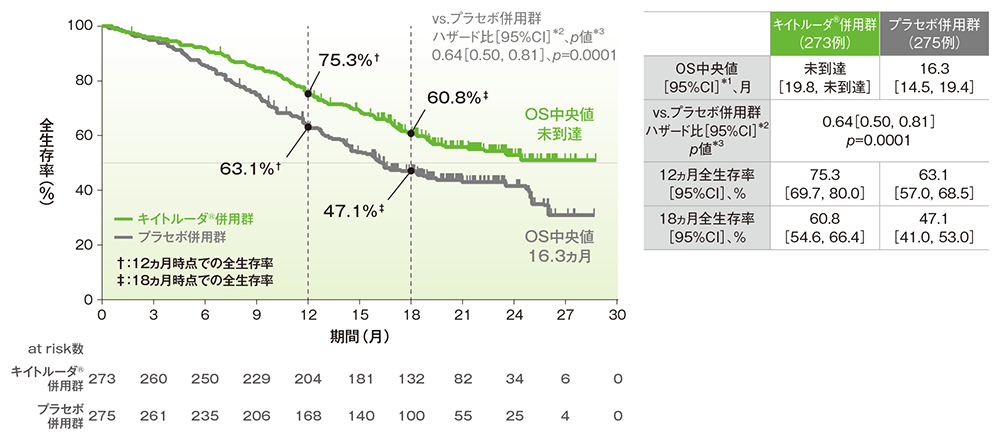
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、無作為化に用いた層別因子[初回診断時の遠隔転移(あり、なし)、ベバシズマブの併用投与(あり、なし)、PD-L1発現状態(CPS<1、1≦CPS<10、CPS≧10)]を層別因子とした層別Cox比例ハザードモデルに基づく
*3 無作為化に用いた層別因子を層別因子とした層別ログランク検定[片側]、有意水準α=0.0054906(検証的解析結果)
(追跡期間中央値:キイトルーダ®併用群 18.3ヵ月、プラセボ併用群 16.3ヵ月、データカットオフ日:2021年5月3日)
■PD-L1発現陽性(CPS≧10)患者における全生存期間: OS
OSのKaplan-Meier曲線(ITT集団)
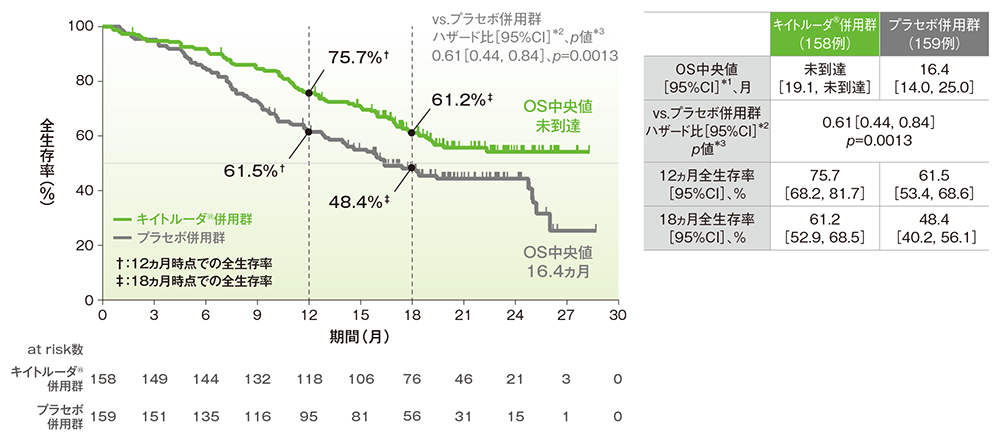
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、無作為化に用いた層別因子[初回診断時の遠隔転移(あり、なし)、ベバシズマブの併用投与(あり、なし)、PD-L1発現状態(CPS<1、1≦CPS<10、CPS≧10)]を層別因子とした層別Cox比例ハザードモデルに基づく
*3 無作為化に用いた層別因子を層別因子とした層別ログランク検定[片側]、有意水準α=0.0114504(検証的解析結果)
(追跡期間中央値:キイトルーダ®併用群 18.3ヵ月、プラセボ併用群 16.3ヵ月、データカットオフ日:2021年5月3日)
サブグループ解析:全生存期間:OS(PD-L1発現陰性〔CPS<1〕患者)※
※ PD-L1発現陰性(CPS<1)患者におけるOS、PFSは治験実施計画書に記載されていないが、評価資料として承認時に評価されたため記載した
■PD-L1発現陰性(CPS<1)患者における全生存期間: OS
*1 投与群を共変量とし、無作為化に用いた層別因子[初回診断時の遠隔転移(あり、なし)、ベバシズマブの併用投与(あり、なし)、PD-L1発現状態(CPS<1、1≦CPS<10、CPS≧10)]を層別因子とした層別Cox比例ハザードモデルに基づく
*2 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
サブグループ解析:部分集団因子別の全生存期間(OS)
■全体集団におけるOSのフォレストプロット(ITT集団)
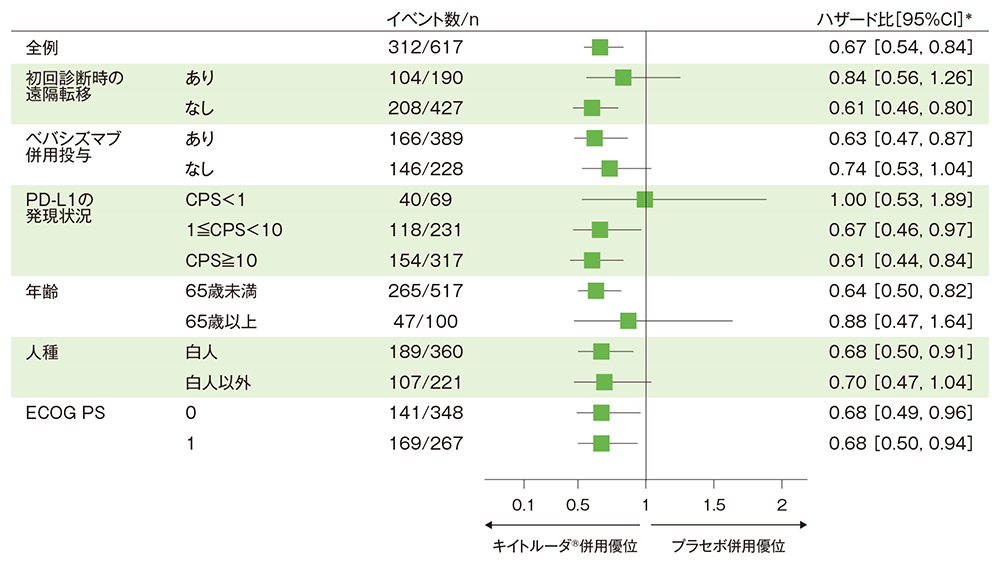
* 投与群を共変量とし、無作為化に用いた層別因子[初回診断時の遠隔転移(あり、なし)、ベバシズマブの併用投与(あり、なし)、PD-L1の発現状況(CPS<1、1≦CPS<10、CPS≧10)]を層別因子とした層別Cox比例ハザードモデルに基づく
(追跡期間中央値:キイトルーダ®併用群 18.2ヵ月、プラセボ併用群 16.3ヵ月、データカットオフ日:2021年5月3日)
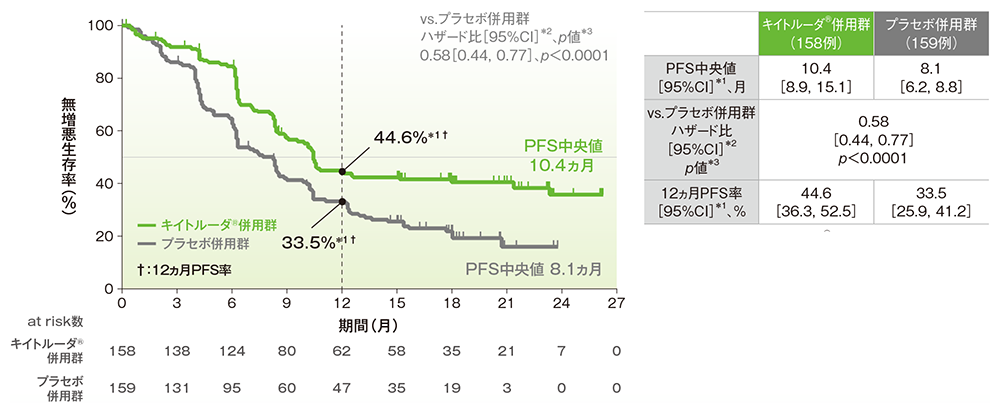
主要評価項目:無増悪生存期間(PFS)(優越性試験)、副次評価項目:12ヵ月PFS率
■全体集団における無増悪生存期間: PFS
■全体集団における12ヵ月PFS率
PFSのKaplan-Meier曲線(ITT集団)
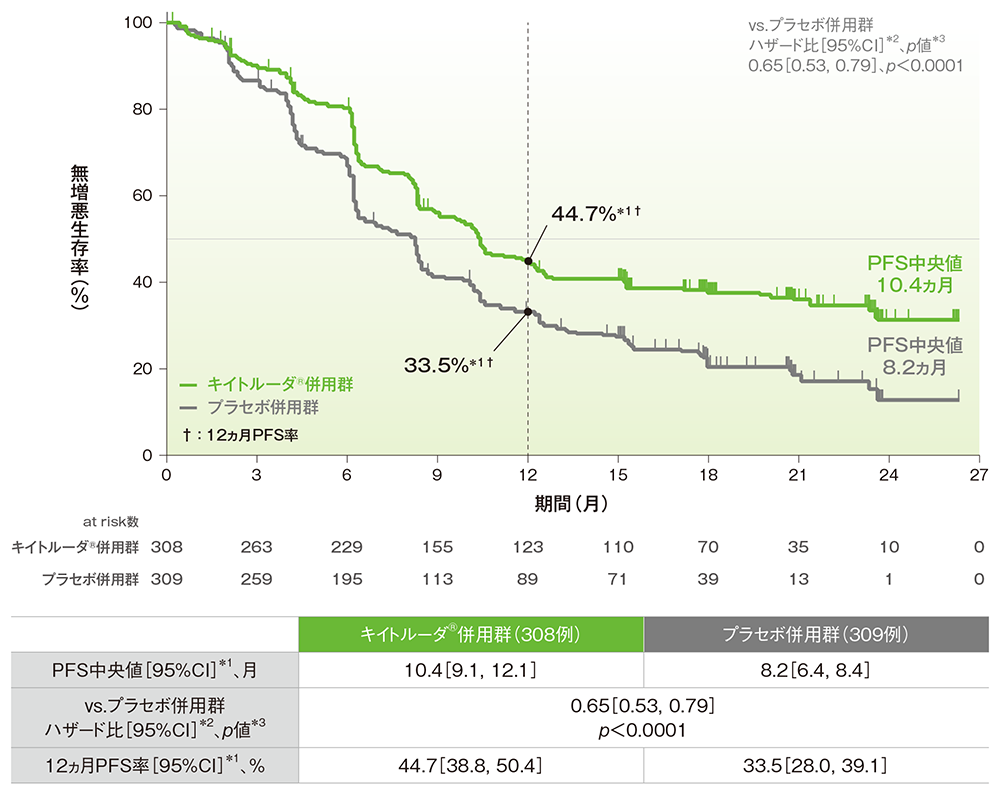
治験担当医師によるRECISTガイドライン1.1版に基づいた評価
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、無作為化に用いた層別因子[初回診断時の遠隔転移(あり、なし)、ベバシズマブの併用投与(あり、なし)、PD-L1の発現状況(CPS<1、1≦CPS<10、CPS≧10)]を層別因子とした層別Cox比例ハザードモデルに基づく
*3 無作為化に用いた層別因子を層別因子とした層別ログランク検定[片側]、有意水準α=0.0012843(検証的解析結果)
(追跡期間中央値:キイトルーダ®併用群 18.2ヵ月、プラセボ併用群 16.3ヵ月、データカットオフ日:2021年5月3日)
■PD-L1発現陽性(CPS≧1)患者における無増悪生存期間: PFS
■PD-L1発現陽性(CPS≧1)患者における12ヵ月PFS率
PFSのKaplan-Meier曲線(ITT集団)
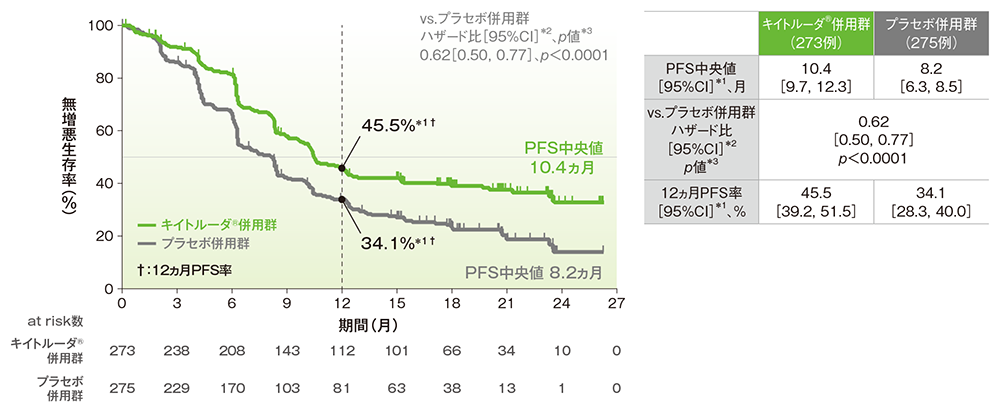
治験担当医師によるRECISTガイドライン1.1版に基づいた評価
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、無作為化に用いた層別因子[初回診断時の遠隔転移(あり、なし)、ベバシズマブの併用投与(あり、なし)、PD-L1発現状態(CPS<1、1≦CPS<10、CPS≧10)]を層別因子とした層別Cox比例ハザードモデルに基づく
*3 無作為化に用いた層別因子を層別因子とした層別ログランク検定[片側]、有意水準α=0.0014426(検証的解析結果)
(追跡期間中央値:キイトルーダ®併用群 18.3ヵ月、プラセボ併用群 16.3ヵ月、データカットオフ日:2021年5月3日)
■PD-L1発現陽性(CPS≧10)患者における無増悪生存期間: PFS
■PD-L1発現陽性(CPS≧10)患者における12ヵ月PFS率
PFSのKaplan-Meier曲線(ITT集団)
治験担当医師によるRECISTガイドライン1.1版に基づいた評価
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、無作為化に用いた層別因子[初回診断時の遠隔転移(あり、なし)、ベバシズマブの併用投与(あり、なし)、PD-L1発現状態(CPS<1、1≦CPS<10、CPS≧10)]を層別因子とした層別Cox比例ハザードモデルに基づく
*3 無作為化に用いた層別因子を層別因子とした層別ログランク検定[片側]、有意水準α=0.0019593(検証的解析結果)
(追跡期間中央値:キイトルーダ®併用群 18.3ヵ月、プラセボ併用群 16.3ヵ月、データカットオフ日:2021年5月3日)
サブグループ解析:無増悪生存期間:PFS(PD-L1発現陰性〔CPS<1〕患者)※
※ PD-L1発現陰性(CPS<1)患者におけるOS、PFSは治験実施計画書に記載されていないが、評価資料として承認時に評価されたため記載した
■PD-L1発現陰性(CPS<1)患者における無増悪生存期間: PFS
*1 投与群を共変量とし、無作為化に用いた層別因子[初回診断時の遠隔転移(あり、なし)、ベバシズマブの併用投与(あり、なし)、PD-L1発現状態(CPS<1、1≦CPS<10、CPS≧10)]を層別因子とした層別Cox比例ハザードモデルに基づく
*2 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
サブグループ解析:部分集団因子別の無増悪生存期間(PFS)
■全体集団におけるPFSのフォレストプロット(ITT集団)
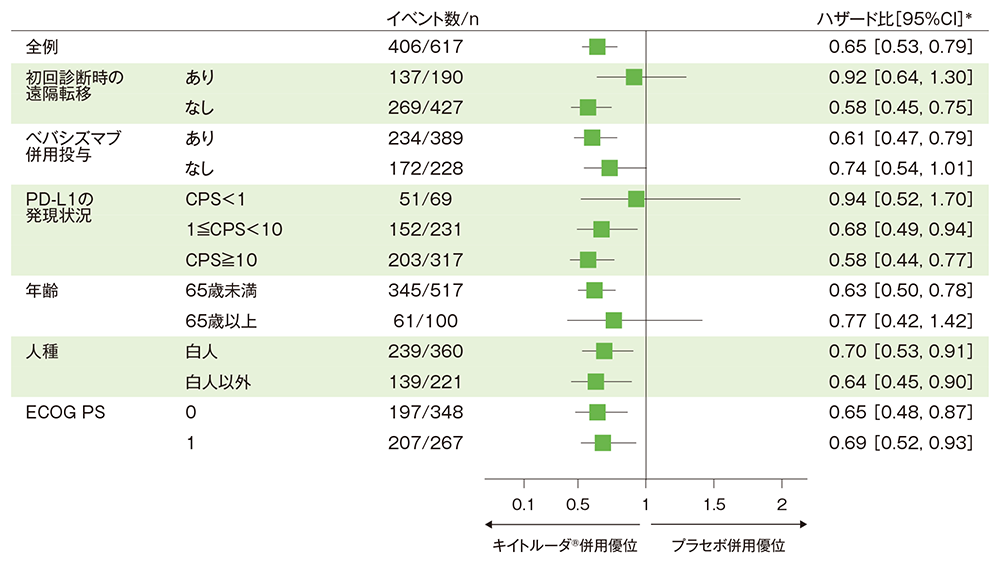
治験担当医師によるRECISTガイドライン1.1版に基づいた評価
* 投与群を共変量とし、無作為化に用いた層別因子[初回診断時の遠隔転移(あり、なし)、ベバシズマブの併用投与(あり、なし)、PD-L1の発現状況(CPS<1、1≦CPS<10、CPS≧10)]を層別因子とした層別Cox比例ハザードモデルに基づく
(追跡期間中央値:キイトルーダ®併用群 18.2ヵ月、プラセボ併用群 16.3ヵ月、データカットオフ日:2021年5月3日)
安全性
キイトルーダ®併用群では、副作用は298/307例(97.1%)に認められました。主な副作用(発現率20%以上)は、脱毛症171例(55.7%)、貧血149例(48.5%)、悪心104例(33.9%)、下痢76例(24.8%)、末梢性ニューロパチー75例(24.4%)、疲労70例(22.8%)、末梢性感覚ニューロパチー69例(22.5%)、好中球減少症68例(22.1%)、嘔吐63例(20.5%)でした。重篤な副作用は93例(30.3%)に認められ、2例以上にみられた重篤な副作用は、発熱性好中球減少症21例(6.8%)、貧血7例(2.3%)、女性生殖器瘻5例(1.6%)、下痢、急性腎障害 各4例(1.3%)、好中球減少症、血小板減少症、副腎機能不全、大腸炎、尿路感染 各3例(1.0%)、汎血球減少症、胃炎、腸管穿孔、直腸穿孔、嘔吐、免疫性肝炎、敗血症、注入に伴う反応、好中球数減少、末梢性運動ニューロパチー、月経中間期出血、腟出血、斑状丘疹状皮疹 各2例(0.7%)でした。いずれかの治験薬で投与中止に至った副作用は96例(31.3%)に認められ、2例以上にみられた投与中止に至った副作用は、貧血、末梢性ニューロパチー 各7例(2.3%)、急性腎障害、蛋白尿、女性生殖器瘻 各5例(1.6%)、過敏症、高血圧 各4例(1.3%)、好中球減少症、腸管穿孔、疲労、注入に伴う反応、血小板数減少、斑状丘疹状皮疹 各3例(1.0%)、血小板減少症、大腸炎、免疫性腸炎、悪心、直腸穿孔、免疫性肝炎、薬物過敏症、アスパラギン酸アミノトランスフェラーゼ増加、血中クレアチニン増加、錯感覚、末梢性運動ニューロパチー、腟瘻 各2例(0.7%)でした。死亡に至った副作用は2例(0.7%)に認められ、内訳は、腸管穿孔、自己免疫性脳炎 各1例(0.3%)でした。
プラセボ併用群では、副作用は300/309例(97.1%)に認められました。主な副作用(発現率20%以上)は、脱毛症172例(55.7%)、貧血132例(42.7%)、悪心120例(38.8%)、末梢性感覚ニューロパチー78例(25.2%)、疲労77例(24.9%)、末梢性ニューロパチー76例(24.6%)、嘔吐66例(21.4%)でした。重篤な副作用は71例(23.0%)に認められ、2例以上にみられた重篤な副作用は、発熱性好中球減少症12例(3.9%)、貧血9例(2.9%)、女性生殖器瘻4例(1.3%)、好中球減少症、汎血球減少症、薬物過敏症、尿路感染、高血圧 各3例(1.0%)、血小板減少症、大腸炎、下痢、大腸穿孔、嘔吐、過敏症、敗血症、血尿、尿生殖器瘻、腟瘻、肺塞栓症、塞栓症 各2例(0.6%)でした。いずれかの治験薬で投与中止に至った副作用は69例(22.3%)に認められ、2例以上にみられた投与中止に至った副作用は、末梢性感覚ニューロパチー8例(2.6%)、末梢性ニューロパチー、女性生殖器瘻 各6例(1.9%)、貧血、過敏症 各4例(1.3%)、好中球減少症、薬物過敏症、注入に伴う反応、腟出血 各3例(1.0%)、血小板減少症、悪心、疲労、好中球数減少、蛋白尿、尿生殖器瘻、腟瘻 各2例(0.6%)でした。死亡に至った副作用は4例(1.3%)に認められ、内訳は、肺敗血症、塞栓症、大腸穿孔、女性生殖器瘻 各1例(0.3%)でした。
■主な副作用(いずれかの投与群で発現率5%以上)(APaT集団)
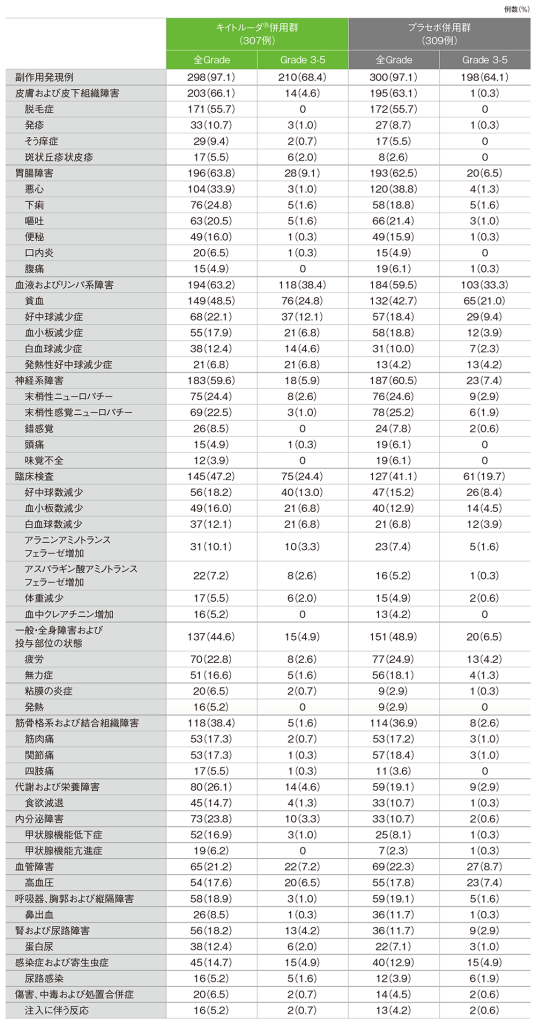
MedDRA/J v24.0、GradeはCTCAE v 4.0
(データカットオフ日:2021年5月3日)
■免疫関連など特に注目すべき有害事象(APaT集団)※
※カテゴリー別で集計
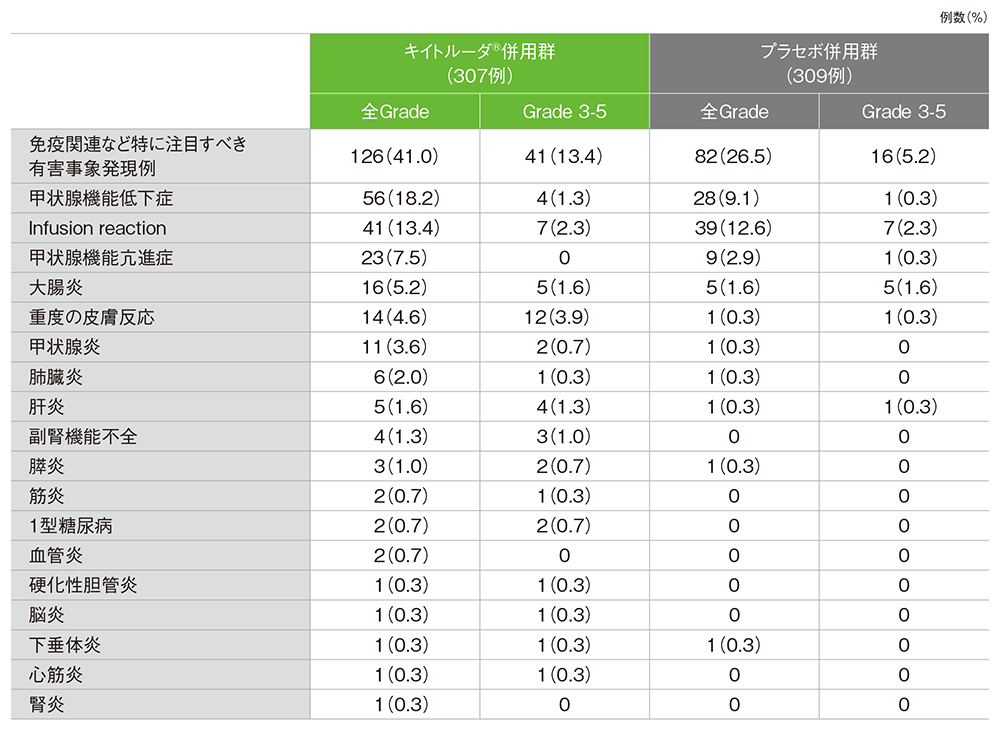
MedDRA/J v24.0、GradeはCTCAE v4.0
(データカットオフ日:2021年5月3日)