10歳未満の小児
臨床成績(10歳未満の小児)
ヘプタバックス®-Ⅱの国内第Ⅲ相臨床試験結果(小児)
国内承認外の用法・用量を含む臨床試験であるため、10歳未満への0.5mlの投与群は適応外のため削除し、承認範囲内の用法及び用量の接種群のみの結果を示します。
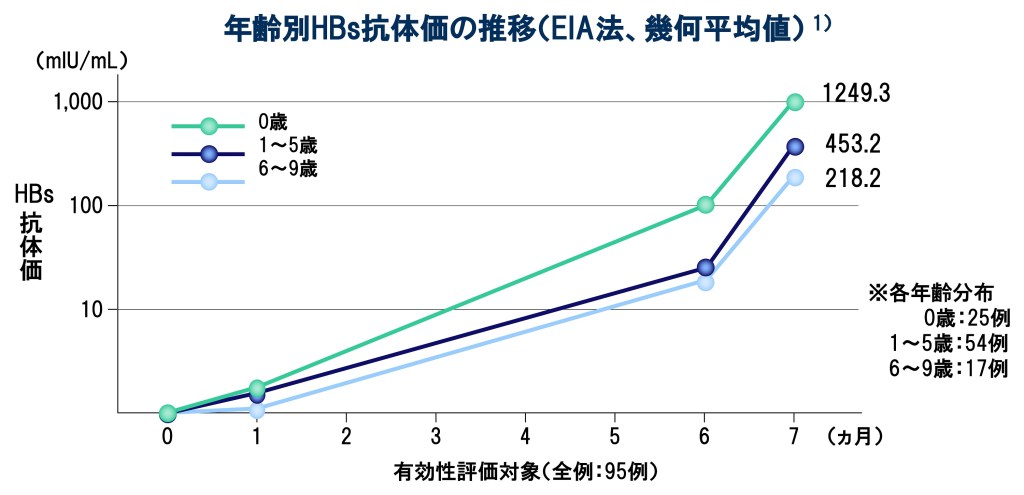
HBs抗原、HBs抗体及びHBc抗体が陰性の小児(0.25mL接種群)における3回接種後の抗体陽転率*は、100%(88/88例)を示した1)、2)。
*抗体陽転率は、測定可能なHBs抗体が検出された被接種者の割合を示すもので、B型肝炎に対する感染防御を示す被接種者の割合ではない。
安全性:副反応は全接種回数351回中のべ13例(3.7%)に発現した。主なものは局所の発赤(6件)、疼痛(4件)、硬結(3件)で、37度以上の発熱は3例に認め、その持続は1~2日であった。
【目 的】
小児におけるヘプタバックス®-Ⅱ接種の抗体反応および安全性について検討する。
【対 象】
国内6施設におけるB型肝炎ウイルス未罹患児118例
安全性評価対象例:初回118例、2回目118例、3回目115例(計351回)
有効性評価対象例:115例(初回接種後にB型肝炎ウイルス既感染が判明した2例と投与量規定違反の1例を除外)
【方 法】
ヘプタバックス®-Ⅱ※は初回、1ヵ月後、および6ヵ月後の計3回上腕外側皮下に接種し、HBs抗体を接種前、1、6、7ヵ月後に定量した(EIA法:Enzyme Immunoassay)。
【評価項目】
副反応(局所反応、全身反応出現の有無、体温)、HBVマーカー:原則としてRIA法〔HBs抗体(一部RPHA法、PHA法含む)、HBs抗体価(EIA法、幾何平均値)、HBs抗原(一部にRPHA法、PHA法含む)、HBc抗体〕など
【解析計画】
EIA法により定量したHBs抗体の抗体価(幾何平均値)を求め、その推移を有効性評価対象のうち0.25mL接種群(95例)について検討した。
※ 本試験で使用されたヘプタバックス®‐Ⅱはチメロサールを含んだ製剤である。
HBs抗体:B型肝炎ウイルスの表面(surface)抗原に対する抗体
ヘプタバックス®−II水性懸濁注シリンジ 6. 用法及び用量(抜粋)
〈B型肝炎の予防〉 通常、0.5mLずつを4週間隔で2回、更に、初回注射の20~24週後に1回0.5mLを皮下又は筋肉内に注射する。ただし、10歳未満の者には、0.25mLずつを同様の投与間隔で皮下に注射する。
ただし、能動的HBs抗体が獲得されていない場合には追加注射する。
1)中尾 亨 他 : 小児科臨床 1987 ; 40(12) : 3377-3383
2)ヘプタバックス®-Ⅱ電子添文:17.1.1 国内臨床試験より
利益相反:本試験のデザインはMSD社により作成され、すべてのステージでMSD社が全面的または部分的に関与している。