国内無作為化比較試験(MR BPA試験)
BPAとアデムパス®の直接比較試験(非盲検試験)
国内無作為化比較試験(MR BPA試験)
Kawakami T et al. Lancet Respir Med. 10, 949(2022)(COI:本研究はバイエル社の資金により実施された、著者にバイエル社及び/又はMSD社より講演料等を受領している者を含む)
プラセボ対照二重盲検比較試験(国際共同第III相試験 CHEST-1試験)
承認時評価資料:バイエル薬品社内資料[慢性血栓塞栓性肺高血圧症患者を対象とした第Ⅲ相試験]
Ghofrani HA et al. N Engl J Med. 369, 319(2013)(COI:本研究はバイエル社の資金により実施された、著者にバイエル社員(3名)を含む、著者にバイエル社より講演料等を受領している者を含む、著者にMSD社からコンサルタント料等を受領している者を含む)
6分間歩行距離のベースラインから第16週までの平均変化量(主要評価項目)(検証的解析結果)
6分間歩行距離の第16週におけるベースラインからの平均変化量は、アデムパス®群38.9m、プラセボ群-5.5mであり、アデムパス®群はプラセボ群に比べて有意な改善を示しました(最小二乗平均値の差45.69[95%信頼区間:24.74~66.63]a、p<0.0001b))。
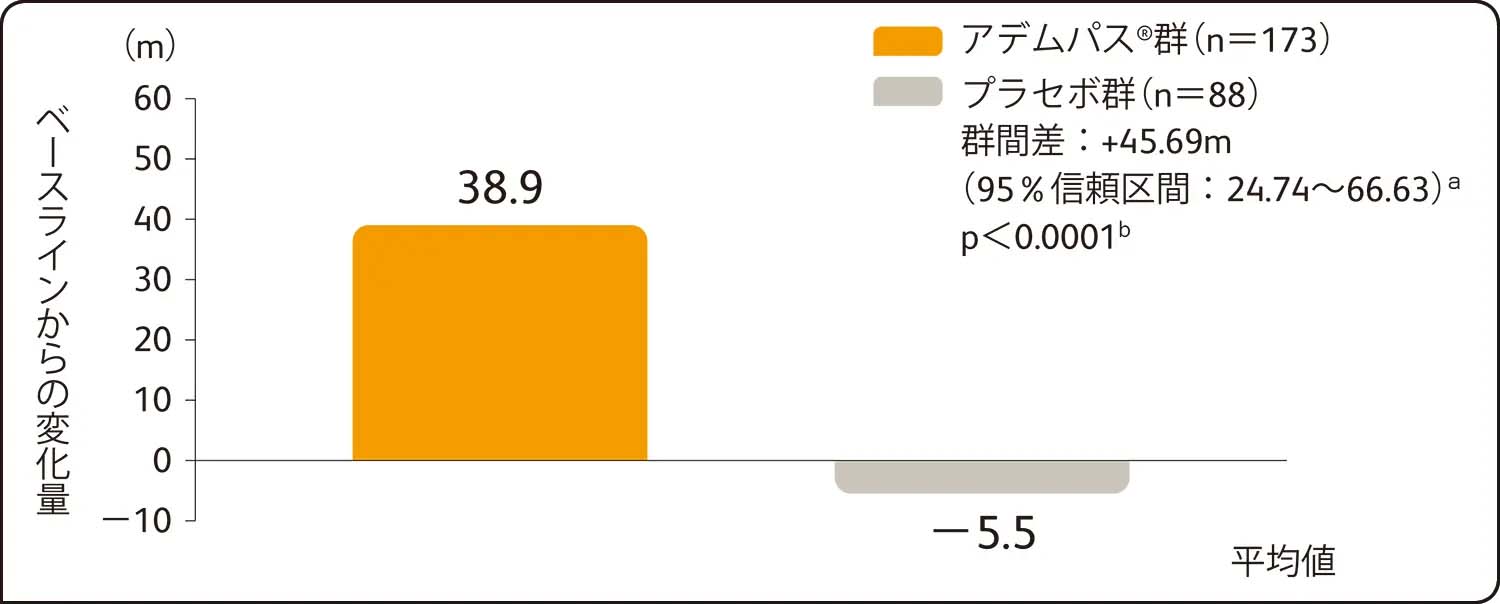
ITT解析による評価
a:ベースライン値を共変量、投与群及び国/地域を主効果とした共分散分析で算出した最小二乗平均値の差及び95%信頼区間
b:国/地域を層とした層別Wilcoxon検定
安全性
本試験において、副作用はアデムパス®群で103/173例(59.5%)、プラセボ群で36/88例(40.9%)に認められ、主な副作用(いずれかの群で5%以上に発現)は頭痛[アデムパス®群27例(15.6%) 、プラセボ群7例(8.0%) 、以降同順)、浮動性めまい[26例(15.0%)、3例(3.4%)] 、消化不良[21例(12.1%)、6例(6.8%)]、低血圧[14例(8.1%)、0例]、悪心[11例(6.4%)、5例(5.7%)]でした。
重篤な副作用は、アデムパス®群で6例(3.5%)、プラセボ群で1例(1.1%)に認められ、アデムパス®群で失神3例、胃炎、急性腎不全、低血圧がそれぞれ1例、プラセボ群で失神及び損傷が1例でした。
投与中止に至った副作用はアデムパス®群で1例(消化不良、下痢、悪心、嘔吐、頭痛)に認められました。死亡に至った副作用はアデムパス®群で1例(急性腎不全)に認められました。
試験概要
目的 慢性血栓塞栓性肺高血圧症(CTEPH)患者におけるアデムパス®の有効性及び安全性を検討
試験デザイン 多施設・国際共同、無作為化、二重盲検、プラセボ対照試験
対象 肺動脈血栓内膜摘除術不適応又は本手術後に残存・再発したCTEPH患者261例(日本人16例を含む)
試験方法 アデムパス®群又はプラセボ群に2:1の割合で割付けた後、用量調節期(8週間)としてアデムパス®1.0mg又はプラセボを1日3回投与より開始し、患者の忍容性に合わせて2週間ごとに1回0.5mgずつ、最高1回2.5mg1日3回まで増量した。その後、主治療期(8週間)として用量調節期終了時における用量を盲検下で投与し、16週間後の主要・副次的評価項目の分析を行った。
評価項目 <主要評価項目>6分間歩行距離の第16週におけるベースラインからの変化量(検証的評価項目)
<安全性の評価項目>有害事象、死亡率等
解析計画 主要評価項目において、アデムパス®群とプラセボ群の比較には、ベースラインの6分間歩行距離を共変量、投与群及び国/地域を主効果とした共分散分析を用いた。共分散分析の残差の正規性をShapiro-Wilk検定により検討し、その結果が有意水準5%で有意な場合には、国/地域を層とした層別Wilcoxon検定を用いた。第16週の欠測値はLOCFで補完した。ただし、死亡・臨床的悪化で中止来院がなかった、あるいは中止来院時の測定値がなかった場合最悪値で補完した。
4. 効能又は効果(抜粋)
○外科的治療不適応又は外科的治療後に残存・再発した慢性血栓塞栓性肺高血圧症
試験概要(MR BPA)

CTEPH(chronic thromboembolic pulmonary hypertension):慢性血栓塞栓性肺高血圧症
BPA(balloon pulmonary angioplasty):バルーン肺動脈形成術
mPAP(mean pulmonary arterial pressure):平均肺動脈圧
PVR(pulmonary vascular resistance):肺血管抵抗
RAP(right atrial pressure):右房圧
CO(cardiac output):心拍出量
BNP(brain natriuretic peptide):脳性ナトリウム利尿ペプチド
SaO2(arterial oxygen saturation):動脈血酸素飽和度
4. 効能又は効果(抜粋)
○外科的治療不適応又は外科的治療後に残存・再発した慢性血栓塞栓性肺高血圧症
試験デザイン
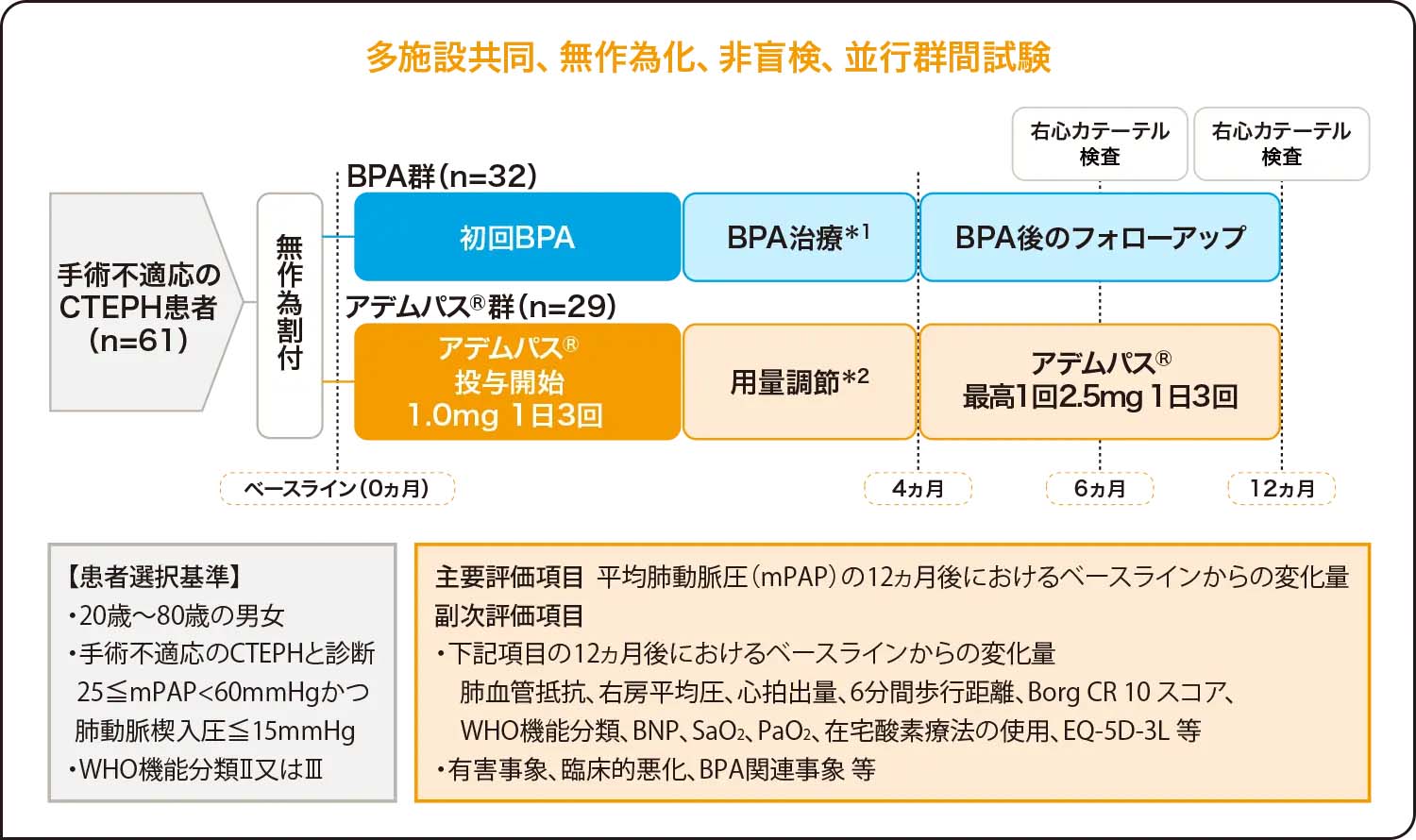
*1 mPAP25mmHg未満を目標に複数回実施
*2 アデムパス®は1回1.0mg 1日3回経口投与から開始。2週間継続して収縮期血圧が95mmHg以上で低血圧症状を示さない場合は2週間間隔で1回用量を0.5mgずつ増量するが最高用量は1回2.5mg 1日3回までとする。収縮期血圧が95mmHg未満でも低血圧症状を示さない場合は現行の用量を維持するが、低血圧症状を示す場合は1回用量を0.5mgずつ減量する。
Kawakami T et al. Lancet Respir Med. 10, 949(2022)より作図
患者背景
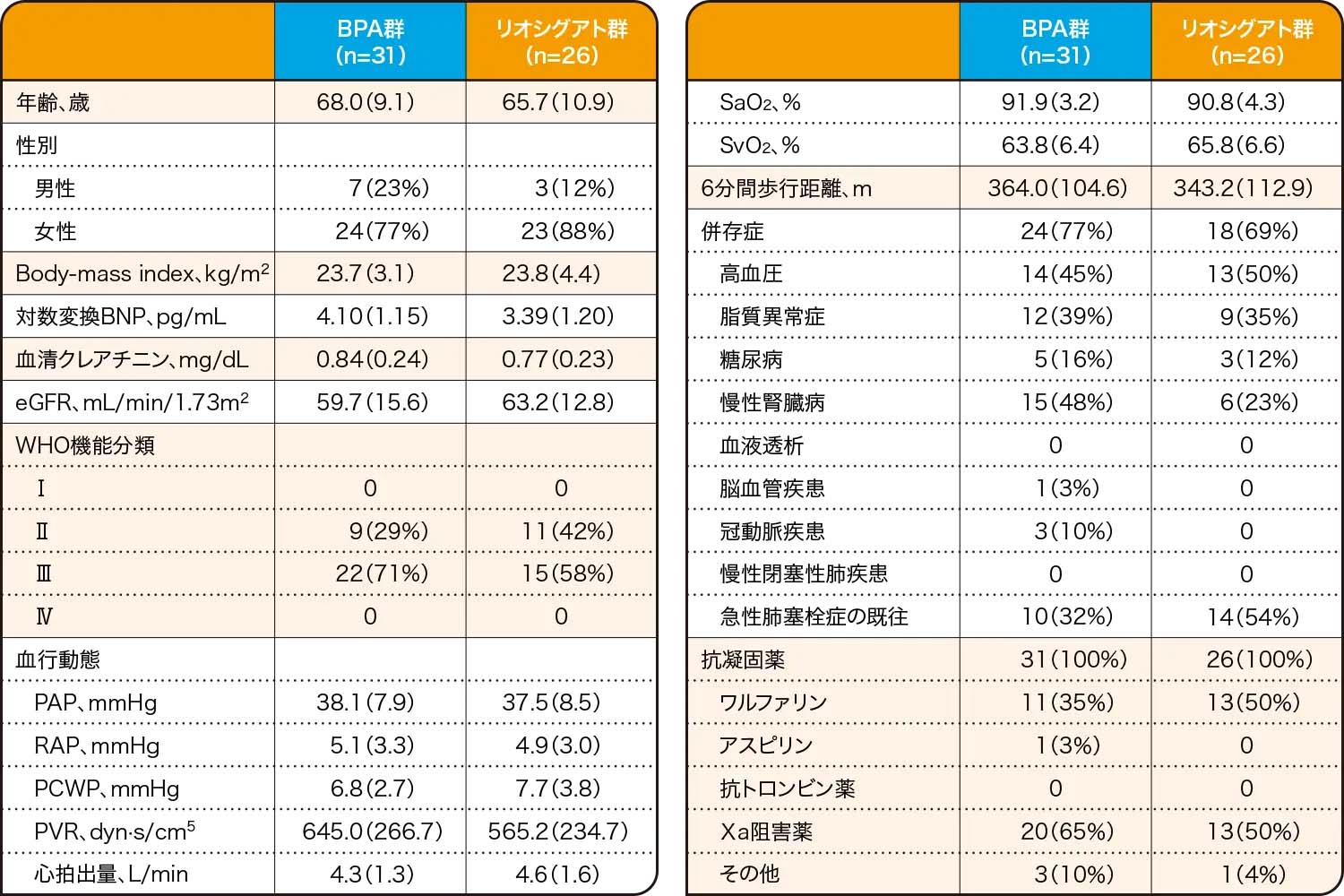
FAS、平均値(SD)又はn(%)
BNP:脳性ナトリウム利尿ペプチド、BPA:バルーン肺動脈形成術、 eGFR:推算糸球体濾過量、PAP:肺動脈圧、PCWP:肺毛細血管楔入圧、PVR:肺血管抵抗、RAP:右房圧、SaO2:動脈血酸素飽和度、SvO2:混合静脈血酸素飽和度
Kawakami T et al. Lancet Respir Med. 10, 949(2022)
Reprinted from The Lancet Respiratory Medicine, 10(10), Kawakami T, et al., Balloon pulmonary angioplasty versus riociguat in inoperable chronic thromboembolic pulmonary hypertension (MR BPA): an open-label, randomised controlled trial, 949-960., Copyright (2022), with permission from Elsevier.
有効性
BPA群ではアデムパス®群に比べて12ヵ月後のmPAP及びPVRが有意に改善
しましたが(いずれもp<0.001、ANCOVA)、心拍出量はアデムパス®群で有意な改善がみられました(p=0.0013、ANCOVA)。
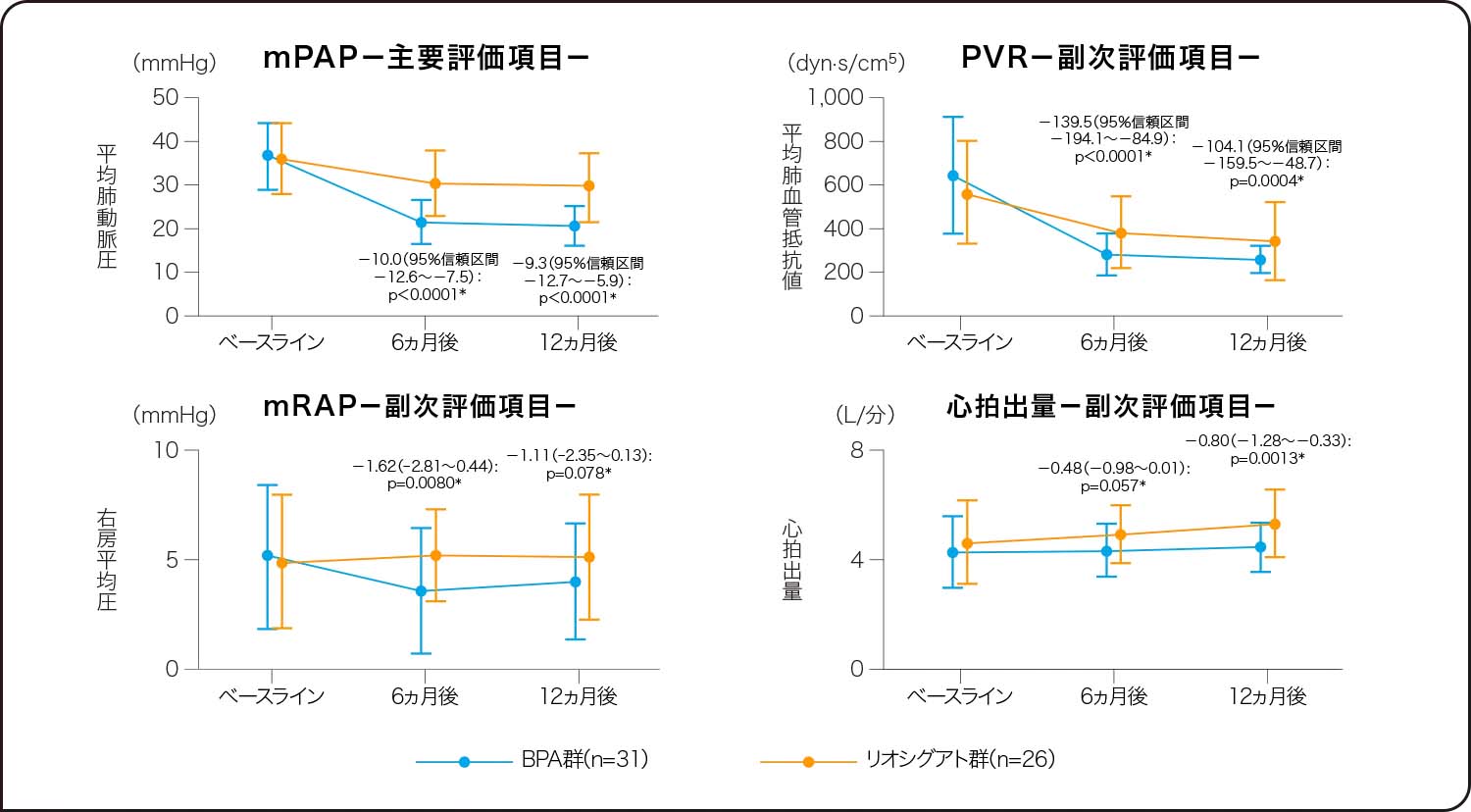
FAS、数値はベースラインからの調整平均変化量(SD)の群間差
*施設及びベースラインの各項目を共変量としたANCOVA
Kawakami T et al. Lancet Respir Med. 10, 949(2022)
Reprinted from The Lancet Respiratory Medicine, 10(10), Kawakami T, et al., Balloon pulmonary angioplasty versus riociguat in inoperable chronic thromboembolic pulmonary hypertension (MR BPA): an open-label, randomised controlled trial, 949-960., Copyright (2022), with permission from Elsevier.
安全性
- アデムパス®群の1例で臨床的悪化(PHの悪化による入院)が認められ、試験中断後にBPA治療を受けました。
- BPA関連事象はBPA群31例の計147セッション中、8例(26%)17件(12%)が認められ、その内訳は血痰・喀血又は肺出血が6例(19%)13件(9%)、NPPVの使用が1例(3%)2件(1%)、遅発性肺損傷が1例(3%)1件(1%)でした。
- 有害事象はBPA群の23例(72%)、アデムパス®群の18例(69%)に認められました。このうち重篤な有害事象はBPA群の5例(16%)、アデムパス®群の4例(15%)に認められ、その内訳はBPA群では血痰・喀血又は肺出血、急性心筋梗塞、遅発性肺損傷、左側ハント症候群、肺腺癌、脊椎圧迫骨折が各1例、アデムパス®群では肺炎、剥離骨折、結腸ポリープ、吐血が各1例でした。中止に至った有害事象は、BPA群の1例で、遅発性肺損傷が認められました。両群ともに、本試験において死亡に至った有害事象は認められませんでした。
最も多かった有害事象は、BPA群で血痰・喀血又は肺出血が14例(44%)、
アデムパス®群で頭痛が6例(23%)に認められました。
有害事象
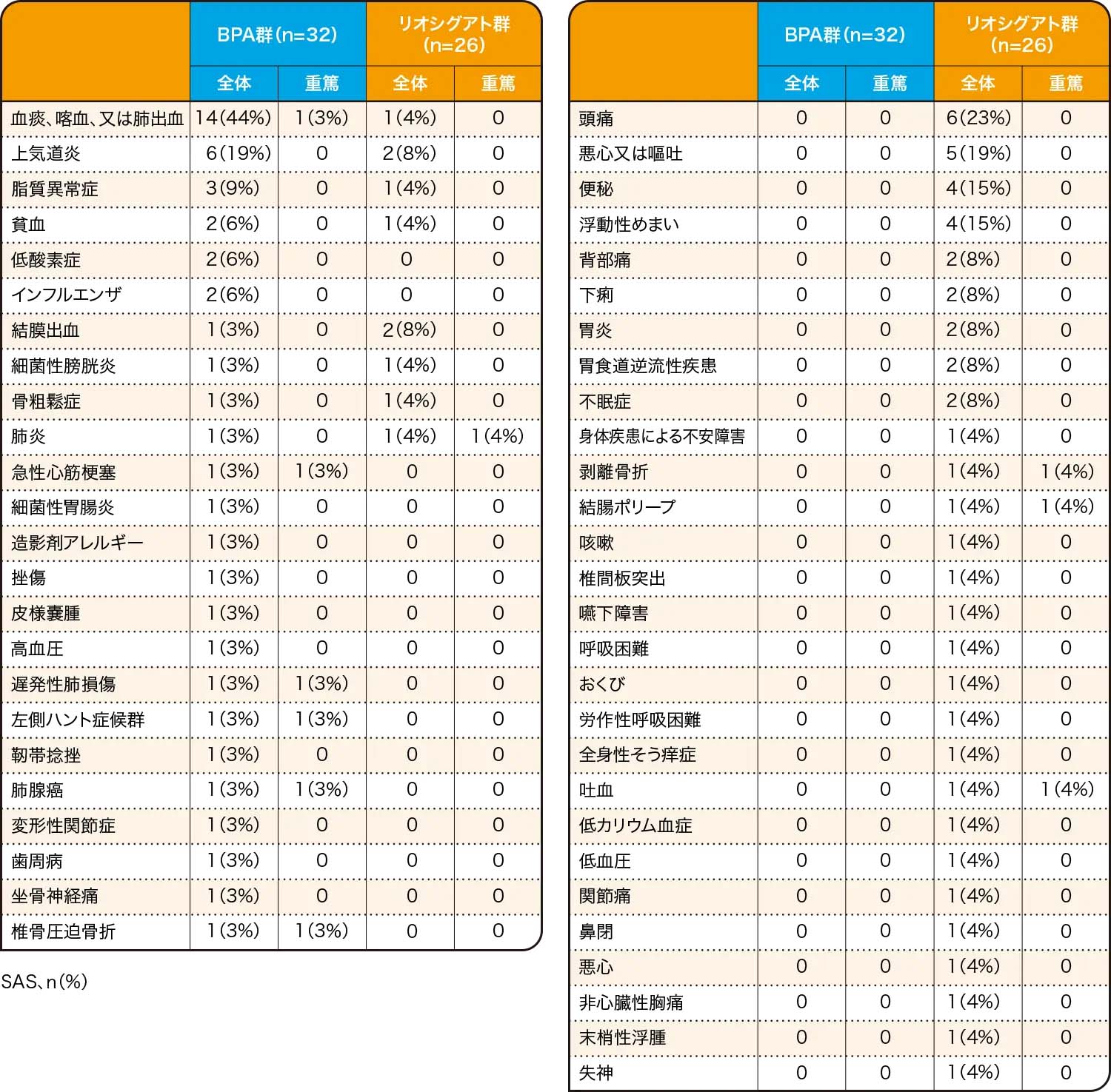
Kawakami T et al. Lancet Respir Med. 10, 949(2022)
Reprinted from The Lancet Respiratory Medicine, 10(10), Kawakami T, et al., Balloon pulmonary angioplasty versus riociguat in inoperable chronic thromboembolic pulmonary hypertension (MR BPA): an open-label, randomised controlled trial, 949-960., Copyright (2022), with permission from Elsevier.