国際共同第Ⅲ相試験:長期継続投与試験(PATENT-2試験)
PAHに対するアデムパス®の臨床成績
国際共同第Ⅲ相試験:長期継続投与試験(PATENT-2試験)
承認時評価資料:バイエル薬品社内資料[肺動脈性肺高血圧症患者を対象とした第Ⅲ相試験の長期継続投与試験]
Rubin LJ et al. Eur Respir J. 45, 1303(2015)(COI:本研究はバイエル社の資金により実施された、著者にバイエル社員(3名)を含む、著者にバイエル社より講演料等を受領している者を含む)
試験概要

PAH(pulmonary arterial hypertension):肺動脈性肺高血圧症
TID:1日3回
NT-proBNP:ヒト脳性ナトリウム利尿ペプチド前駆体N端フラグメント
†探索的用量群は比較対照群ではないため、有効性評価項目における結果は記載していない。
※ 用量調節時の指標として用いる収縮期血圧について、第Ⅲ相試験ではその基準値を“95mmHg以上”、“90~94mmHg”及び“90mmHg未満”に分けたが、[承認用法及び用量]では日常臨床においてより実用的なものにするため、“95mmHg以上”と“95mmHg未満”の2つに分けた。
6. 用法及び用量
用量調節期:通常、成人にはリオシグアトとして1回1.0mg 1日3回経口投与から開始する。2週間継続して収縮期血圧が95mmHg以上で低血圧症状を示さない場合には、2週間間隔で1回用量を0.5mgずつ増量するが、最高用量は1回2.5mg 1日3回までとする。収縮期血圧が95mmHg未満でも低血圧症状を示さない場合は、現行の用量を維持するが、低血圧症状を示す場合には、1回用量を0.5mgずつ減量する。
用量維持期:用量調節期に決定した用量を維持する。用量維持期においても、最高用量は1回2.5mg 1日3回までとし、低血圧症状を示すなど、忍容性がない場合には、1回用量を0.5mgずつ減量する。
安全性
中間解析での副作用発現率は、アデムパス®用量調節群で53.2%(123/231例)、プラセボ-アデムパス®群で60.6%(66/109例)、アデムパス®探索的用量群で46.4%(26/56例)でした。
副作用
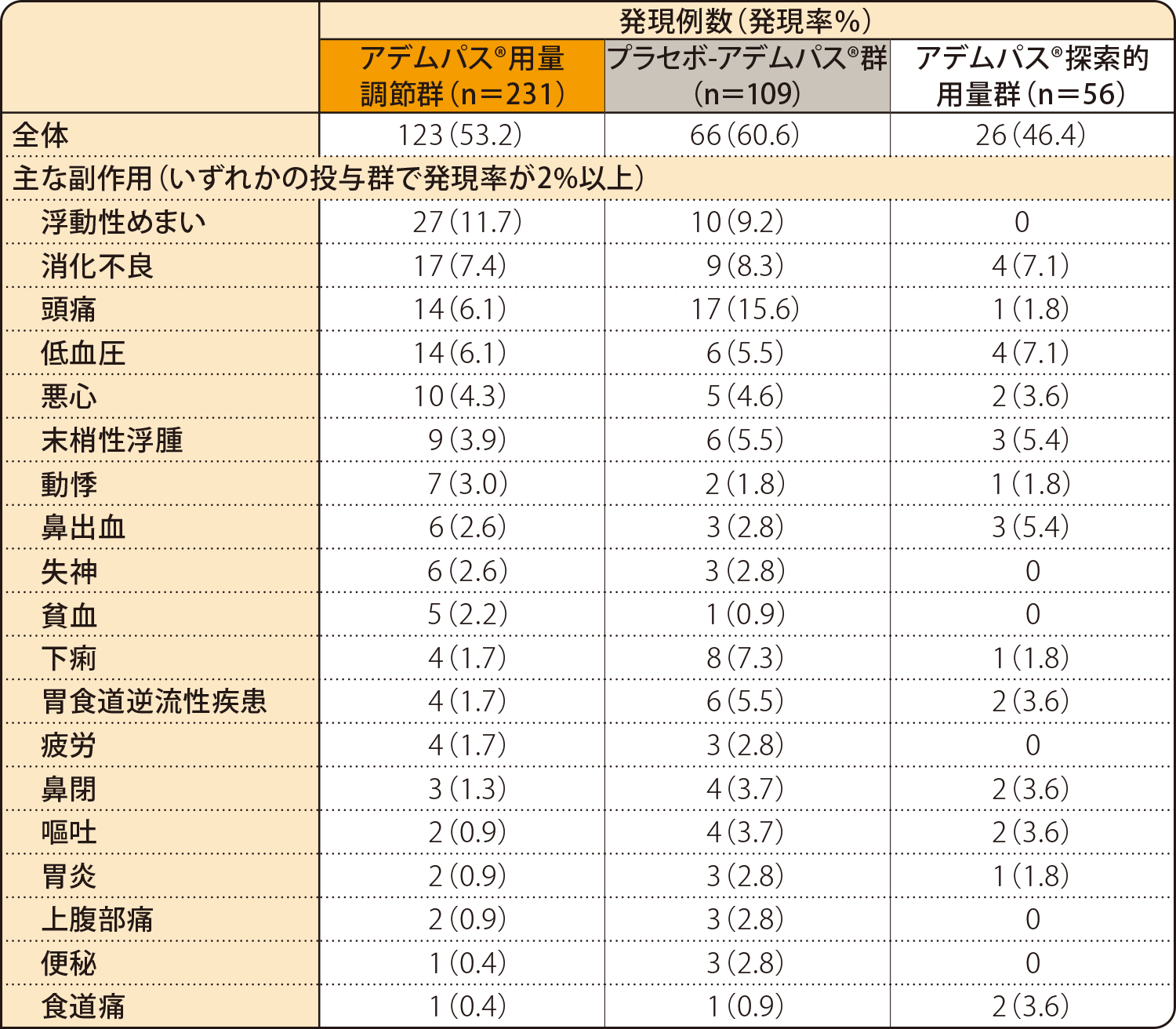
安全性解析対象集団
MedDRA version 15.1
副作用:治験薬と関連のある有害事象/治験薬投与下
重篤な副作用は、アデムパス®用量調節群で16例(6.9%)、プラセボ-アデムパス®群で9例(8.3%)、アデムパス®探索的用量群で1例(1.8%)に認められました。アデムパス®用量調節群の内訳は、失神が6例、肺出血が2例、心房細動、直腸ポリープ、胃腸炎、敗血症、変形性脊椎症、急性腎不全、鼻出血、低酸素症、肺動脈性肺高血圧症、肺静脈閉塞性疾患、薬疹、低血圧が1例、プラセボ-アデムパス®群の内訳は、失神が3例、心嚢液貯留、腹部不快感、上部腹痛、上部消化管出血、急性間質性肺臓炎、アレルギー性胞隔炎、間質性肺疾患が1例、アデムパス®探索的用量群は肺動脈性肺高血圧症が1例でした。
投与中止に至った副作用は、アデムパス®用量調節群で10例(4.3%)、プラセボ-アデムパス®群で3例(2.8%)、アデムパス®探索的用量群で1例(1.8%)に認められました。アデムパス®用量調節群の内訳は、心房細動、排便回数増加、嘔吐、胃腸炎、血中クレアチンホスホキナーゼ増加、肝酵素上昇、低酸素症、肺動脈性肺高血圧症、肺出血、肺静脈閉塞性疾患、発疹が各1例、プラセボ-アデムパス®群の内訳は、心嚢液貯留、上部消化管出血、アレルギー性胞隔炎が各1例、アデムパス®探索的用量群の内訳は、肺動脈性肺高血圧症1例でした。
死亡に至った副作用は、アデムパス®用量調節群で2例に認められ、肺出血及び肺炎が1例、肺動脈性肺高血圧症が1例でした。
有効性
396例(日本人21例を含む)を対象とした中間解析の結果、アデムパス®用量調節群における6分間歩行距離のPATENT-1試験ベースラインからの平均変化量は、PATENT-2試験投与12週後(218例)で52.3m、投与6ヵ月後(211例)で54.4m、投与9ヵ月後(206例)で51.0m、投与12ヵ月後(192例)で52.7mでした。
プラセボ対照二重盲検比較試験で認められたアデムパス®投与による6分間歩行距離のベースラインからの変化量は長期継続投与試験において以下のような推移を示しました。
6分間歩行距離のPATENT-1試験ベースラインからの平均変化量の推移
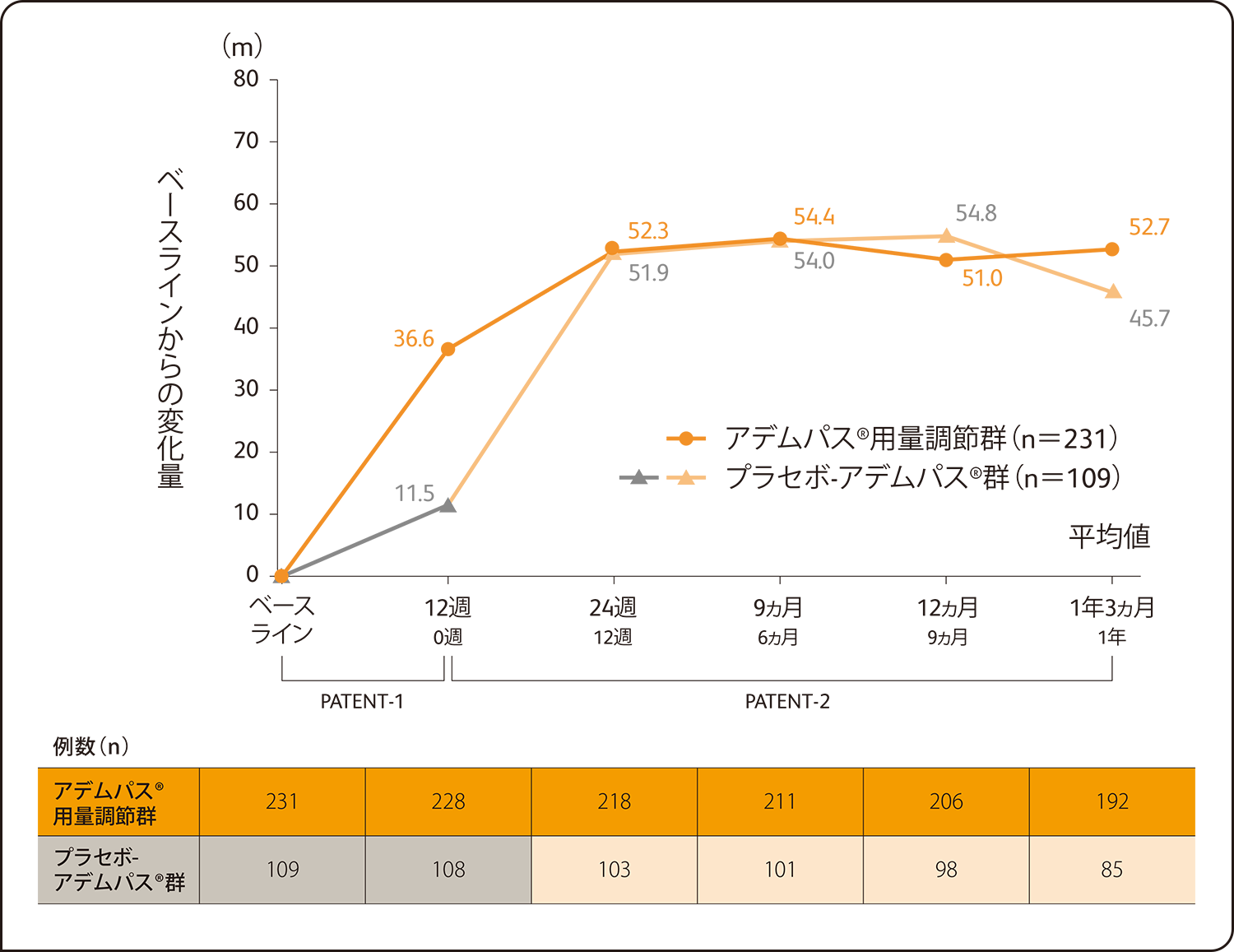
SAF解析による評価
PATENT-2試験開始から中間解析までの期間中、臨床的悪化を示した患者の割合は、PATENT-2試験の全症例の21.2%(84例)でした。
臨床的悪化
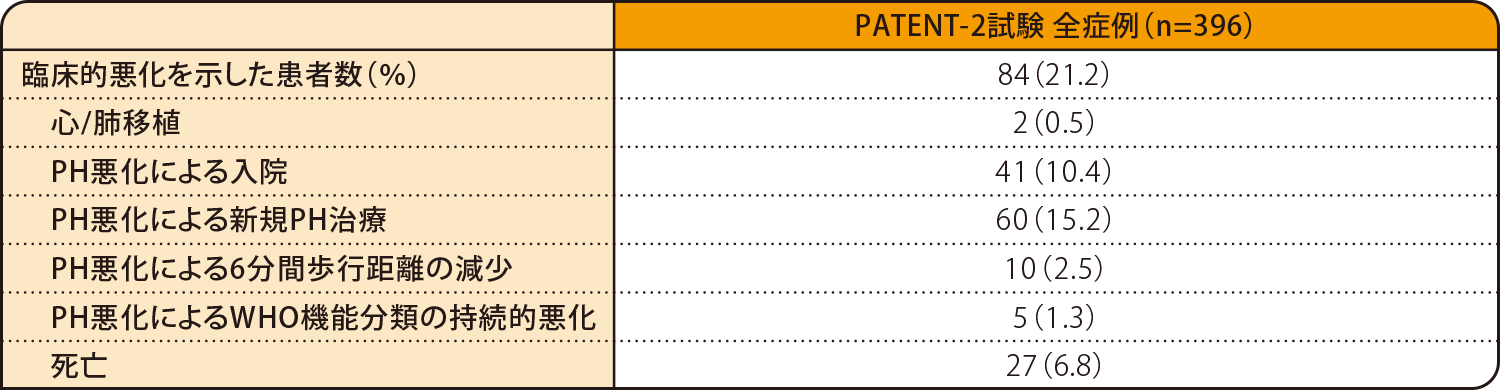
PH(pulmonary hypertension):肺高血圧症
PATENT-2試験開始から1年後の臨床的悪化を示していない患者の割合は88%(95%信頼区間:84~91%)、生存率は97%(95%信頼区間:94~98%)でした。
臨床的悪化を示していない患者の割合(PATENT-2試験 全症例 n=396)
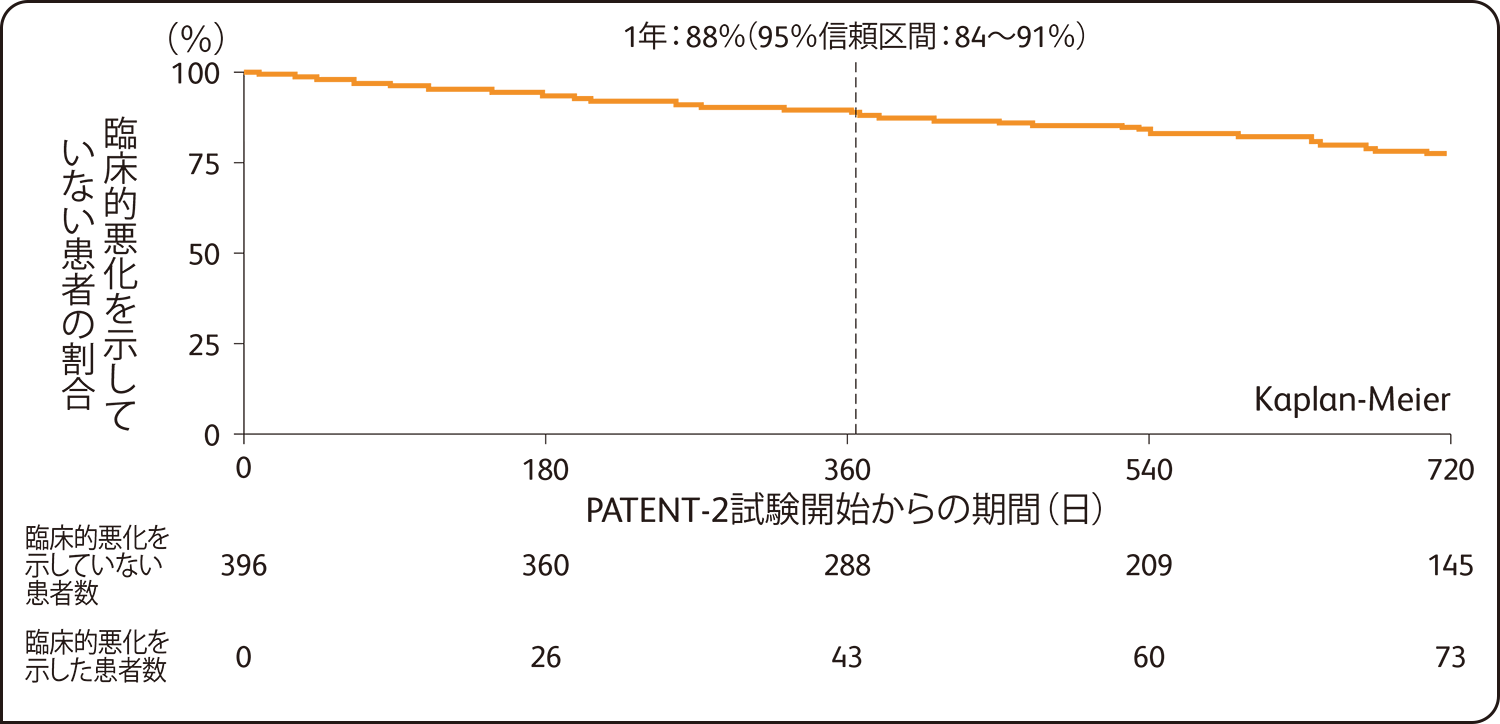
SAF解析による評価
生存率(PATENT-2試験 全症例 n=396)
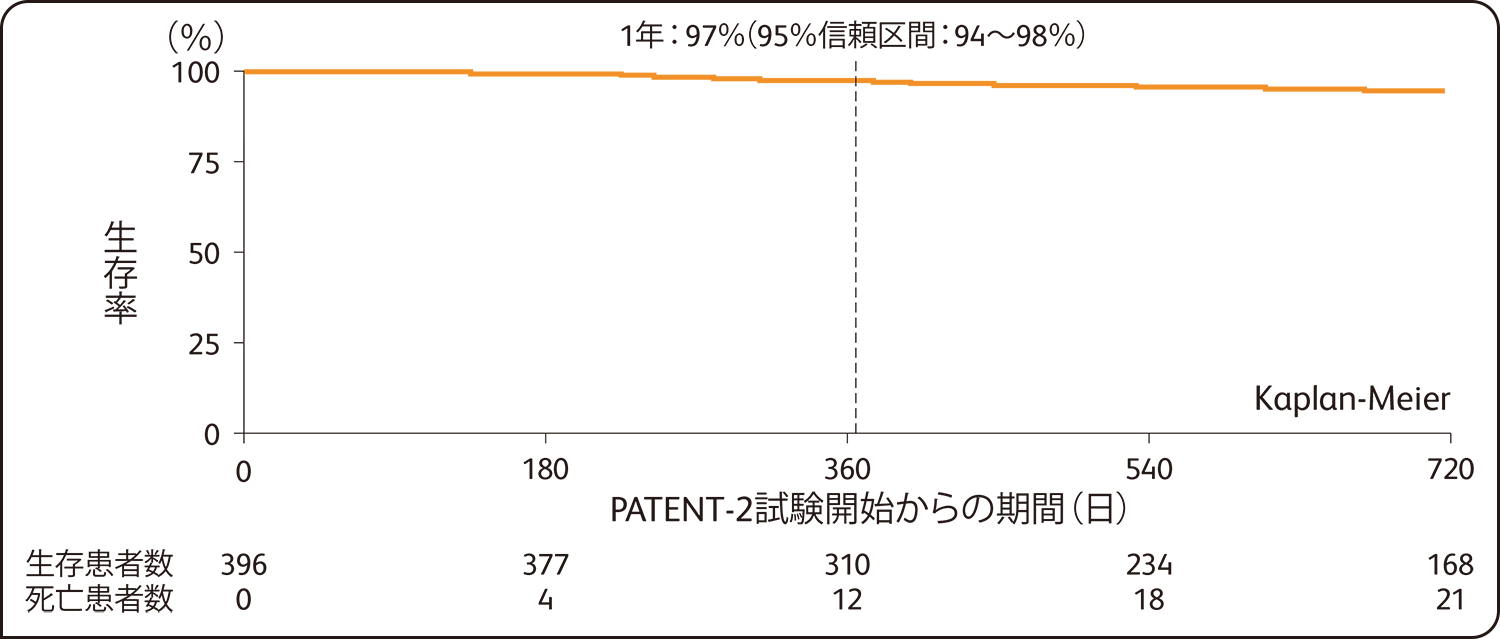
SAF解析による評価
Rubin LJ et al. Eur Respir J. 45, 1303(2015)より改変
Reproduced with permission of the © ERS 2023. European Respiratory Journal 45 (5) 1303-1313; DOI: 10.1183/09031936.00090614 Published 30 April 2015.