国際共同第Ⅲ相試験:有効性検証試験(CHEST-1)
外科的治療不適応又は外科的治療後に残存・再発したCTEPHに対するアデムパス®の臨床成績
国際共同第Ⅲ相試験:有効性検証試験(CHEST-1)
承認時評価資料:バイエル薬品社内資料[慢性血栓塞栓性肺高血圧症患者を対象とした第Ⅲ相試験]
Ghofrani HA et al. N Engl J Med. 369, 319(2013)(COI:本研究はバイエル社の資金により実施された、著者にバイエル社員(3名)を含む、著者にバイエル社より講演料等を受領している者を含む、著者にMSD社からコンサルタント料等を受領している者を含む)
試験概要

CTEPH(chronic thromboembolic pulmonary hypertension):慢性血栓塞栓性肺高血圧症
PVR(pulmonary vascular resistance):肺血管抵抗
PAH(pulmonary arterial hypertension):肺動脈性肺高血圧症
PH(pulmonary hypertension):肺高血圧症
TID:1日3回
NT-proBNP(N-terminal prohormone of brain natriuretic peptide):ヒト脳性ナトリウム利尿ペプチド前駆体N端フラグメント
4. 効能又は効果(抜粋)
○外科的治療不適応又は外科的治療後に残存・再発した慢性血栓塞栓性肺高血圧症
※ 用量調節時の指標として用いる収縮期血圧について、第Ⅲ相試験ではその基準値を“95mmHg以上”、“90~94mmHg”及び“90mmHg未満”に分けたが、[承認用法及び用量]では日常臨床においてより実用的なものにするため、“95mmHg以上”と“95mmHg未満”の2つに分けた。
6. 用法及び用量
用量調節期:通常、成人にはリオシグアトとして1回1.0mg 1日3回経口投与から開始する。2週間継続して収縮期血圧が95mmHg以上で低血圧症状を示さない場合には、2週間間隔で1回用量を0.5mgずつ増量するが、最高用量は1回2.5mg 1日3回までとする。収縮期血圧が95mmHg未満でも低血圧症状を示さない場合は、現行の用量を維持するが、低血圧症状を示す場合には、1回用量を0.5mgずつ減量する。
用量維持期:用量調節期に決定した用量を維持する。用量維持期においても、最高用量は1回2.5mg 1日3回までとし、低血圧症状を示すなど、忍容性がない場合には、1回用量を0.5mgずつ減量する。
有効性
6分間歩行距離の第16週におけるベースラインからの平均変化量は、アデムパス®群38.9m、プラセボ群-5.5mであり、アデムパス®群はプラセボ群に比べて有意な改善を示しました(最小二乗平均値の差45.69[95%信頼区間:24.74~66.63]a、p<0.0001b)。
主要評価項目:6分間歩行距離のベースラインから第16週までの平均変化量(検証的解析結果)
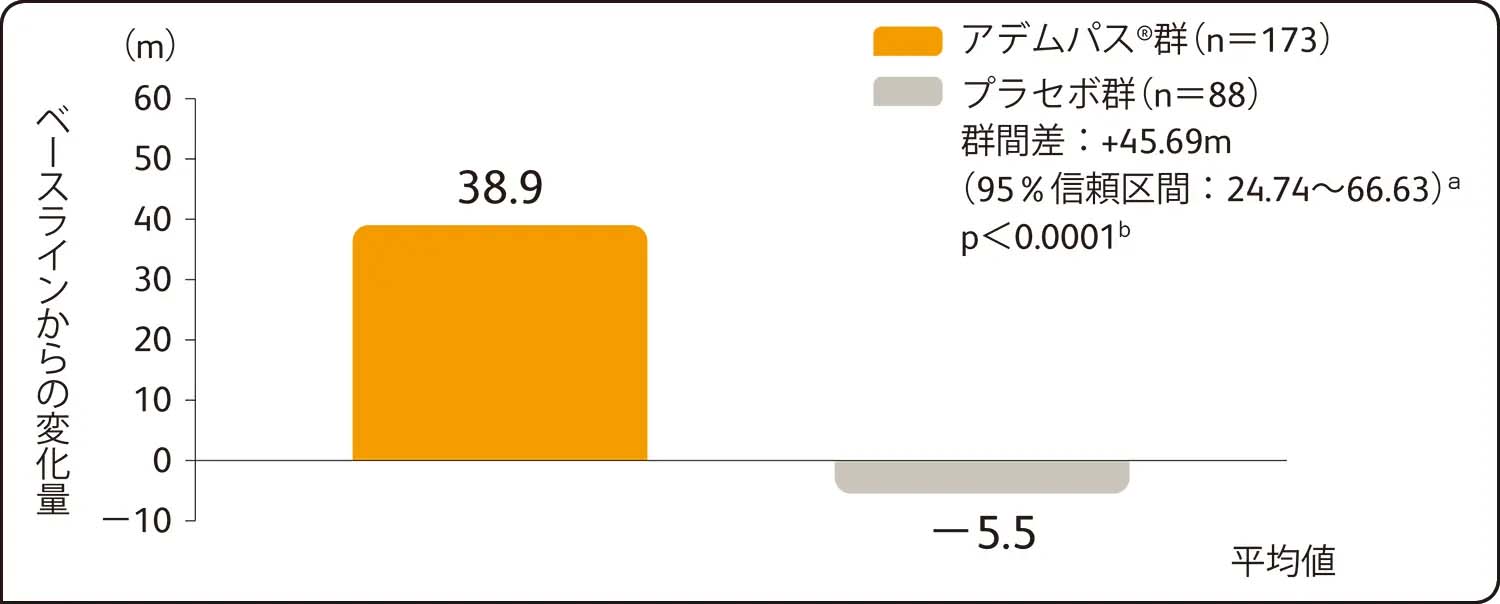
ITT解析による評価
a: ベースライン値を共変量、投与群及び国/地域を主効果とした共分散分析で算出した最小二乗平均値の差及び95%信頼区間
b:国/地域を層とした層別Wilcoxon検定
第16週においてベースラインからWHO機能分類が改善した患者の割合は、アデムパス®群で32.9%、プラセボ群で14.9%でした。第16週におけるWHO機能分類のベースラインからの変化量について、アデムパス®群はプラセボ群に比べて有意に改善しました(p=0.003a)。
副次的評価項目:WHO機能分類のベースラインから第16週までの変化量
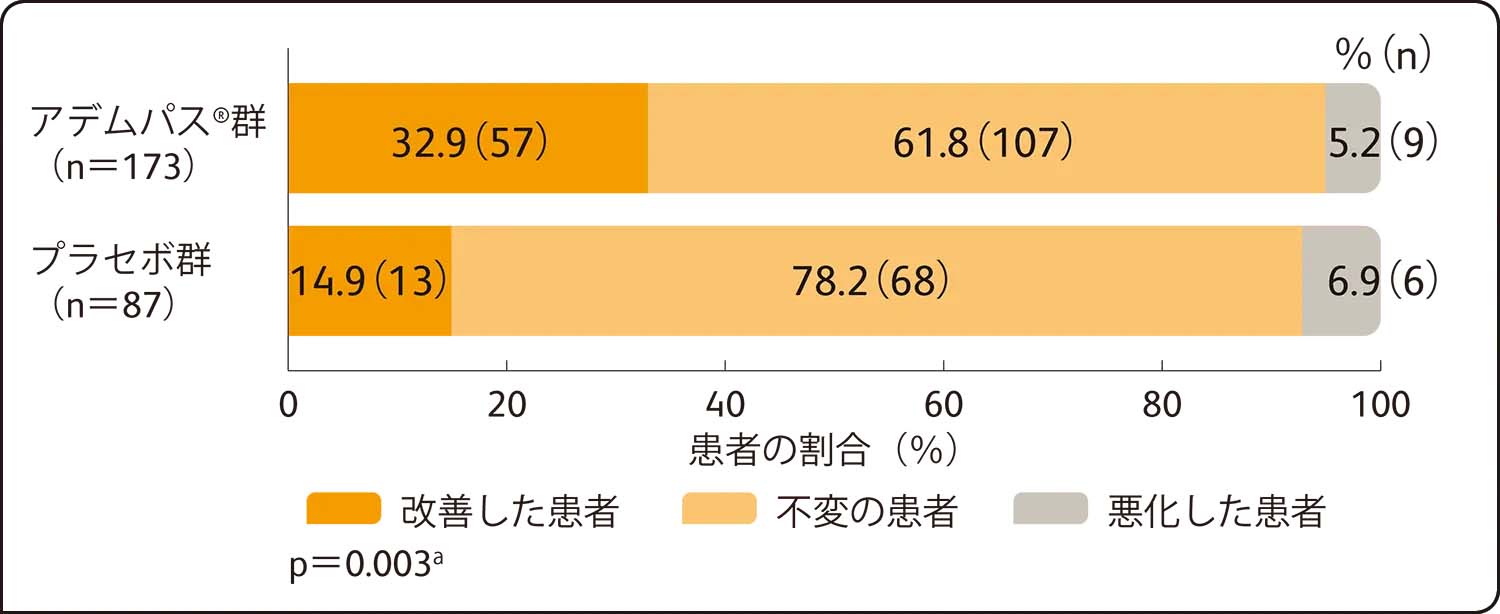
ITT解析による評価
WHO機能分類のクラスが1段階以上改善した場合を「改善」、変化しなかった場合を「不変」、1段階以上悪化した場合を「悪化」と分類した。投与群間の比較のための検定には、スコアの変化(治験終了時クラス-ベースライン時のクラス)を用いた。死亡をクラスⅤとし、スコアの変化は-3(ベースライン時にクラスⅣで終了時にクラスⅠ)から+4(ベースライン時にクラスⅠで終了時に死亡)までの値を取り得る。
a:国/地域を層とした層別Wilcoxon検定
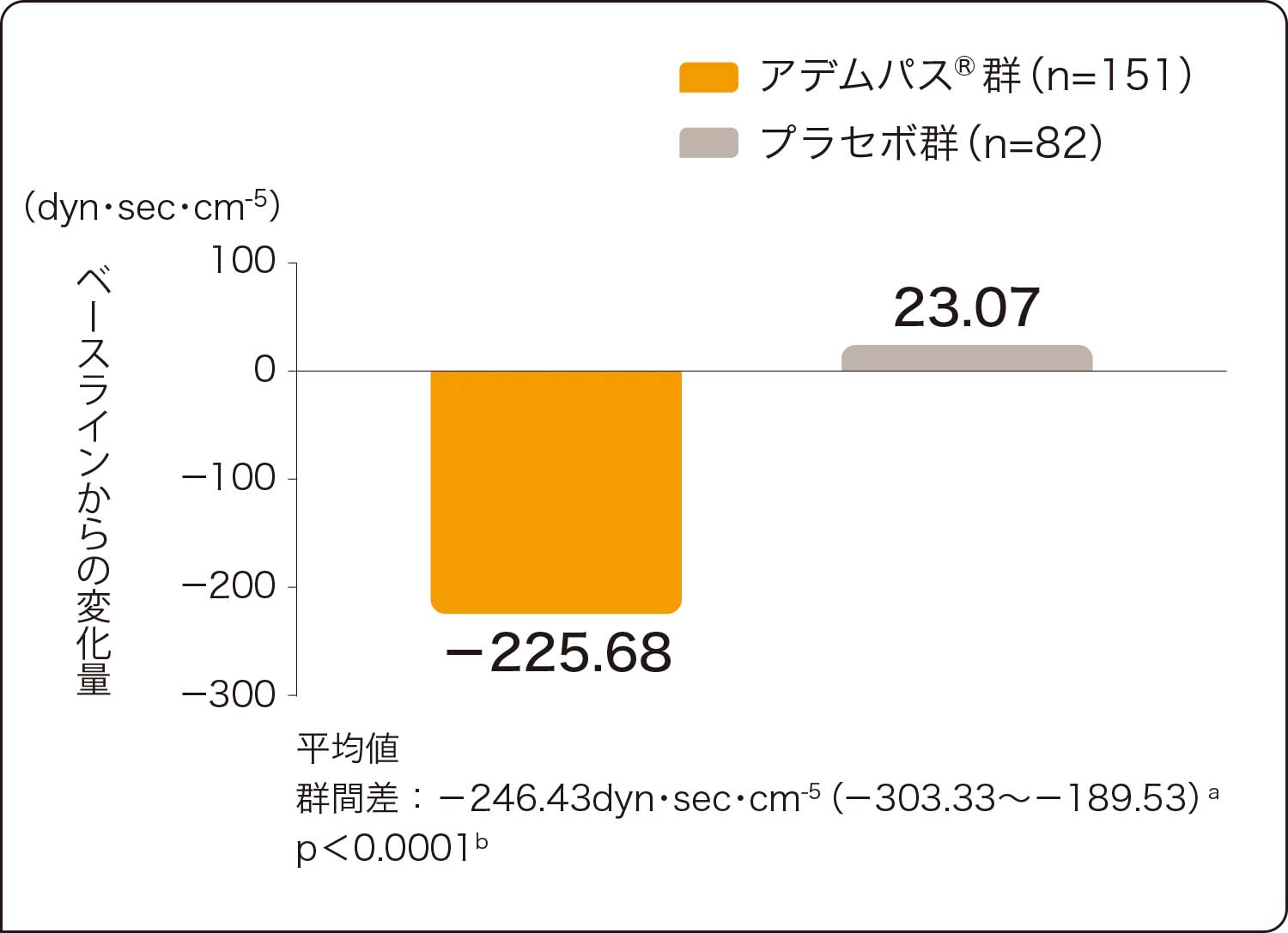
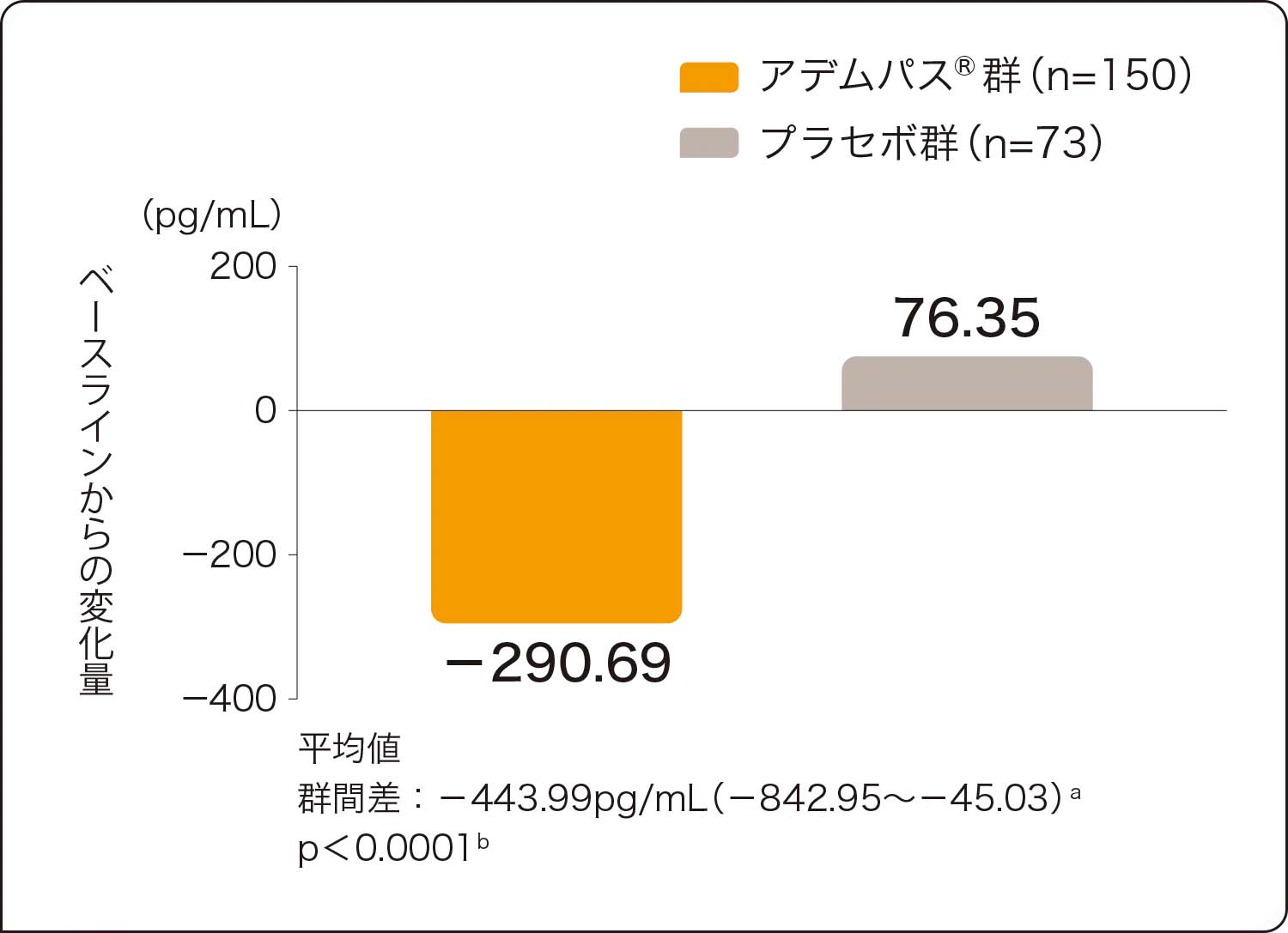
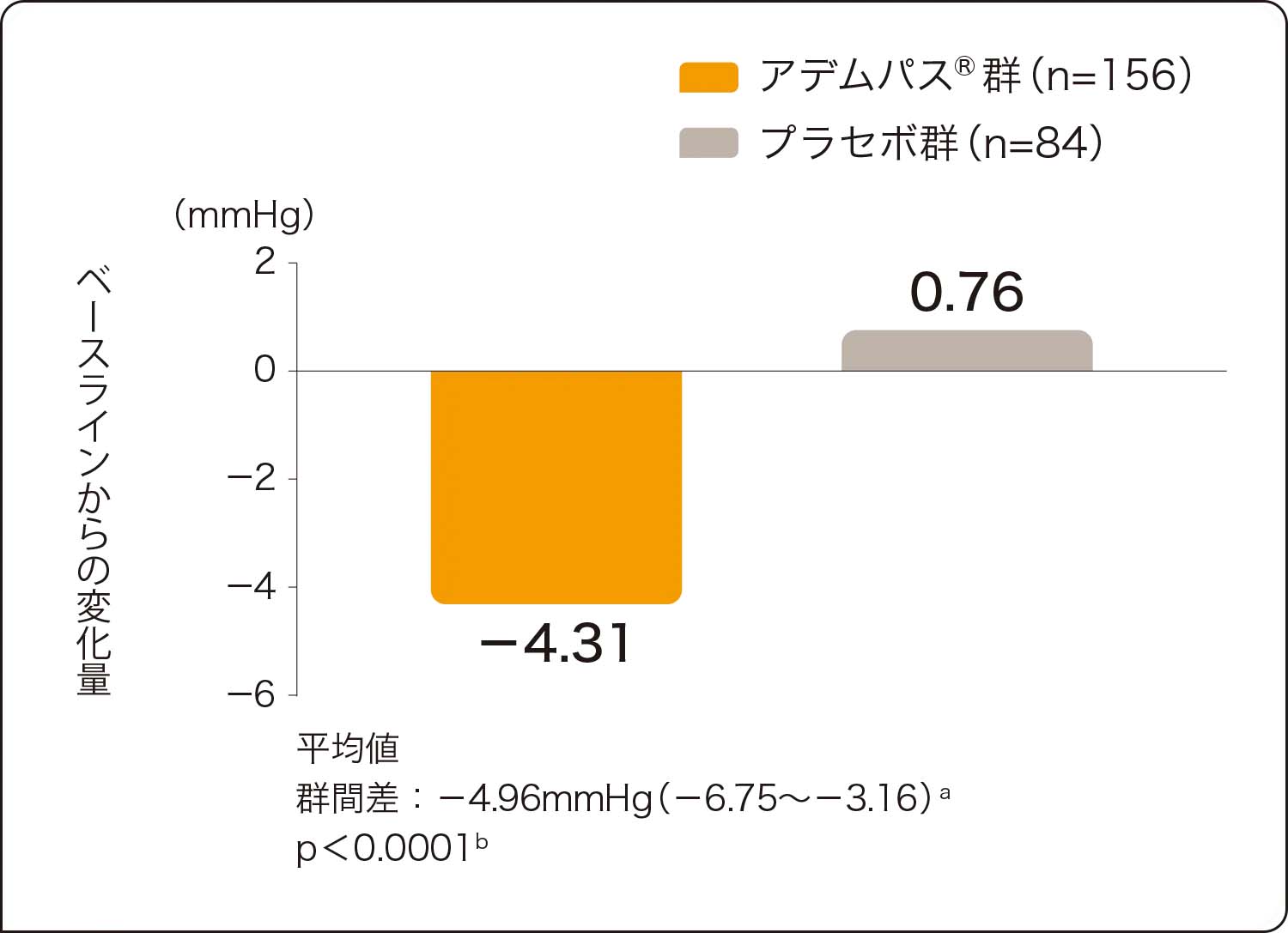
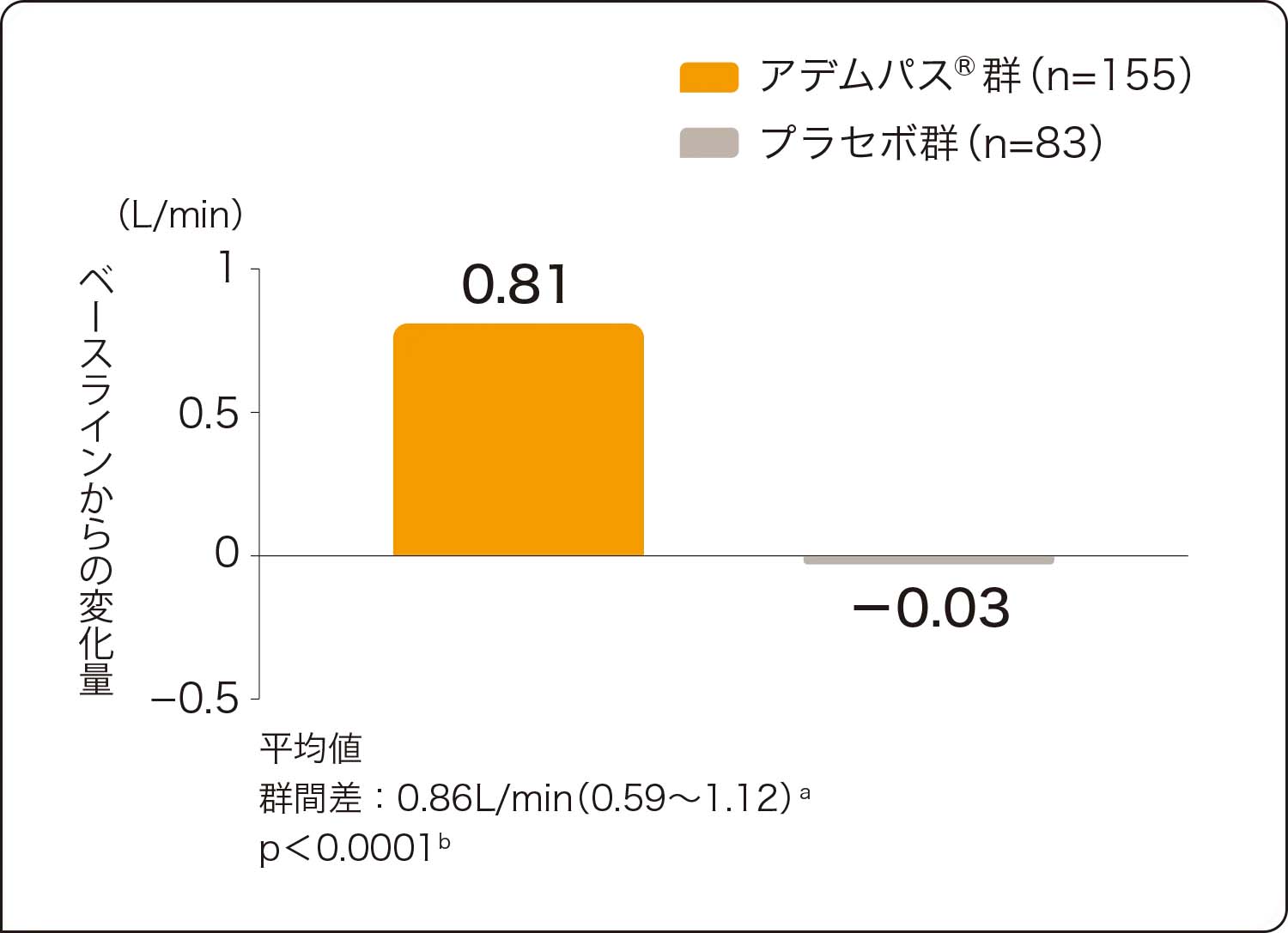
アデムパス®群では、肺血管抵抗、NT-proBNP、平均肺動脈圧、心拍出量においてもプラセボ群に比べ有意な改善が認められました(いずれもp<0.0001、層別Wilcoxon検定)。
副次的評価項目:肺血管抵抗、NT-proBNPのベースラインから第16週までの変化量
ベースラインから第16週までの平均変化量
肺血管抵抗(PVR)
NT-proBNP
追加の評価項目:平均肺動脈圧、心拍出量のベースラインから第16週までの変化量
ベースラインから第16週までの平均変化量
平均肺動脈圧(mPAP)
心拍出量(CO)
ITT解析による評価
NT-proBNP(N-terminal prohormone of brain natriuretic peptide) :ヒト脳性ナトリウム利尿ペプチド前駆体N端フラグメント
a:ベースライン値を共変量、投与群及び国/地域を主効果とした共分散分析で算出した最小二乗平均値の差及び95%信頼区間
b:国/地域を層とした層別Wilcoxon検定
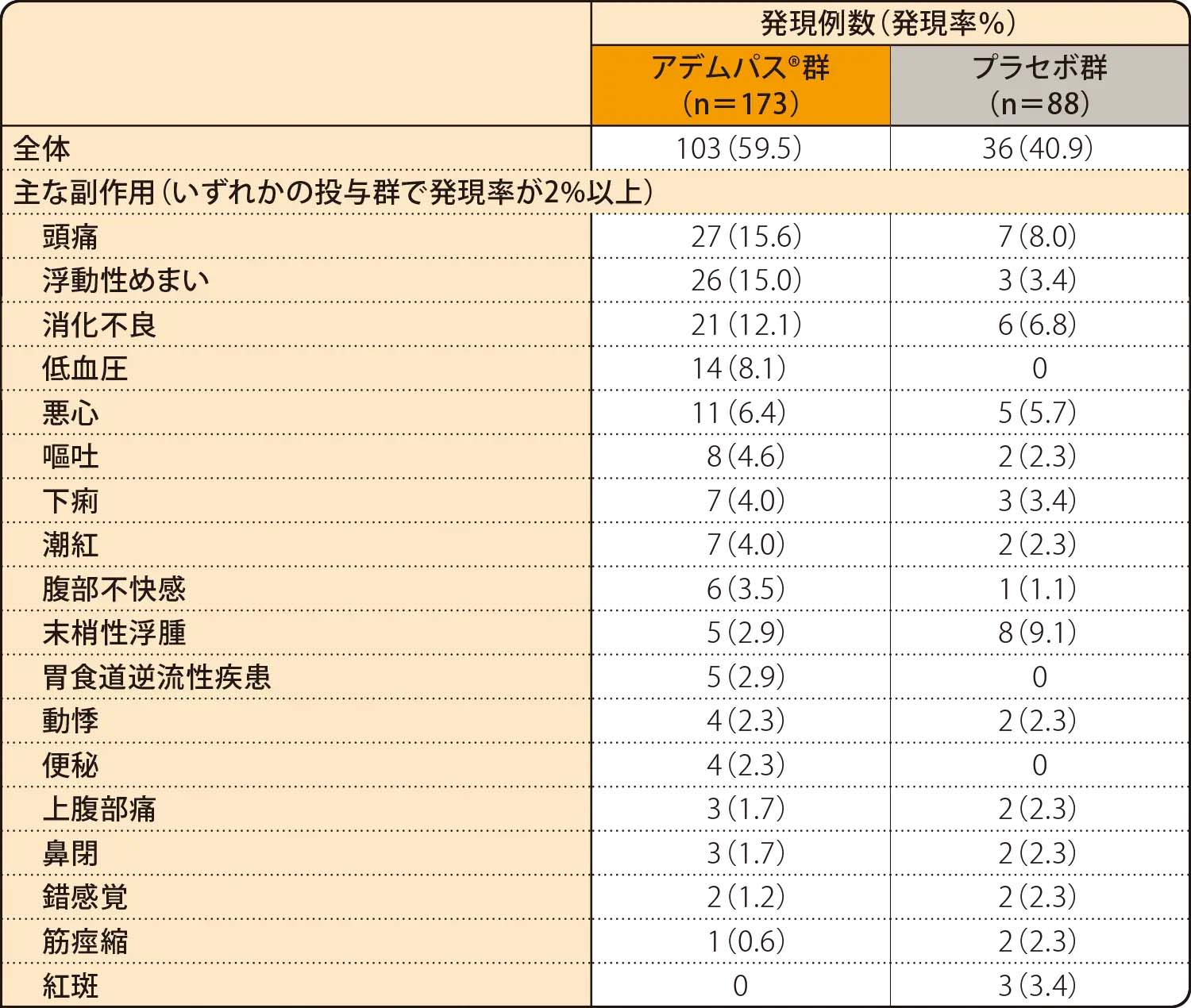
安全性
全ての副作用発現率は、アデムパス®群で59.5%(103/173例)、プラセボ群で40.9%(36/88例)でした。
副作用
安全性解析対象集団
MedDRA version 15.0
副作用:治験薬と関連のある有害事象/治験薬投与下
重篤な副作用は、アデムパス®群で6例(3.5%)、プラセボ群で1例(1.1%)に認められ、アデムパス®群で失神3例、胃炎、急性腎不全、低血圧がそれぞれ1例、プラセボ群で失神及び損傷が1例でした。
投与中止に至った副作用はアデムパス®群で1例(消化不良、下痢、悪心、嘔吐、頭痛)に認められました。死亡に至った副作用はアデムパス®群で1例(急性腎不全)に認められました。