DRIVE-SHIFT試験
本剤は海外での臨床試験成績をもとに承認されたため、国内での臨床試験は実施していません。
DRIVE-SHIFT試験で投与したDOR/3TC/TDF(ドラビリン/ラミブジン/テノホビル ジソプロキシルフマル酸塩)配合剤※1は国内未承認薬ですが、承認時評価資料であることからデータを掲載しています。これらの各成分の国内承認用法および用量については本ページ注釈または各製品添付文書をご参照ください。
DRIVE-SHIFT試験
承認時評価資料
治療経験があるHIV-1感染患者を対象とした海外第Ⅲ相非盲検比較試験(海外データ)7)8)
[目的]
抗HIV薬投与(ベースライン治療)で安定したウイルス学的抑制が得られているHIV-1感染患者を対象に、DOR/3TC/TDF※1へ切り替えた場合のウイルス学的効果への影響をベースライン治療継続と比較検証する。
[試験デザイン]
多施設共同、無作為化、非盲検、実薬対照第Ⅲ相、非劣性検証試験

[対象]
18歳以上で、抗HIV薬投与で6ヵ月以上ウイルス学的抑制(HIV-1 RNA量<40copies/mL)が維持されている成人HIV-1感染患者670例(試験薬投与例)
[方法]
①リトナビルまたはコビシスタットを併用したプロテアーゼ阻害剤(PI)、もしくは②コビシスタットを併用したエルビテグラビル、または③非ヌクレオシド系逆転写酵素阻害剤(NNRTI)に、ヌクレオシド系逆転写酵素阻害剤(NRTI)2剤を併用した抗HIV薬投与(ベースライン治療)で安定している患者を、DOR/3TC/TDF(ドラビリン100mg/ラミブジン300mg/テノホビル ジソプロキシルフマル酸塩300mgの配合剤)※1を1日1回経口投与に直接切り替える(ISG:Immediate Switch Group)群と、24週までベースライン治療を継続し、24週時にDOR/3TC/TDFに切り替える(DSG:Delayed Switch Group)群に2:1の割合で無作為に割付け、48週間追跡した。
[評価項目]
主要評価項目:ISG群48週時およびDSG群24週時におけるHIV-1 RNA量<50copies/mLの患者の割合
副次評価項目:ISG群24週時およびDSG群24週時におけるHIV-1 RNA量<50copies/mL/≧50copies/mLの患者の割合 ISG群48週時
およびDSG群24週時におけるHIV-1 RNA量≧50copies/mLの患者の割合
ISG群48週時およびDSG群24週時とISG群24週時およびDSG群24週時におけるHIV-1 RNA量< 40copies/mLの患者の割合
免疫学的有効性(CD4陽性リンパ球数のベースラインからの変化量) 等
追加評価項目:抗ウイルス薬耐性の発現 等
安全性評価項目:副作用、ベースライン治療がリトナビルを併用したPIベースの患者におけるISG群24週時およびDSG群24週時のLDLコレステロールおよびNon-HDLコレステロールのベースラインからの変化量 等
[解析計画]
有効率の群間差の95%CIは、各投与群の層(ベースライン治療別)あたりの症例数の調和平均により重み付けした差を用いた層補正Mantel-Haenszel法で算出した。CD4陽性リンパ球数の平均変化量の差の95%CIは、t分布に基づいて求めた。主要評価項目について、群間差(ISG群48週時-DSG群24週時)の95%CIの下限値が-8%を上回る場合に、ISG群のDSG群に対する非劣性が検証されるとした。非劣性が検証され、かつ95%CIの下限値が0%を上回る場合に、ISG群のDSG群に対する優越性が検証されるとした。また、副次評価項目である24週時のISG群およびDSG群のHIV-1 RNA量<50copies/mLの患者の割合について、ベースライン時の患者背景因子別にサブグループ解析を実施した。
有効性
■ ウイルス学的効果
(主要評価時点:ISG群48週 vs DSG群24週、副次評価時点:ISG群24週 vs DSG群24週)
主要評価項目であるISG群の48週およびDSG群の24週におけるHIV-1 RNA量<50copies/mLを達成した患者の割合は、ISG群48週で90.8%、DSG群24週で94.6%であり[群間差(95%CI)-3.8(-7.9, 0.3)%]、ISG群48週のDSG群24週に対する非劣性が検証されました。一方、優越性は示されませんでした。
ウイルス学的効果a, 7)8)
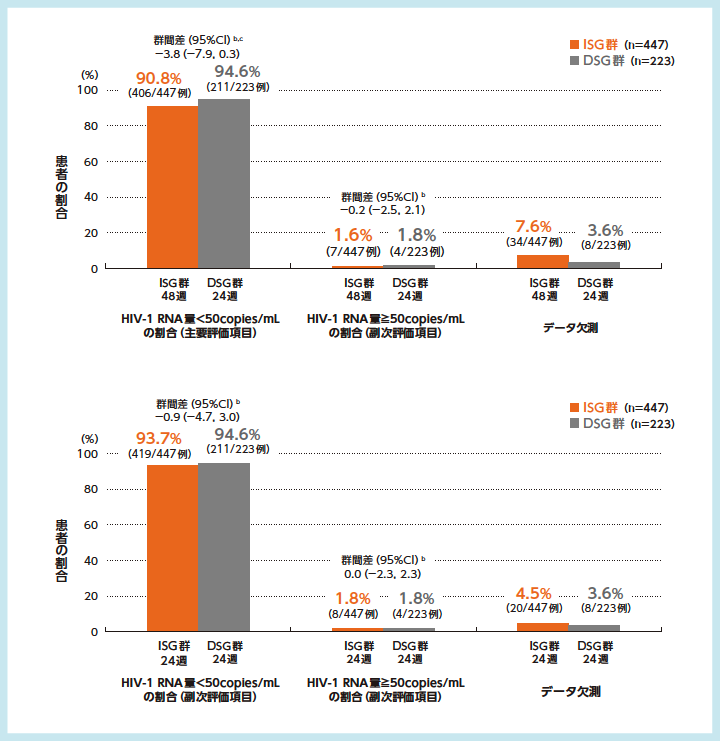
ISG群:試験開始時にDOR/3TC/TDFに切り替えて48週間投与
DSG群:ベースライン治療を24週間継続後にDOR/3TC/TDFに切り替えて24週間投与
a:FDA Snapshot法:理由を問わず、試験の中止を含めて全てのデータ欠損を治療失敗として扱った。
b:投与群間差(ISG群-DSG群)の95%CIは、各投与群の層(ベースライン治療:リトナビルもしくはコビシスタットを併用したPIベース、コビシスタットを併用したEVGベースまたはNNRTIベース)あたりの症例数の調和平均により重み付けした差を用いた層補正Mantel-Haenszel法により算出した。
c:主要評価項目について、HIV-1 RNA量<50copies/mLを達成した患者の割合の投与群間差の95%CIの下限値が-8%を上回る場合に、ISG群のDSG群に対する非劣性が検証されるとした。非劣性が検証され、かつ95%CIの下限値が0%を上回る場合に、ISG群のDSG群に対する優越性が検証されるとした。
ウイルス学的抑制および免疫学的効果8)
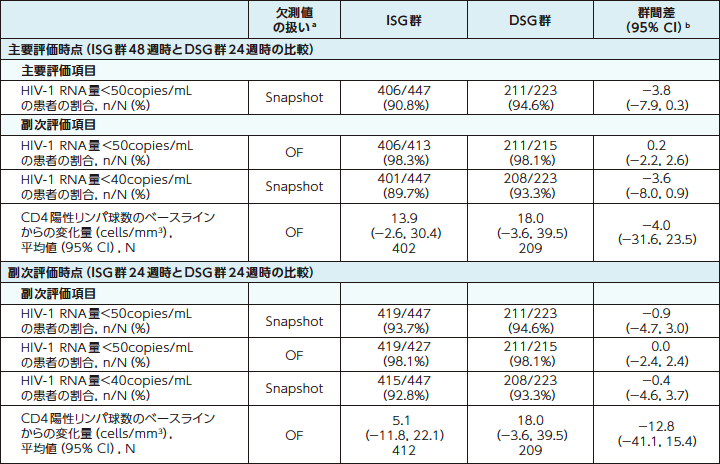
ISG群:試験開始時にDOR/3TC/TDFに切り替えて48週間投与
DSG群:ベースライン治療を24週間継続後にDOR/3TC/TDFに切り替えて24週間投与
a:Snapshot:FDA Snapshot法:理由を問わず、試験の中止を含めて全てのデータ欠損を治療失敗として扱った。
OF:Observed Failure法:効果不十分のために試験薬投与を早期に中止し、欠測値[投与期間中に断続的に生じる欠測値を除く]のある症例を治療失敗例として扱った。
b:群間差の95%CIは、各投与群の層(ベースライン治療:リトナビルもしくはコビシスタットを併用したPIベース、コビシスタットを併用したEVGベースまたはNNRTIベース)あたりの症例数の調和平均により重み付けした差を用いた層補正Mantel-Haenszel法により算出した。CD4陽性リンパ球数の平均変化量の差の95%CIは、t分布に基づいて求めた。
c:ウイルス学的失敗は、1週間以上間隔を空けて2回連続してHIV-1 RNA量≧50copies/mLと定義した。
d:DSG群のウイルス学的失敗は、ベースラインレジメン継続中に1例、DOR/3TC/TDF切り替え後に1例の計2例であった。
安全性
■ 副作用
48週までのDOR/3TC/TDF投与群(ISG群0~48週+DSG群24~48週、n=656)の副作用発現率は19.7%(129/656例)で、主なものはALT増加14例(2.1%)、頭痛12例(1.8%)でした。
DOR/3TC/TDF投与群で48週までに発現した重篤な副作用は、5例でリパーゼ増加2件、ALT増加、AST増加、 アミラーゼ増加、うつ病および腎不全の各1件でした。 DOR/3TC/TDF投与群で48週までに試験薬の投与中止に至った副作用は、13例でリパーゼ増加、ALT増加およびAST増加の各2件、全身性浮腫、筋肉痛、斑状皮疹、腎臓痛、記憶障害、疲労、睡眠障害、うつ病、食欲減退、アミラーゼ増加、腎不全、記憶障害および肝炎の各1件でした。
24週までのDSG群の副作用発現率は2.2%(5/223例)で、主なものは頭痛1例(0.4%)でした。
24週までのDSG群に重篤な副作用ならびに試験薬の投与中止に至った副作用の発現は認められませんでした。
48週間の試験期間中に、いずれの投与群においても死亡は認められませんでした。
■[参考情報]脂質プロファイルへの影響(24週時)
スクリーニング時のベースライン治療がリトナビルを併用したPIベースの患者では、24週時の空腹時LDLコレステロールおよびNon-HDLコレステロールのベースラインからの変化量は、ISG群で-16.5および-24.7mg/dL、DSG群でそれぞれ-1.9および-1.3mg/dLでした。
空腹時脂質のベースラインからの変化量 (安全性評価項目、ベースライン治療がリトナビルを併用したPIベースの患者:24週時)8)
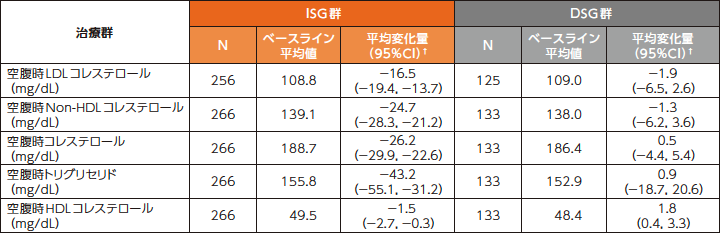
ISG群:試験開始時にDOR/3TC/TDFに切り替えて48週間投与
DSG群:ベースライン治療を24週間継続後にDOR/3TC/TDFに切り替えて24週間投与
欠測値は、Last Observation Carried Forward(LOCF)法を用いて補完した。
†:群内の95%CIはt分布に基づいた。
N:スクリーニング時の治療レジメンがリトナビルを併用したPIベースで、ベースライン後の検査結果が1つ以上得られた患者の数
※1 DOR/3TC/TDF配合剤は、ドラビリン100mg/ラミブジン300mg/テノホビル ジソプロキシルフマル酸塩300mgを含有する製剤で、国内未承認です。
各成分の国内承認用法および用量(各製品添付文書より):
・ドラビリン:通常、成人にはドラビリンとして100mgを1日1回経口投与する。本剤は、食事の有無にかかわらず投与できる。投与に際しては、必ず他の抗HIV薬と併用すること。
・ラミブジン:通常、成人には他の抗HIV薬と併用して、ラミブジンとして1日量300mgを1日1回又は2回(150mg×2)に分けて経口投与する。なお、年齢、体重、症状により適宜増減する。
・テノホビル ジソプロキシルフマル酸塩:通常、成人にはテノホビル ジソプロキシルフマル酸塩として1回300mg(テノホビル ジソプロキシルとして245mg)を1日1回経口投与する。 なお、投与に際しては必ず他の抗HIV薬と併用すること。
【禁忌を含む使用上の注意】 等はこちらをご参照ください。
7) Johnson M, et al. J Acquir Immune Defic Syndr 2019; 81(4): 463-472
(利益相反:Merck Sharp & Dohme Corp., a subsidiary of Merck & Co., Inc., N.J., U.S.A.が資金提供。
共著者のZhou、Morais、Kumar、Sklar、Hanna、Hwang、GreavesはMerck Sharp & Dohme Corp., a subsidiary of Merck & Co., Inc., N.J., U.S.A.の社員。)
8) 承認時評価資料(海外第Ⅲ相試験:DRIVE-SHIFT試験)