2次治療:KEYNOTE-045試験
尿路上皮癌:国際共同臨床試験成績:国際共同第Ⅲ相試験 <KEYNOTE-045試験>
承認時評価資料:国際共同第Ⅲ相試験(KEYNOTE-045試験)
Bellmunt J et al. N Engl J Med 2017; 376: 1015-1026#1
Vaughn DJ et al. J Clin Oncol 2018; 36: 1579-1587#2
#1 本試験はMSD社の資金提供により行われた。Joaquim BellmuntはMSD社から顧問料等を受領している。その他の著者に同社から顧問料などを受領している者が含まれる。著者のうち、Yabing Mai、Rodolfo F. Perini、Christian H. PoehleinはMSD社の社員である。
#2 本試験はMSD社の資金提供により行われた。David J. VaughnはMSD社から顧問料等を受領している。その他の著者に同社から顧問料などを受領している者が含まれる。著者のうち、Yabing Mai、Haojie Li、Rodolfo F. PeriniはMSD社の社員である。
試験概要
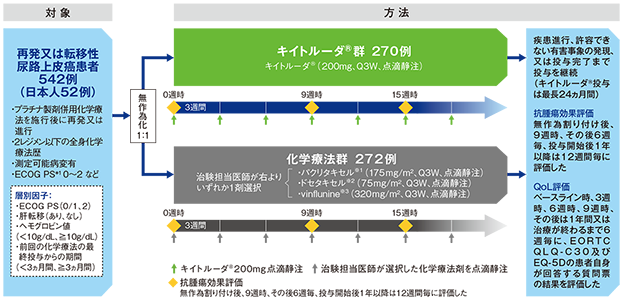
【目的】プラチナ製剤併用化学療法後に再発又は進行した局所進行性又は転移性の尿路上皮癌患者の2次治療におけるキイトルーダ®と化学療法の有効性及び安全性を比較検討する。
【デザイン】国際共同無作為化非盲検第Ⅲ相試験[優越性試験]
主要評価項目及び副次評価項目 第2回中間解析結果[データカットオフ日: 2016年9月7日(追跡期間中央値: 14.1ヵ月)]
探索的評価項目 データカットオフ日:2017年1月18日(追跡期間中央値: 18.5ヵ月)
【対象】1次治療のプラチナ製剤併用化学療法後に再発又は進行した、あるいはプラチナ製剤併用化学療法による術前若しくは術後補助化学療法の治療終了後12ヵ月以内に再発又は進行した局所進行性又は転移性の尿路上皮癌患者542例(日本人患者52例を含む)
【方法】キイトルーダ®群(200mgを3週間間隔(Q3W)で点滴静注)又は化学療法群に1:1の割合で無作為に割り付けた。無作為割り付け後9週時点とその後6週間毎に患者の疾患状態を画像診断により評価した。投与開始後1年以降は12週間毎に患者の疾患状態を評価した。疾患進行、許容できない有害事象の発現、又は投与完了(キイトルーダ®投与は24ヵ月間)まで継続した。
※1、2 パクリタキセル、ドセタキセルは尿路上皮癌に対して国内適応外
※3 vinflunineは国内未承認のため、日本では選択されなかった
【評価項目】主要評価項目:ITT集団*2及びPD-L1高発現(CPS*3≧10)、PD-L1陽性(CPS≧1)患者における全生存期間(OS*4)#及び無増悪生存期間(PFS*5)#
副次評価項目:奏効率(ORR*6)#、奏効期間(DOR*7)、安全性
探索的評価項目:健康関連QoLに関するPRO*8(EORTC QLQ-C30、EQ-5D)
#検証的解析項目
【判定基準】PFS、ORR、DORは、BICR*9がRECISTガイドライン1.1版に基づき評価した。
[第2回目中間解析及び最終解析はPD-L1陽性(CPS≧1)を除く]
【解析計画】解析対象集団:有効性はITT集団、安全性はASaT集団*10を解析対象とした。QoLの解析対象はFAS集団*11とした。
有効性評価の統計手法:OS、PFSの生存曲線はKaplan-Meier法を用いて推定し、OS、PFSの群間比較には層別ログランク検定を用いた。OS、PFSのハザード比(HR)及び95%信頼区間(95%CI)を投与群のみを共変量とした層別Cox比例ハザードモデルを用いて算出した。層別因子は、無作為化に用いた層別因子[ECOG PS(0/1、2)、肝転移(あり、なし)、ヘモグロビン値(<10g/dL、≧10g/dL)及び前回の化学療法の最終投与からの期間(<3ヵ月間、≧3ヵ月間)]とした。また、サブグループ解析として、同じ層別因子に基づく層別Cox比例ハザードモデルを用いてOS、 PFSの部分集団解析を実施した。ORRは層別Miettinen & Nurminen法にて評価した。DORはKaplan-Meier法を用いて要約した。
PD-L1低発現(CPS<10)患者についての解析は治験実施計画書に記載されていないが、OS、PFSについて算出し、評価資料として承認時に評価された。また、日本人集団について、治療実施計画書に記載されていないが、OS、PFS、ORRについて算出し、評価資料として承認時に評価された。日本人集団の有効性は例数が限られているため、層別因子を用いず投与群のみを共変量としたCox比例ハザードモデルを用いて解析した。また、日本人集団の予後因子がOSの結果に与える影響を検討するために、全体集団の予後因子を加えた多変量Cox比例ハザードモデルを用いてハザード比を算出した。
多重性の調整:本試験は、PFS、OSは2回の中間解析及び最終解析を事前に計画した。1回目の中間解析後に、最初に配分する有意水準を変更した。PFS及びOSならびにORR間で、試験全体の有意水準を片側2.5%となるよう厳密に制御した。PFS及びOSの多重性の調整には、Maurer & Bretzのグラフィカルアプローチを用いて、有意水準の配分にはHwang-Shih-Decani(γ=-4)のalpha消費関数を用いた。検定手順は、“PD-L1高発現患者のPFS”→“全体集団のPFS”の順に優越性が示された場合に次の検定に進むこととした。同様に、”PD-L1高発現患者のOS”→”全体集団のOS”→“全体集団のORR”の順に優越性が示された場合に次の検定に進むこととした。なお、“全体集団のOS“は“全体集団のPFS”の優越性が示された場合に、“全体集団のPFS”は“全体集団のORR”の優越性が示された場合にも検定することとした。
患者報告アウトカム(PRO)評価:FAS集団を対象とし、ベースライン時、3、6、9週間後、その後は6週間毎に最長1年間、または投与中止日及び安全性評価の30日目の来院時に、EORTC QLQ-C30*12及びEQ-5D*13の質問票を用いて、PROを評価した。
*1 ECOG(Eastern Cooperative Oncology Group):米国東海岸がん臨床試験グループ、PS(performance status):全身状態の指標
*2 ITT集団(intention to treat):無作為化されたすべての患者
*3 CPS(combined positive score):PD-L1陽性細胞数(腫瘍細胞、リンパ球及びマクロファージ)を総腫瘍細胞数で除し、100を乗じた数値
*4 OS(overall survival):全生存期間
*5 PFS(progression free survival):無増悪生存期間
*6 ORR(overall response rate):奏効率
*7 DOR(duration of response):奏効期間
*8 PRO(patient reported outcome):患者報告アウトカム
*9 BICR(blinded independent central review):盲検下独立判定委員会
*10 ASaT(all subjects as treated)集団:治験薬が1回以上投与されたすべての患者
*11 FAS(full analysis set)集団:無作為化され、治験薬が1回以上投与されたすべての患者のうち、少なくとも1回以上質問票に回答した患者
*12 疾患特異的QoL調査を目的
*13 一般健康関連QoL調査を目的
※1 パクリタキセルの効能又は効果は以下のとおりです。
効能又は効果
卵巣癌、非小細胞肺癌、乳癌、胃癌、子宮体癌、再発又は遠隔転移を有する頭頸部癌、再発又は遠隔転移を有する食道癌、血管肉腫、進行又は再発の子宮頸癌、再発又は難治性の胚細胞腫瘍(精巣腫瘍、卵巣腫瘍、性腺外腫瘍)
※2 ドセタキセルの効能又は効果は以下のとおりです。
効能又は効果
乳癌、非小細胞肺癌、胃癌、頭頸部癌、卵巣癌、食道癌、子宮体癌、前立腺癌
8. 重要な基本的注意
8.1 本剤のT細胞活性化作用による、過度の免疫反応に起因すると考えられる様々な疾患、8.2 間質性肺疾患、8.3 甲状腺機能障害、下垂体機能障害及び副腎機能障害、8.4 劇症肝炎、肝不全、肝機能障害、肝炎、硬化性胆管炎、8.5 1型糖尿病、8.6 腎障害、8.7 筋炎、横紋筋融解症、8.8 重症筋無力症、8.9心筋炎、8.10 ぶどう膜炎(虹彩炎及び虹彩毛様体炎を含む)等の重篤な眼障害があらわれることがあるので注意が必要です。詳細は「製品情報:基本情報>「警告・禁忌」等その他の注意」をご参照ください。
患者背景(ITT集団)(各項目の「不明」は省略)
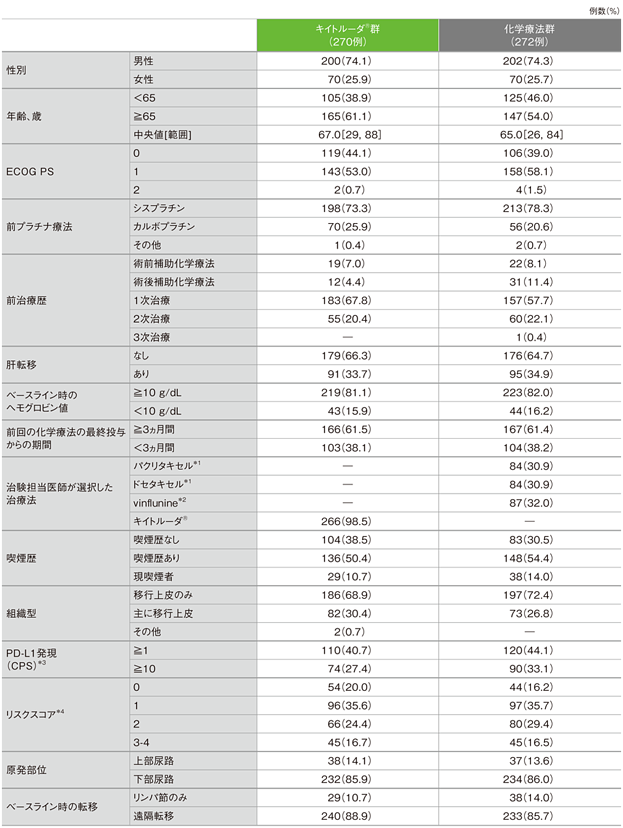
*1 国内適応外
*2 国内未承認
*3 CPS(combined positive score): PD-L1陽性細胞数(腫瘍細胞、リンパ球及びマクロファージ)を総腫瘍細胞数で除し、100を乗じた数値
*4 ECOG PS(>0)、ヘモグロビン値(<10g/dL)、前回の化学療法の最終投与からの期間(<3ヵ月間)及び肝転移(あり)の4つの因子の該当数
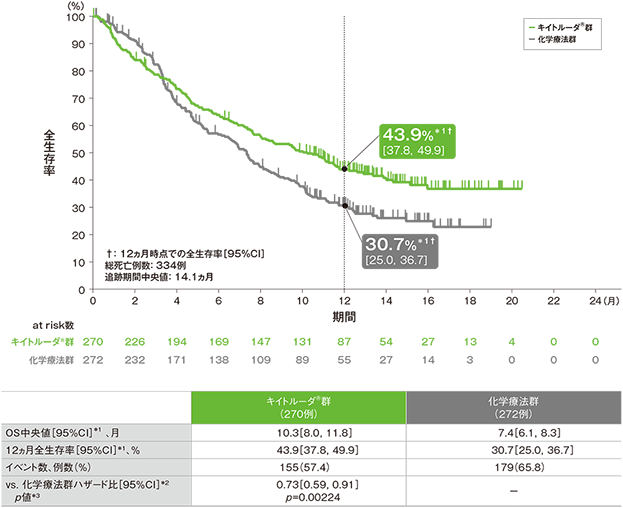
主要評価項目 全生存期間:OS
全生存期間(OS)のKaplan-Meier 曲線(ITT集団)
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、無作為化に用いた層別因子[ECOG PS(0/1、2)、肝転移(あり、なし)、ヘモグロビン値(<10g/dL、≧10g/dL)及び前回の化学療法の最終投与からの期間(<3ヵ月間、≧3ヵ月間)]を層別因子とした層別Cox比例ハザードモデルに基づく
*3 無作為化に用いた層別因子[ECOG PS(0/1、2)、肝転移(あり、なし)、ヘモグロビン値(<10g/dL、≧10g/dL)及び前回の化学療法の最終投与からの期間(<3ヵ月間、≧3ヵ月間)]を層別因子とした層別ログランク検定[片側]、有意水準α=0.0123
(追跡期間中央値:14.1ヵ月)
化学療法群は治験担当医師がパクリタキセル#1、ドセタキセル#1、vinflunine#2から選択(#1:国内適応外、#2:国内未承認)
- OS中央値はキイトルーダ®群で10.3ヵ月(95%CI:8.0, 11.8)、化学療法群で7.4ヵ月(95%CI:6.1, 8.3)、12ヵ月時点の全生存率はそれぞれ43.9%(95%CI:37.8, 49.9)、30.7%(95%CI:25.0, 36.7)でした。化学療法群に対するキイトルーダ®群のOSのハザード比は0.73(95%CI:0.59, 0.91)で、有意にOSを改善しました(p=0.00224、層別ログランク検定[片側]、有意水準α=0.0123;検証的解析結果)。
主要評価項目 PD-L1高発現(CPS≧10)患者の全生存期間:OS
PD-L1高発現(CPS≧10)患者の全生存期間(OS)のKaplan-Meier曲線
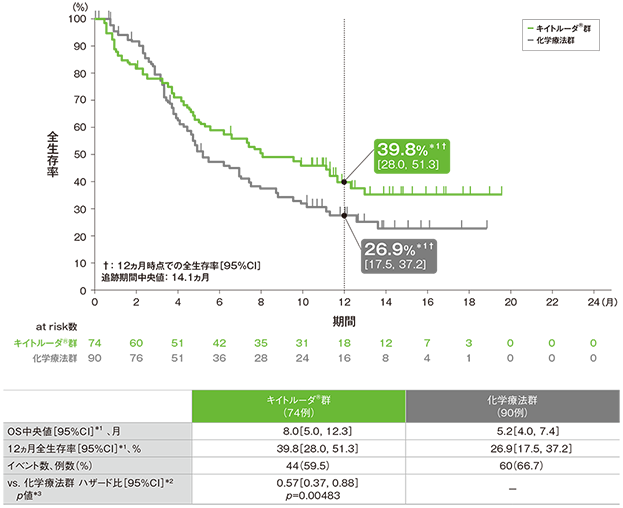
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、無作為化に用いた層別因子[ECOG PS(0/1、2)、肝転移(あり、なし)、ヘモグロビン値(<10g/dL、≧10g/dL)及び前回の化学療法の最終投与からの期間(<3ヵ月間、≧3ヵ月間)]を層別因子とした層別Cox比例ハザードモデルに基づく
*3 無作為化に用いた層別因子[ECOG PS(0/1、2)、肝転移(あり、なし)、ヘモグロビン値(<10g/dL、≧10g/dL)及び前回の化学療法の最終投与からの期間(<3ヵ月間、≧3ヵ月間)]を層別因子とした層別ログランク検定[片側]、有意水準α=0.0065
(追跡期間中央値:14.1ヵ月)
化学療法群は治験担当医師がパクリタキセル#1、ドセタキセル#1、vinflunine#2から選択(#1:国内適応外、#2:国内未承認)
- OS中央値はキイトルーダ®群で8.0ヵ月(95%CI:5.0, 12.3)及び化学療法群で5.2ヵ月(95%CI:4.0, 7.4)、12ヵ月時点の全生存率はそれぞれ39.8%(95%CI:28.0, 51.3)及び26.9%(95%CI:17.5, 37.2)でした。化学療法群に対するキイトルーダ®群のハザード比は0.57(95%CI:0.37, 0.88)で、有意にOSを改善しました(p=0.00483、層別ログランク検定[片側]、有意水準α=0.0065;検証的解析結果)。
サブグループ解析 部分集団因子別の全生存期間:OS
全生存期間(OS)の背景因子別ハザード比のフォレストプロット(ITT集団)
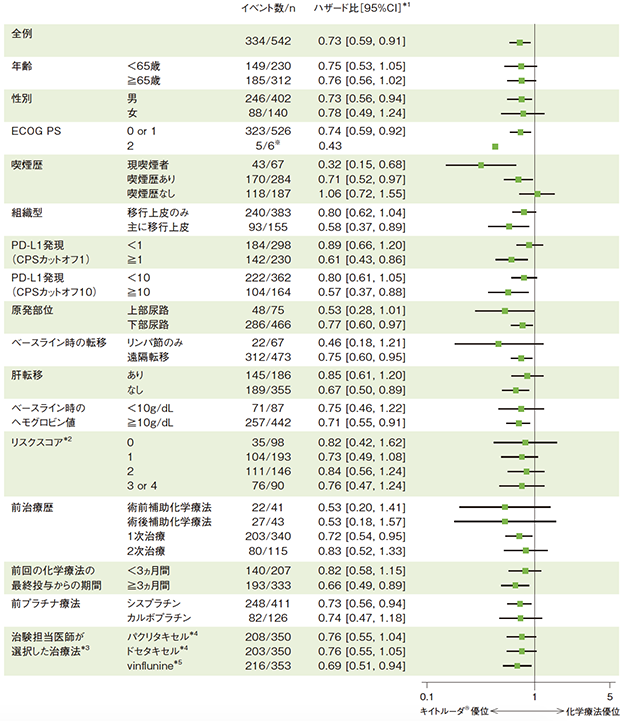
*1 投与群を共変量とし、無作為化に用いた層別因子[ECOG PS(0/1、2)、肝転移(あり、なし)、ヘモグロビン値(<10g/dL、≧10g/dL)及び前回の化学療法の最終投与からの期間(<3ヵ月間、≧3ヵ月間)]を層別因子とした層別Cox比例ハザードモデルに基づく
*2 ECOG PS(>0)、ヘモグロビン値(<10g/dL)、前回の化学療法の最終投与からの期間(<3ヵ月間)及び肝転移(あり)の4つの因子の該当数
*3 治験担当医師が無作為割り付け前に選択した化学療法
*4 国内適応外
*5 国内未承認
化学療法群は治験担当医師がパクリタキセル#1、ドセタキセル#1、vinflunine#2から選択(#1:国内適応外、#2:国内未承認)
※nが10例未満のため、ハザード比の95%CIは示していない
主要評価項目 無増悪生存期間:PFS
無増悪生存期間(PFS)のKaplan-Meier 曲線(ITT集団)
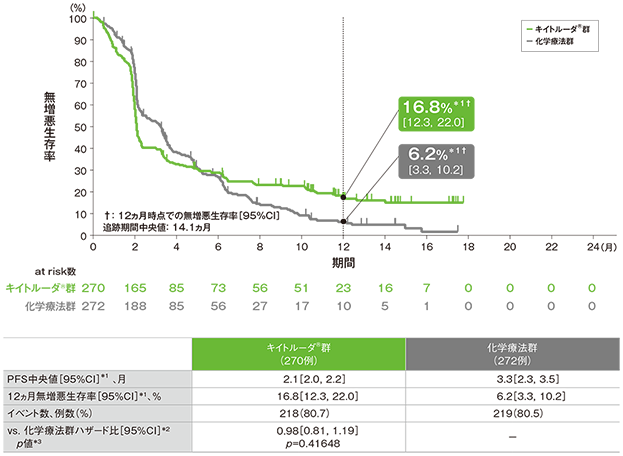
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、無作為化に用いた層別因子[ECOG PS(0/1、2)、肝転移(あり、なし)、ヘモグロビン値(<10g/dL、≧10g/dL)及び前回の化学療法の最終投与からの期間(<3ヵ月間、≧3ヵ月間)]を層別因子とした層別Cox比例ハザードモデルに基づく
*3 無作為化に用いた層別因子[ECOG PS(0/1、2)、肝転移(あり、なし)、ヘモグロビン値(<10g/dL、≧10g/dL)及び前回の化学療法の最終投与からの期間(<3ヵ月間、≧3ヵ月間)]を層別因子とした層別ログランク検定[片側]、有意水準α=0.0151
(追跡期間中央値:14.1ヵ月)
化学療法群は治験担当医師がパクリタキセル#1、ドセタキセル#1、vinflunine#2から選択(#1:国内適応外、#2:国内未承認)
主要評価項目 PD-L1高発現(CPS≧10)患者の無増悪生存期間:PFS
- 化学療法群に対するキイトルーダ®群のハザード比*1は0.89(95%CI:0.61, 1.28)*2であり、優越性が検証されませんでした(検証的解析結果)。
PFS中央値*3はキイトルーダ®群で2.1ヵ月(95%CI:1.9, 2.1)、化学療法群で3.1ヵ月(95%CI:2.2, 3.4)、12ヵ月時点の無増悪生存率はそれぞれ17.7%(95%CI:9.5, 27.9)、3.7%(95%CI:0.7, 10.9)でした。
*1 投与群を共変量とし、無作為化に用いた層別因子[ECOG PS(0/1、2)、肝転移(あり、なし)、ヘモグロビン値(<10g/dL、≧10g/dL)及び前回の化学療法の最終投与からの期間(<3ヵ月間、≧3ヵ月間)]を層別因子とした層別Cox比例ハザードモデルに基づく
*2 p=0.23958、無作為化に用いた層別因子[ECOG PS(0/1、2)、肝転移(あり、なし)、ヘモグロビン値(<10g/dL、≧10g/dL)及び前回の化学療法の最終投与からの期間(<3ヵ月間、≧3ヵ月間)]を層別因子とした層別ログランク検定[片側]、有意水準α=0.0029
*3 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
(追跡期間中央値:14.1ヵ月)
化学療法群は治験担当医師がパクリタキセル#1、ドセタキセル#1、vinflunine#2から選択(#1:国内適応外、#2:国内未承認)
副次評価項目 奏効率:ORR
奏効率: ORR:CR+PR(ITT集団)
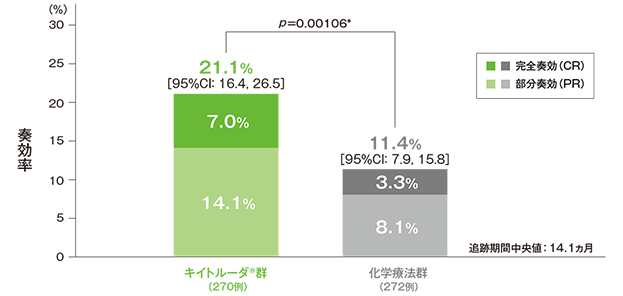
*ECOG PS(0/1、2)、肝転移(あり、なし)、ヘモグロビン値(<10g/dL、≧10g/dL)及び前回の化学療法の最終投与からの期間(<3ヵ月間、≧3ヵ月間)を層別因子とした層別Miettinen & Nurminen法[片側]、有意水準α=0.0170
奏効率及び最良総合効果(ITT集団)
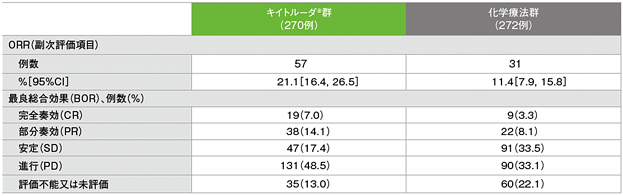
RECISTガイドライン 1.1版に基づくBICRによる評価
(追跡期間中央値:14.1ヵ月)
化学療法群は治験担当医師がパクリタキセル#1、ドセタキセル#1、vinflunine#2から選択(#1:国内適応外、#2:国内未承認)
- ORRは、キイトルーダ®群で21.1%(95%CI:16.4, 26.5)及び化学療法群で11.4%(95%CI:7.9, 15.8)であり、有意に高い値でした(p=0.00106、層別Miettinen & Nurminen法[片側]、有意水準α=0.0170)。
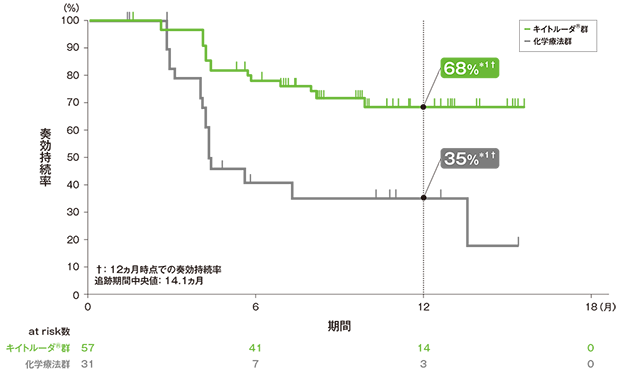
副次評価項目 奏効期間:DOR
奏効が確定した患者における奏効期間(DOR)のKaplan-Meier 曲線
奏効までの期間及び奏効期間(DOR)の要約
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 「+」は最後の疾患評価からPDがみられないことを示す
(追跡期間中央値:14.1ヵ月)
化学療法群は治験担当医師がパクリタキセル#1、ドセタキセル#1、vinflunine#2から選択(#1:国内適応外、#2:国内未承認)
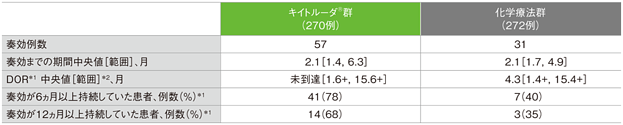
- 奏効までの期間中央値はキイトルーダ®群で2.1ヵ月(範囲:1.4, 6.3)、化学療法群で2.1ヵ月(範囲:1.7, 4.9)でした。DOR中央値はキイトルーダ®群で未到達(範囲: 1.6+, 15.6+ヵ月)及び化学療法群で4.3ヵ月(範囲:1.4+, 15.4+)でした。奏効が認められた患者のうち、データカットオフ時点において奏効が持続していた患者数は、キイトルーダ®群で41例(72%)及び化学療法群で11例(35%)でした。奏効が12ヵ月以上持続した割合は、キイトルーダ®群で68%及び化学療法群で35%でした。
奏効例における奏効までの期間及び奏効期間(DOR)
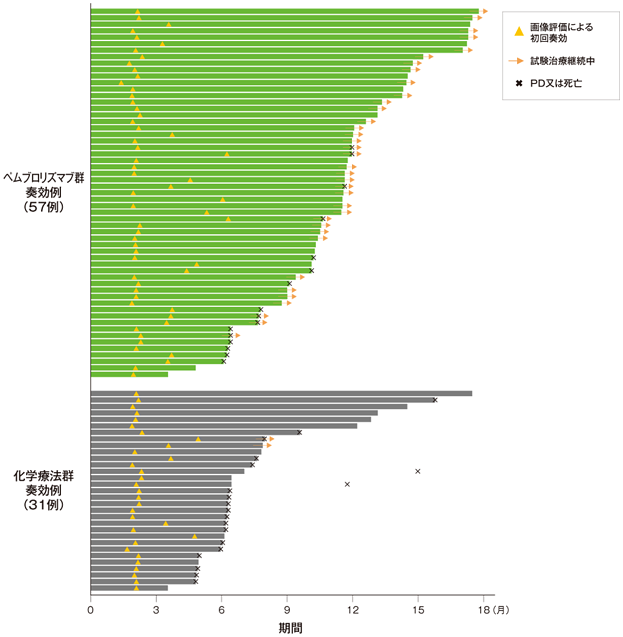
Bellmunt J et al. N Engl J Med 2017: 376: 1015-1026.
Copyright ©2017 Massachusetts Medical Society. All rights reserved. Translated with permission.
(追跡期間中央値:14.1ヵ月)
化学療法群は治験担当医師がパクリタキセル#1、ドセタキセル#1、vinflunine#2から選択(#1:国内適応外、#2:国内未承認)
探索的評価項目 健康関連QoL(参考情報)
各来院時のEORTC QLQ-C30全般的健康状態/QoLスコアの変化(FAS集団)
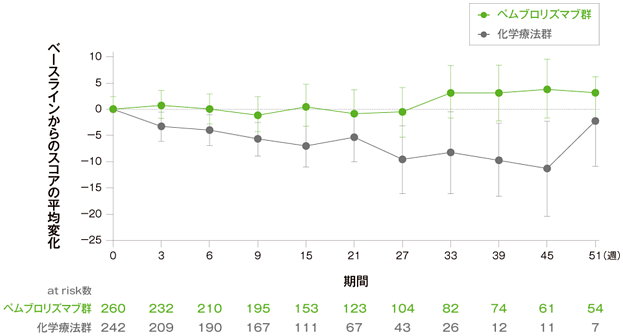
エラーバーは95%CIを示す
(追跡期間中央値:18.5ヵ月)
Adapted from Vaughn DJ et al: J Clin Oncol 2018; 36(16): 1579-1587.
© 2018 American Society of Clinical Oncology. All rights reserved.
Readers are encouraged to read the entire article for the correct context at jco.ascopubs.org.
- 15週目におけるベースラインからの平均変化量は、キイトルーダ®群では0.69 ポイント(95%CI:-2.40, 3.77)、化学療法群では-8.36 ポイント(95%CI:-11.84,-4.89)でした。
EORTC QLQ-C30について
EORTC QLQ-C30は、EORTC(European Organisation for Research and Treatment of Cancer)により開発された、がん患者の健康関連QoLの質問票です。
30の質問項目からなり、機能の5尺度(身体、役割、情緒、認知、社会的)、症状の3尺度(疲労感、悪心/嘔吐、疼痛)と6単項目(呼吸困難、不眠、食欲不振、便秘、下痢、経済的困難)、全般的健康状態/QoLの1尺度が含まれます。
Aaronson NK et al. J Natl Cancer Inst 1993; 85: 365-376.
安全性
キイトルーダ®群の副作用は162/266例(60.9%)に認められました。主な副作用(発現率10%以上)は、そう痒症52例(19.5%)、疲労37例(13.9%)、悪心29例(10.9%)でした。重篤な副作用は27例(10.2%)で認められました。2例以上にみられた重篤な副作用は肺臓炎5例(1.9%)、大腸炎4例(1.5%)、下痢2例(0.8%)でした。副作用による中止は15例(5.6%)に認められ、その内訳は肺臓炎5例(1.9%)、疲労、間質性肺疾患、自己免疫性腎炎、血中尿酸増加、脳症、肝機能検査値上昇、悪性新生物進行、粘膜の炎症、好中球数減少、尿路障害各1例(0.4%)でした。副作用による死亡は4例(1.5%)で、その内訳は、肺臓炎、尿路閉塞、悪性新生物進行、死亡が各1例(0.4%)でした。
化学療法群の副作用は230/255例(90.2%)に認められました。主な副作用(発現率10%以上)は、脱毛症96例(37.6%)、疲労71例(27.8%)、貧血63例(24.7%)、悪心62例(24.3%)、便秘52例(20.4%)、食欲減退41例(16.1%)、好中球減少症39例(15.3%)、無力症、好中球数減少各36例(14.1%)、下痢33例(12.9%)、末梢性感覚ニューロパチー28例(11.0%)、末梢性ニューロパチー27例(10.6%)でした。重篤な副作用は57例(22.4%)で認められました。2例以上にみられた重篤な副作用は発熱性好中球減少症15例(5.9%)、便秘7例(2.7%)、貧血、好中球減少症、腸閉塞各5例(2.0%)、尿路感染4例(1.6%)、好中球数減少3例(1.2%)、汎血球減少症、イレウス、麻痺性イレウス、敗血症、急性腎障害各2例(0.8%)でした。副作用による中止は28例(11.0%)に認められ、その内訳は末梢性感覚ニューロパチー5例(2.0%)、末梢性ニューロパチー4例(1.6%)、好中球減少症、疲労各2例(0.8%)、間質性肺疾患、急性腎障害、心不全、発熱性好中球減少症、注射部位反応、腸閉塞、流涙増加、倦怠感、悪心、汎血球減少症、錯感覚、血小板数減少、ニューモシスチス肺炎感染、可逆性後頭葉白質脳症、尿路感染、嘔吐各1例(0.4%)でした。副作用による死亡は4例(1.6%)で、その内訳は敗血症2例(0.8%)、敗血症性ショック、死亡各1例(0.4%)でした。
副作用(いずれかの投与群で発現率5%以上)(ASaT集団)
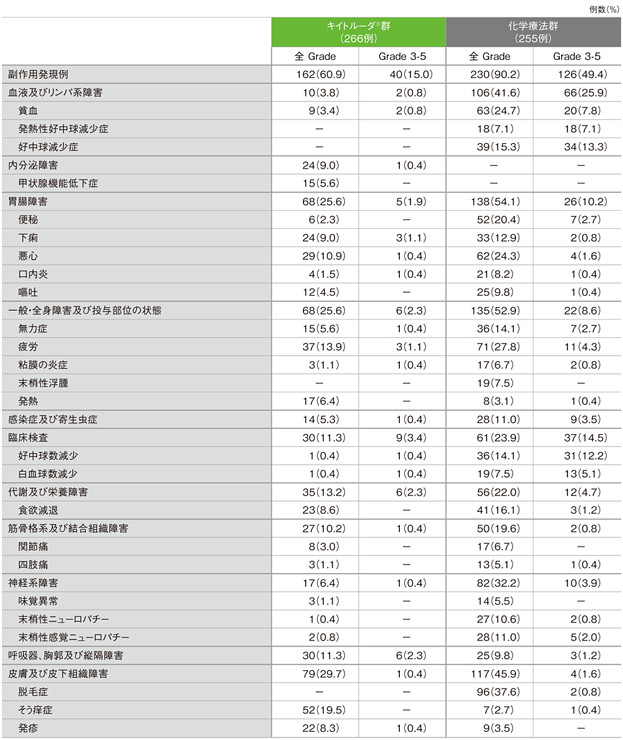
MedDRA/J v19.0、GradeはCTCAE v4.0
(追跡期間中央値:14.1ヵ月)
免疫関連など特に注目すべき有害事象
キイトルーダ®群の免疫関連など特に注目すべき有害事象は45/266例(16.9%)に認められました。主な免疫関連など特に注目すべき有害事象(発現率5%以上)は、甲状腺機能低下症17例(6.4%)でした。重篤な免疫関連など特に注目すべき有害事象は14例(5.3%)に認められ、その内訳は肺臓炎7例(2.6%)、大腸炎5例(1.9%)、腎炎2例(0.8%)、副腎機能不全1例(0.4%)でした(1例で2つの免疫関連など特に注目すべき有害事象発現者が存在しています)。起因する死亡は肺臓炎1例(0.4%)でした。
化学療法群の免疫関連など特に注目すべき有害事象は19/255例(7.5%)で、発現率5%以上の免疫関連など特に注目すべき有害事象は認められませんでした。重篤な免疫関連など特に注目すべき有害事象は2例(0.8%)に認められ、その内訳は重度の皮膚障害、甲状腺機能亢進症各1例(0.4%)でした。なお、起因する死亡例は認められませんでした。
免疫関連など特に注目すべき有害事象(ASaT集団)
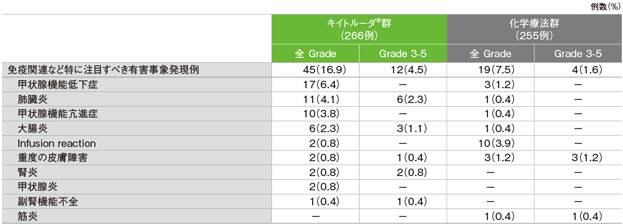
MedDRA/J v19.0、GradeはCTCAE v4.0
(追跡期間中央値:14.1ヵ月)
キイトルーダ®の投与期間中は、以下の検査スケジュールを参考に患者さんの状態を観察してください。
国際共同第Ⅲ相試験(KEYNOTE-045試験)における検査スケジュール
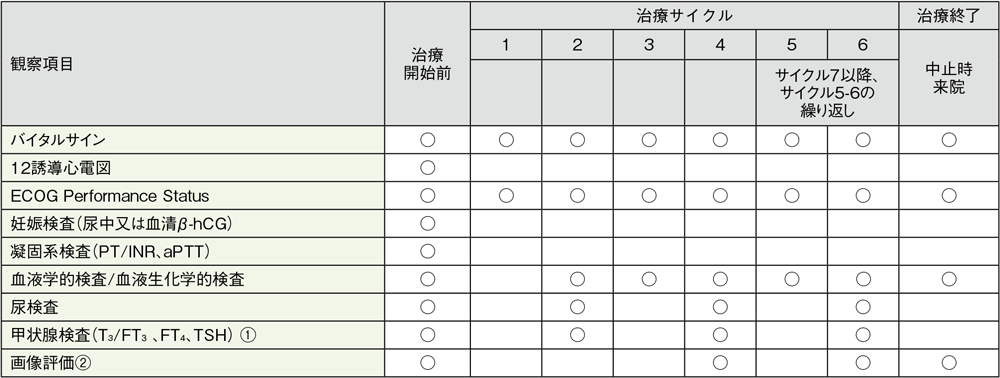
バイタルサイン:体温、脈拍、呼吸数、体重、血圧
妊娠検査:妊娠の可能性がある女性の場合に、治療開始前72時間以内に実施
血液学的検査:ヘマトクリット、ヘモグロビン、血小板数、白血球数、白血球分画、赤血球数、好中球絶対数、リンパ球絶対数
血液生化学的検査: 総蛋白、アルブミン、ALT(GPT)、AST(GOT)、ALP、HCO3–、総ビリルビン、直接ビリルビン、BUN、クレアチニン、尿酸、Na、K、Cl、Ca、P、血糖値
尿検査:潜血、糖、蛋白、比重、顕微鏡検査(異常値の場合)
①:6週毎 ②:9週以降6週毎、12ヵ月経過後は12週毎