KEYNOTE-041試験(切除不能日本人,P1)
本剤は、一部承認外の効能又は効果、用法及び用量による臨床試験の成績も含めた臨床データパッケージで評価され、承認されました。
そのため、国内で承認されている効能又は効果、用法及び用量と異なるデータも紹介しています。
悪性黒色腫:臨床試験成績:国内第Ⅰ相試験<KEYNOTE-041試験>
承認時評価資料:国内第Ⅰ相試験(KEYNOTE-041試験)
Yamazaki N et al. Cancer Chemother Pharmacol 2017; 79: 651-660
本試験は、MSD社の資金により行われた。Kazuhiko Nakagawa、Yoshio Kiyoharaは、MSD社から研究助成金を受領している。Hisashi Uhara、Tatsuya TakenouchiはMSD社から講演の謝礼を受領している。Takashi ShimamotoとKazuo NoguchiはMSD社の従業員であり、MSD社の株式を保有している。
※本試験におけるキイトルーダ®の用法及び用量は、現在承認されている用法及び用量と異なります。
試験概要
【目的】
日本人切除不能又は転移性悪性黒色腫患者に対するキイトルーダ®の安全性及び有効性を検討する。
【デザイン】
非盲検、非無作為化、多施設共同第Ⅰ相試験
【対象】
イピリムマブ未治療の局所治療が適応とならない切除不能(Ⅲ期)又は転移性(Ⅳ期)の病変を有する悪性黒色腫患者(ぶどう膜又は眼内悪性黒色腫は除く)42例
【方法】
キイトルーダ®2mg/kgを3週間間隔(Q3W)で点滴静注した。疾患進行又は投与中止理由の一つが認められるまで最長2年間投与を継続する。
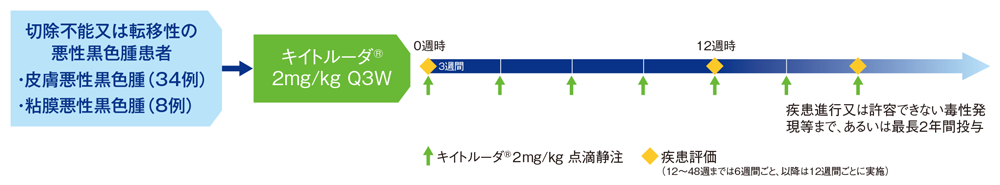
【評価項目】
主要評価項目:安全性、皮膚悪性黒色腫患者における奏効率(overall response rate: ORR)
副次評価項目:皮膚悪性黒色腫患者における奏効期間(duration of response: DOR)、皮膚悪性黒色腫患者における無増悪生存期間(progression free survival: PFS)、皮膚悪性黒色腫患者における全生存期間(overall survival: OS)など
探索的評価項目:粘膜悪性黒色腫患者における有効性(ORR、DOR、PFS、OS)など
【判定基準】
奏効及び疾患進行は、IRCがRECISTガイドライン1.1版に基づき評価した。
【解析計画】
解析対象集団: 主な有効性解析(ORR、DOR、PFS)は皮膚悪性黒色腫及び粘膜悪性黒色腫のFAS集団*1、OSの解析及び安全性解析は皮膚悪性黒色腫及び粘膜悪性黒色腫のAPaT集団*2を対象として行った。
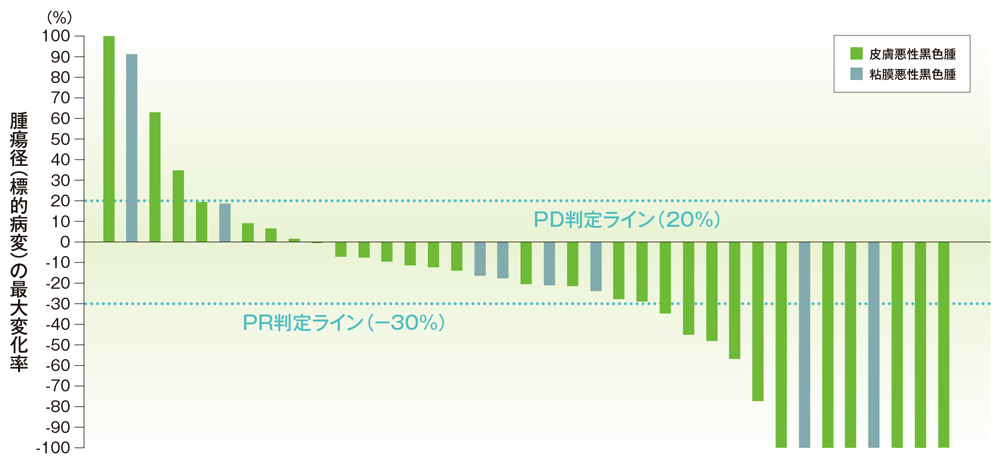
有効性の統計手法: ORRについて、二項分布の正確検定に基づく95%信頼区間(95%CI)を算出した。有効性の基準(治験の成功基準)は、真のORRを35%と仮定し、有意水準片側2.5%、95%CIの下限を10%とした。主要な解析対象集団(FAS)では、奏効のデータがない患者は無効例としてカウントした。また、BRAF 変異(野生型、変異型)、PD-L1発現状況(陽性、陰性)、NRAS 及びc-KIT の遺伝子変異の有効性及び安全性のサブグループ解析を実施した。PFS、OS及びDORは、Kaplan-Meier法を用いて生存曲線を推定し、中央値を算出した。有効性の評価項目は、フォレストプロット、スイマーズプロット、ウォーターフォールプロット、スパイダープロットにより解析を行った。
*1 FAS(full analysis set)集団: ベースライン時に独立判定委員会(Independent Review Committee: IRC)評価で確認された測定可能病変があり、治験薬を1回も投与されていない患者を除いた、すべての割り付けされた患者
*2 APaT(all patients as treated)集団: 治験薬を少なくとも1回投与されたすべての割り付けされた患者
4. 効能又は効果(抜粋)
悪性黒色腫
6. 用法及び用量(抜粋)
〈悪性黒色腫〉
通常、成人には、ペムブロリズマブ(遺伝子組換え)として、1回200mgを3週間間隔又は1回400mgを6週間間隔で30分間かけて点滴静注する。ただし、術後補助療法の場合は、投与期間は12ヵ月間までとする。
8. 重要な基本的注意
8.1 本剤のT細胞活性化作用による、過度の免疫反応に起因すると考えられる様々な疾患、8.2 間質性肺疾患、8.3 甲状腺機能障害、下垂体機能障害及び副腎機能障害、8.4 劇症肝炎、肝不全、肝機能障害、肝炎、硬化性胆管炎、8.5 1型糖尿病、8.6 腎障害、8.7 筋炎、横紋筋融解症、8.8 重症筋無力症、8.9 心筋炎、8.10 ぶどう膜炎等の重篤な眼障害があらわれることがあるので注意が必要です。詳細は「製品情報:基本情報>「警告・禁忌」等その他の注意」をご参照ください。
患者背景
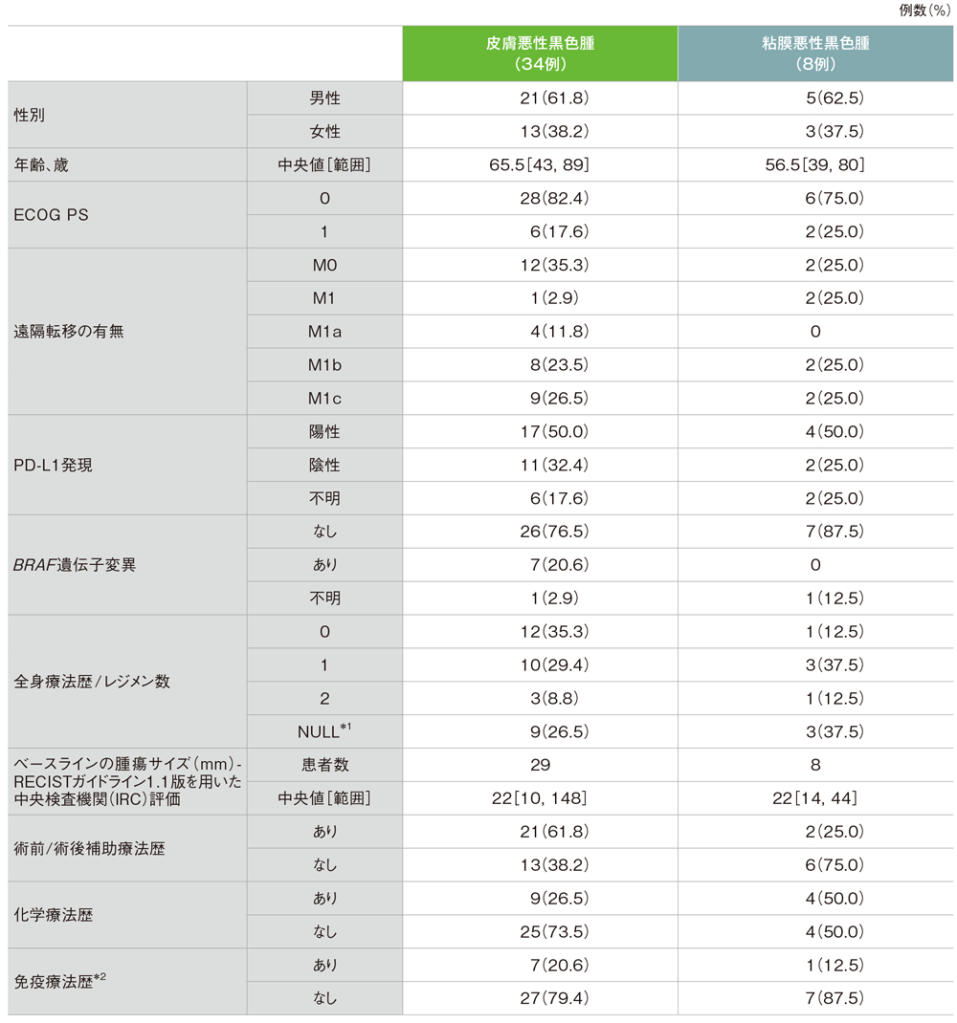
ECOG: Eastern Cooperative Oncology Group PS:performance status
*1 全身療法として術前/術後補助療法のみの治療歴がある場合は「0」、術前/術後補助療法も含め全身療法の治療歴がない場合を「NULL」とした
*2 悪性腫瘍に対する免疫療法(試験実施時、イピリムマブ及びBRAF阻害剤は本邦未承認であったため、すべての患者で未投与)
主な有効性(FAS集団)
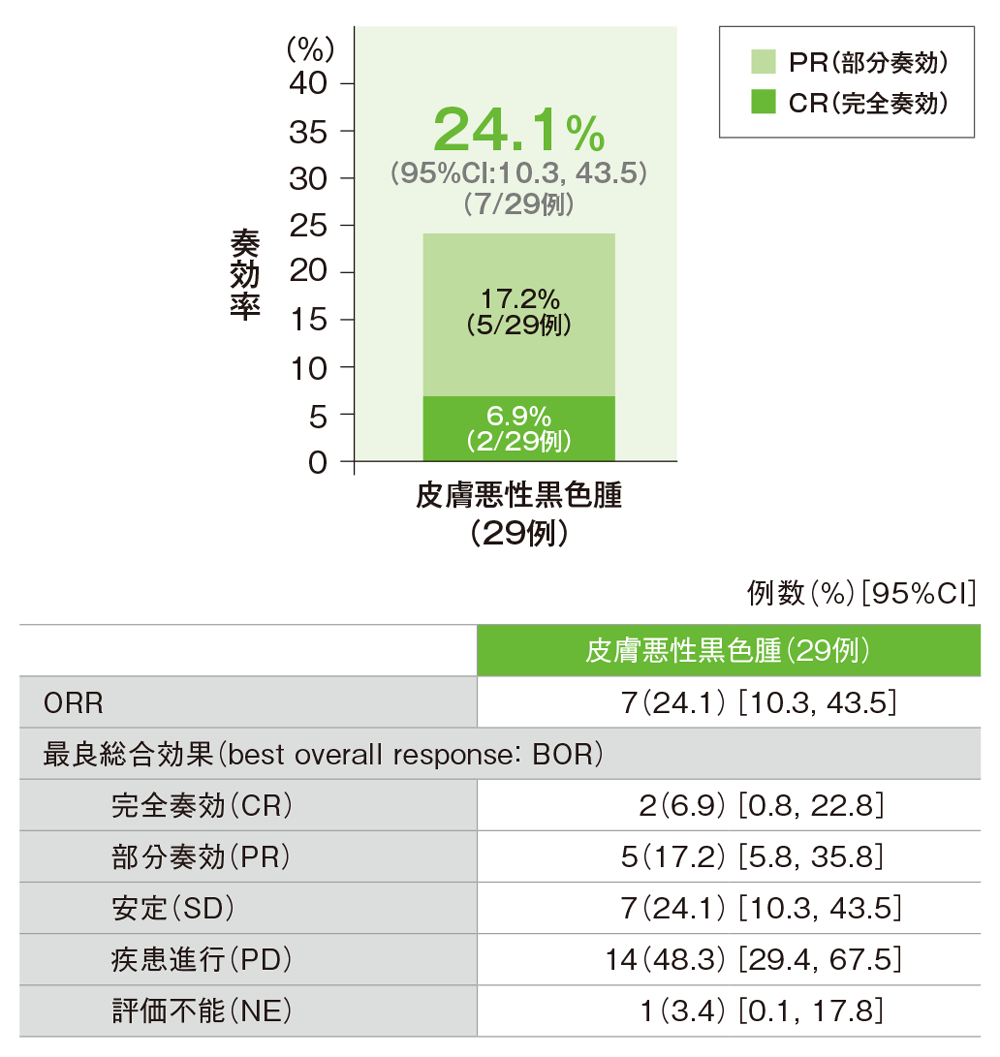
- 皮膚悪性黒色腫及び粘膜悪性黒色腫のORRは24.1%(95%CI: 10.3, 43.5)及び2/8例でした。
- 12ヵ月生存率は皮膚悪性黒色腫で82.7%でした。
主要評価項目 皮膚悪性黒色腫患者における奏効率(ORR)
副次評価項目 皮膚悪性黒色腫患者における奏効期間(DOR)、無増悪生存期間(PFS)、全生存期間(OS)
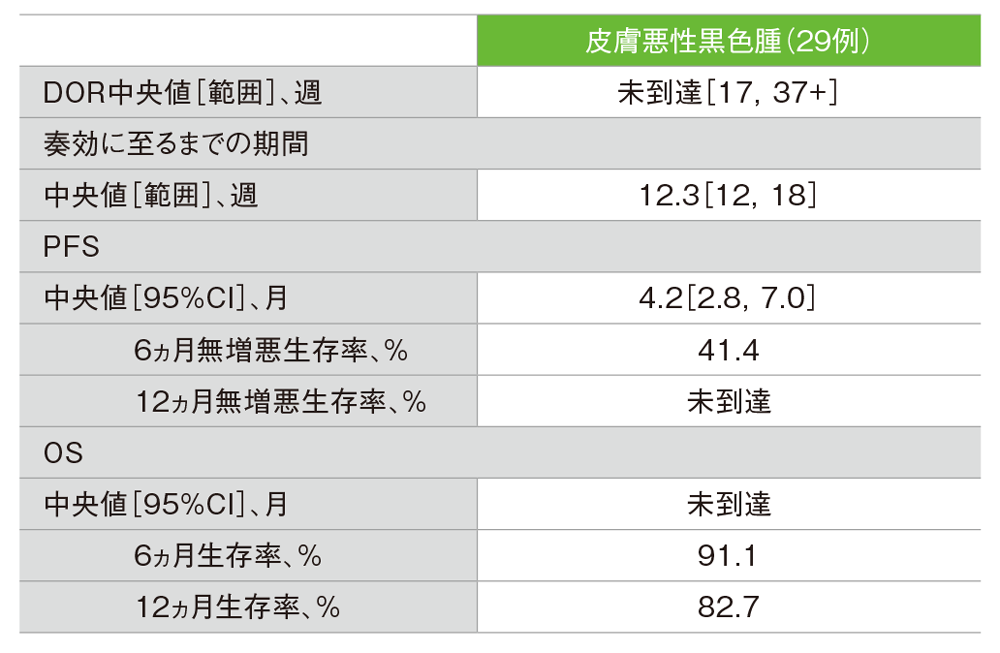
「+」は最後の疾患評価までPDがみられなかったことを示す
投与期間中央値212.5日[範囲:1, 385]
探索的評価項目 粘膜悪性黒色腫患者における有効性(ORR、DOR、PFS、OS)
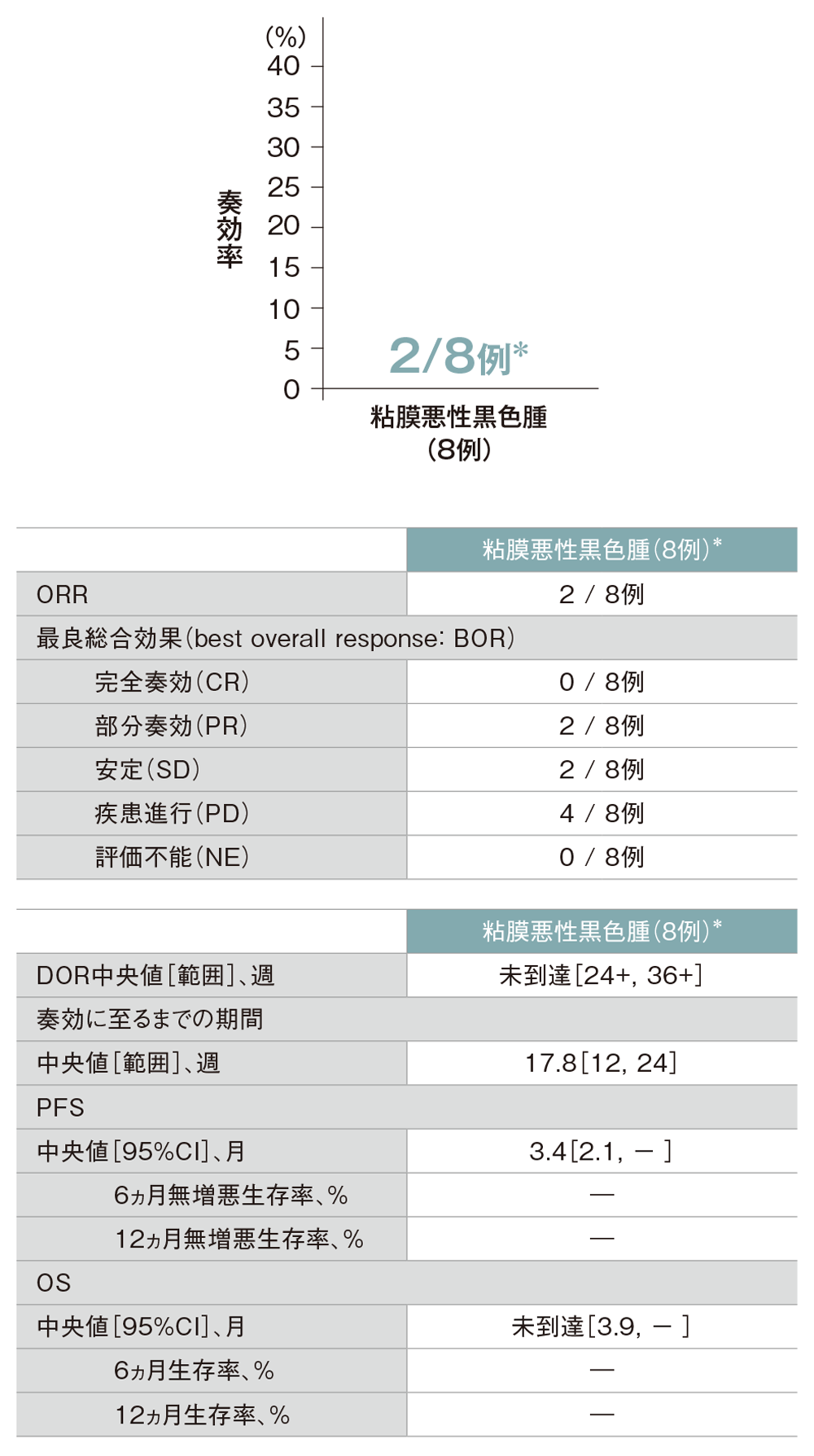
* 解析対象症例が10例未満のために例数表記又は「―」とした
「+」は最後の疾患評価までPDがみられなかったことを示す
投与期間中央値212.5日[範囲:1, 385]
副次評価項目 皮膚悪性黒色腫患者における奏効期間(DOR)
探索的評価項目 粘膜悪性黒色腫患者における奏効期間(DOR)
- 奏効が認められた皮膚悪性黒色腫患者7例のうち5例、及び粘膜悪性黒色腫患者2例のうち2例で奏効の持続が観察されました。データカットオフ時点における奏効期間の中央値は未到達でした。
ベースラインからの腫瘍径の経時的変化率(スパイダープロット)(FAS集団*)
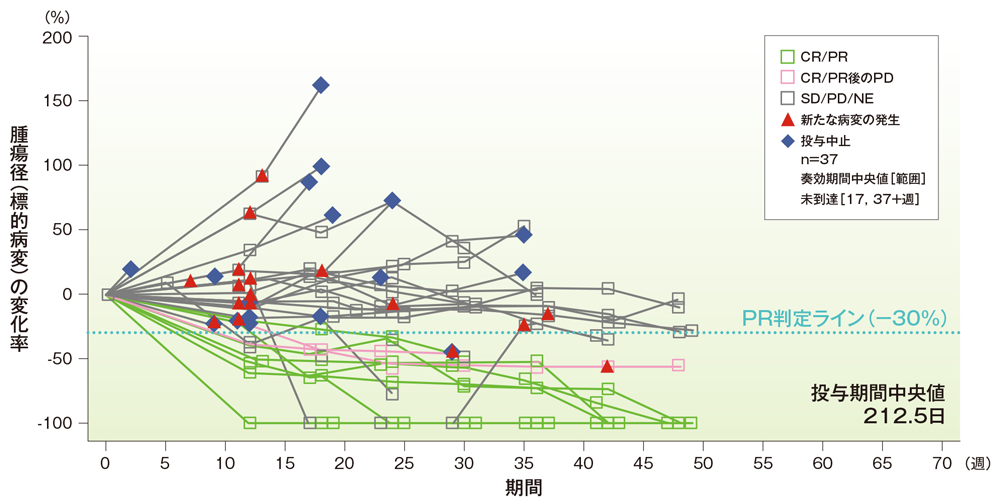
*腫瘍径(標的病変)の変化率が200%を超える1例を除外している
ベースラインからの腫瘍径の最大変化率(ウォーターフォールプロット)(FAS集団)
安全性
主な副作用(APaT集団)
- 副作用は34/42例(81.0%)に認められました。主な副作用(発現率10%以上)は、そう痒症、斑状丘疹状皮疹各6例(14.3%)及び倦怠感5例(11.9%)でした。
- 重篤な副作用は10例(23.8%)に認められ、その内訳は下垂体炎が2例(4.8%)、貧血、腹痛、大腸炎、下痢、死亡、胆管閉塞、肺感染、高血糖、脳出血、脳症、肺臓炎、薬疹が各1例(2.4%)でした。
- 副作用による中止は5例(11.9%)で、その内訳は下垂体炎、死亡、肺感染、高血糖、脳出血、脳症、及び肺臓炎が各1例(2.4%)でした。肺臓炎と肺感染は同一症例、脳症と脳出血も同一症例に認められました。
- 副作用による死亡は2例(4.8%)で、その内訳は原因不明の死亡(転落による死亡)及び脳出血でした。
主な副作用(発現率5%以上)(APaT集団)
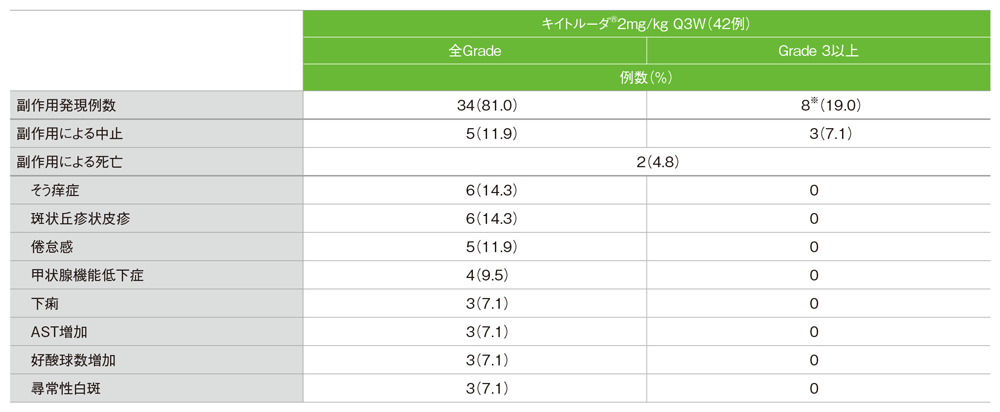
*Grade3以上の副作用の内訳:貧血2例。リンパ球減少症、下垂体炎、大腸炎、死亡、胆管閉塞症、高血糖症、脳出血、脳症、薬疹は各1例
MedDRA/J v18.0、GradeはCTCAE v4.0
免疫関連など特に注目すべき有害事象(APaT集団)
- 主な免疫関連の有害事象(発現率5%以上)は、甲状腺機能低下症5例(11.9%)及び下垂体炎3例(7.1%)でした。
免疫関連など特に注目すべき有害事象(APaT集団)
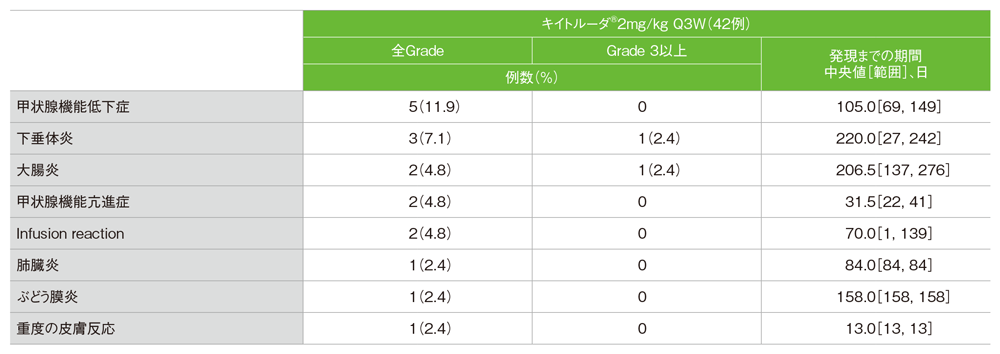
MedDRA/J v18.0、GradeはCTCAE v4.0