KEYNOTE-001試験(切除不能, P1)
本剤は、一部承認外の効能又は効果、用法及び用量による臨床試験の成績も含めた臨床データパッケージで評価され、承認されました。
そのため、国内で承認されている効能又は効果、用法及び用量と異なる海外データも紹介しています。
悪性黒色腫:臨床試験成績:海外第Ⅰ相試験<KEYNOTE-001試験:パートD>(海外データ)
承認時評価資料:海外第Ⅰ相試験(KEYNOTE-001試験)
Hamid O et al. N Engl J Med 2013; 369: 134-144
Robert C et al. Lancet 2014; 384: 1109-1117
本試験は、MSD社の資金提供により行われた。Omid HamidはMSD社からコンサルタント料を受領している。Caroline RobertはMSD社から顧問料を受領している。また、著者のうち、Kevin Gergich、Jeroen Elassaiss-Schaap、Xiaoyun Nicole Li、Robert Iannone、Scot W Ebbinghaus、S Peter KangはMSD社の社員である。その他の著者にMSD社より研究費や顧問料、講演料などを受領している者が含まれる。
※本試験におけるキイトルーダ®の用法及び用量は、現在承認されている用法及び用量と異なります。
試験概要
【目的】
切除不能又は転移性悪性黒色腫患者に対するキイトルーダ®の安全性及び有効性を検討する(パートD:キイトルーダ®2mg/kg又は10mg/kg 3週間間隔(Q3W)の用法及び用量で評価する)。
【デザイン】
多施設共同、非盲検、第Ⅰ相試験(パートD:無作為化試験)
【対象】
切除不能又は転移性悪性黒色腫患者(パートD:イピリムマブ未治療患者)103例
【方法】
キイトルーダ®2mg/kg Q3W群又は10mg/kg Q3W群に1:1の割合で無作為に割り付けした。12週間ごとに疾患評価を実施し、疾患進行又は許容できない毒性が認められるまで治療を継続した。
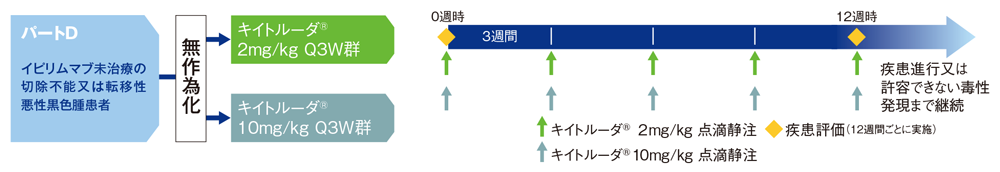
【評価項目】
主要評価項目:安全性、奏効率(overall response rate: ORR)
副次評価項目:全生存期間(overall survival: OS)など
【判定基準】
主要評価項目における奏効及び疾患進行は、独立した放射線科医及び腫瘍専門医がRECISTガイドライン1.1版に基づき盲検下で評価した。
副次評価項目は、RECISTガイドライン1.1版に基づく独立した放射線科医及び腫瘍専門医による評価、及び免疫療法のための治療効果判定基準(irRC)を用いた治験担当医師の評価とした。
【解析計画】
解析対象集団: 主な有効性解析(ORR、DCR、DOR)はFAS集団*1を対象として実施し、APaT集団*2でも副次的に実施した。PFSとOSの解析はAPaT集団のみとした。安全性の解析はAPaT集団を対象に実施した。
有効性の統計手法: ORR及びDCRは、二項分布に基づく正確法により95%信頼区間(CI)を算出した。OS、PFS及びDORはKaplan-Meier法により生存曲線を推定した。ORRの用法・用量間の比較はMiettinen & Nurminen法により評価した。閾値奏効率は10%と設定した。PFS及びOSは、投与群を共変量としたCox比例ハザードモデルを用いてハザード比及びその95%Clを算出し、用法・用量間の比較はログランク検定を用いて評価した。
*1 FAS(full analysis set)集団: ベースライン時に独立判定委員会(Independent Review Committee: IRC)評価で確認された測定可能病変があり、治験薬を1回も投与されていない患者を除いた、すべての割り付けされた患者
*2 APaT(all patients as treated)集団: 治験薬を少なくとも1回投与されたすべての割り付けされた患者
4. 効能又は効果(抜粋)
悪性黒色腫
6. 用法及び用量(抜粋)
〈悪性黒色腫〉
通常、成人には、ペムブロリズマブ(遺伝子組換え)として、1回200mgを3週間間隔又は1回400mgを6週間間隔で30分間かけて点滴静注する。ただし、術後補助療法の場合は、投与期間は12ヵ月間までとする。
8. 重要な基本的注意
8.1 本剤のT細胞活性化作用による、過度の免疫反応に起因すると考えられる様々な疾患、8.2 間質性肺疾患、8.3 甲状腺機能障害、下垂体機能障害及び副腎機能障害、8.4 劇症肝炎、肝不全、肝機能障害、肝炎、硬化性胆管炎、8.5 1型糖尿病、8.6 腎障害、8.7 筋炎、横紋筋融解症、8.8 重症筋無力症、8.9 心筋炎、8.10 ぶどう膜炎等の重篤な眼障害があらわれることがあるので注意が必要です。詳細は「製品情報:基本情報>「警告・禁忌」等その他の注意」をご参照ください。
患者背景
パートD(APaT集団)
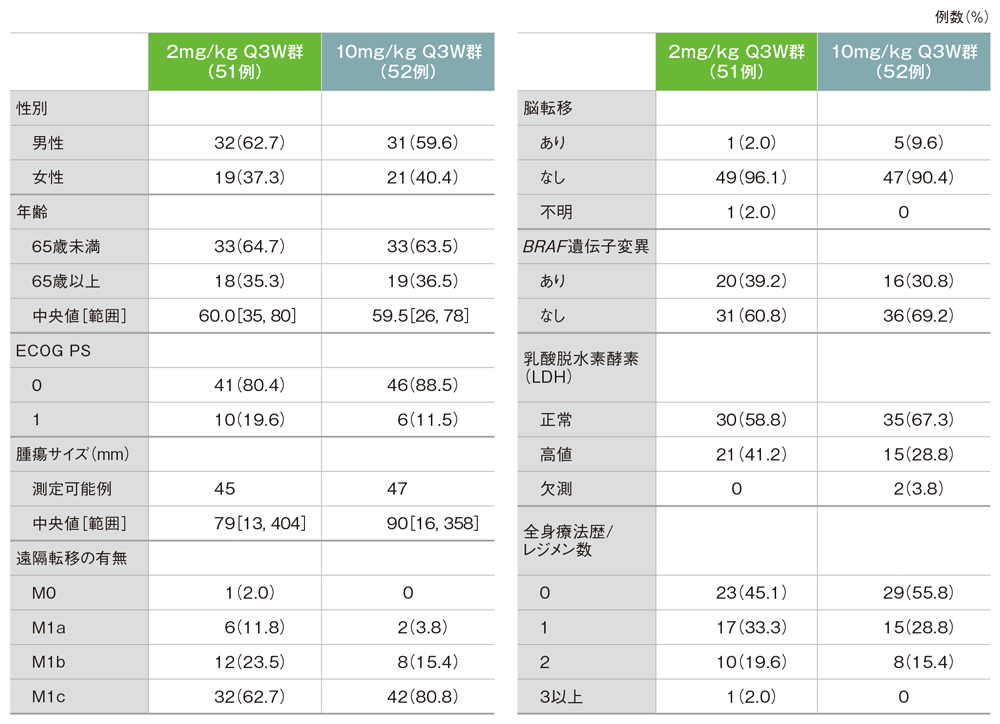
ECOG:Eastern Cooperative Oncology Group PS:performance status
主要評価項目 安全性
- キイトルーダ®2mg/kg Q3W群で副作用は44/51例(86.3%)に認められました。主な副作用(発現率10%以上)は疲労17例(33.3%)、関節痛12例(23.5%)、発疹11例(21.6%)、そう痒症9例(17.6%)、下痢及び甲状腺機能低下症各8例(15.7%)、悪心及び嘔吐各6例(11.8%)でした。重篤な副作用は7例(13.7% )で、その内訳は心膜液貯留、心膜炎、大腸炎、下痢、悪心、嘔吐、疲労、脱水症、インスリン抵抗性糖尿病、呼吸困難、末梢性虚血が各1例(2.0%)でした。副作用による中止はインスリン抵抗性糖尿病が1例(2.0%)にみられました。副作用による死亡例はみられませんでした。
- キイトルーダ®10mg/kg Q3W群で副作用は47/52例(90.4%)に認められました。主な副作用(発現率10%以上)は疲労23例(44. 2%)、そう痒症16例(30.8%)、筋肉痛12例(23.1%)、発疹及び関節痛が11例(21.2%)、悪心10例(19.2%)、下痢9例(17.3%)、尋常性白斑7例(13.5%)でした。重篤な副作用は4例(7.7%)で、その内訳は大腸炎が2例(3.8%)、全身健康状態低下、発熱、結核、急性腎不全が各1例(1.9%)でした。副作用による中止は3例(5.8%)にみられ、その内訳は大腸炎、関節痛、筋炎が各1例(1.9%)でした。副作用による死亡例はみられませんでした(投与期間平均値2mg/kg Q3W群285日、10mg/kg Q3W群277日)。
主要評価項目 奏効率:ORR
- 奏効率(ORR)はキイトルーダ®2mg/kg Q3W群で33.3%(95%CI: 20.0, 49.0)、10mg/kg Q3W群で38.3%(95%CI: 24.5, 53.6)であり、用法・用量群間で有意差は認められませんでした(p=0.6216、Miettinen & Nurminen法[両側]、有意水準α=0.2)。
副次評価項目 全生存期間:OS
- OSはキイトルーダ®2mg/kg Q3W群及び10mg/kg Q3W群ともに中央値に未到達、10mg/kg Q3W群に対する2mg/kg Q3W群のハザード比は0.81(95%CI: 0.44, 1.50)であり、両群間に有意差は認められませんでした(p=0.507、ログランク検定[両側]、有意水準α=0.2)。
- 18ヵ月生存率は2mg/kg Q3W群で61.4%、10mg/kg Q3W 群で55.2%でした。
全生存期間(OS)のKaplan-Meier曲線(APaT集団)
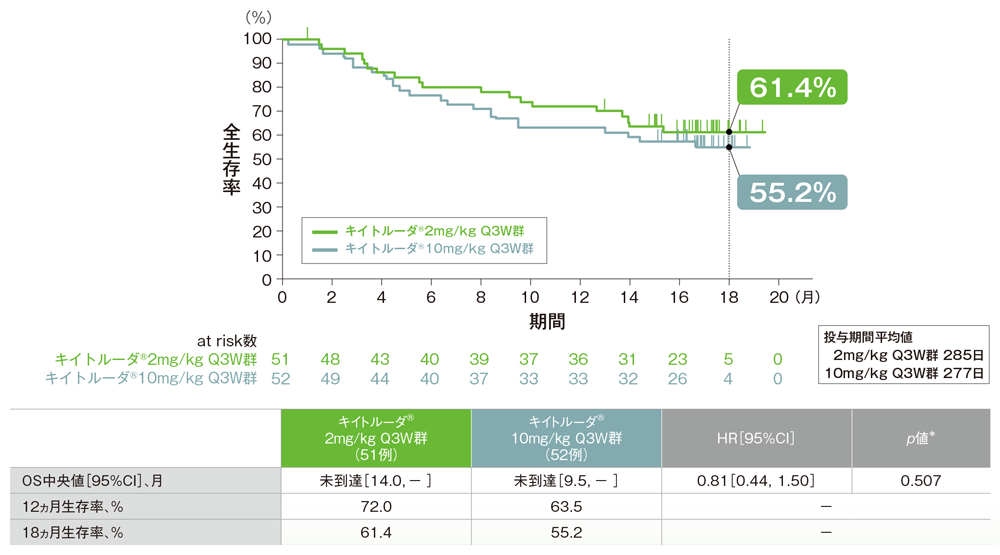
* ログランク検定[両側](有意水準α=0.2)