国際共同第Ⅲ相試験:長期継続投与試験(CHEST-2)
外科的治療不適応又は外科的治療後に残存・再発したCTEPHに対するアデムパス®の臨床成績
国際共同第Ⅲ相試験:長期継続投与試験(CHEST-2)
承認時評価資料:バイエル薬品社内資料[慢性血栓塞栓性肺高血圧症患者を対象とした第Ⅲ相試験の長期継続投与試験]
Simonneau G et al. Eur Respir J. 45, 1293(2015)(COI:本研究はバイエル社の資金により実施された、著者にバイエル社員(3名)を含む、著者にバイエル社より講演料等を受領している者を含む)
試験概要
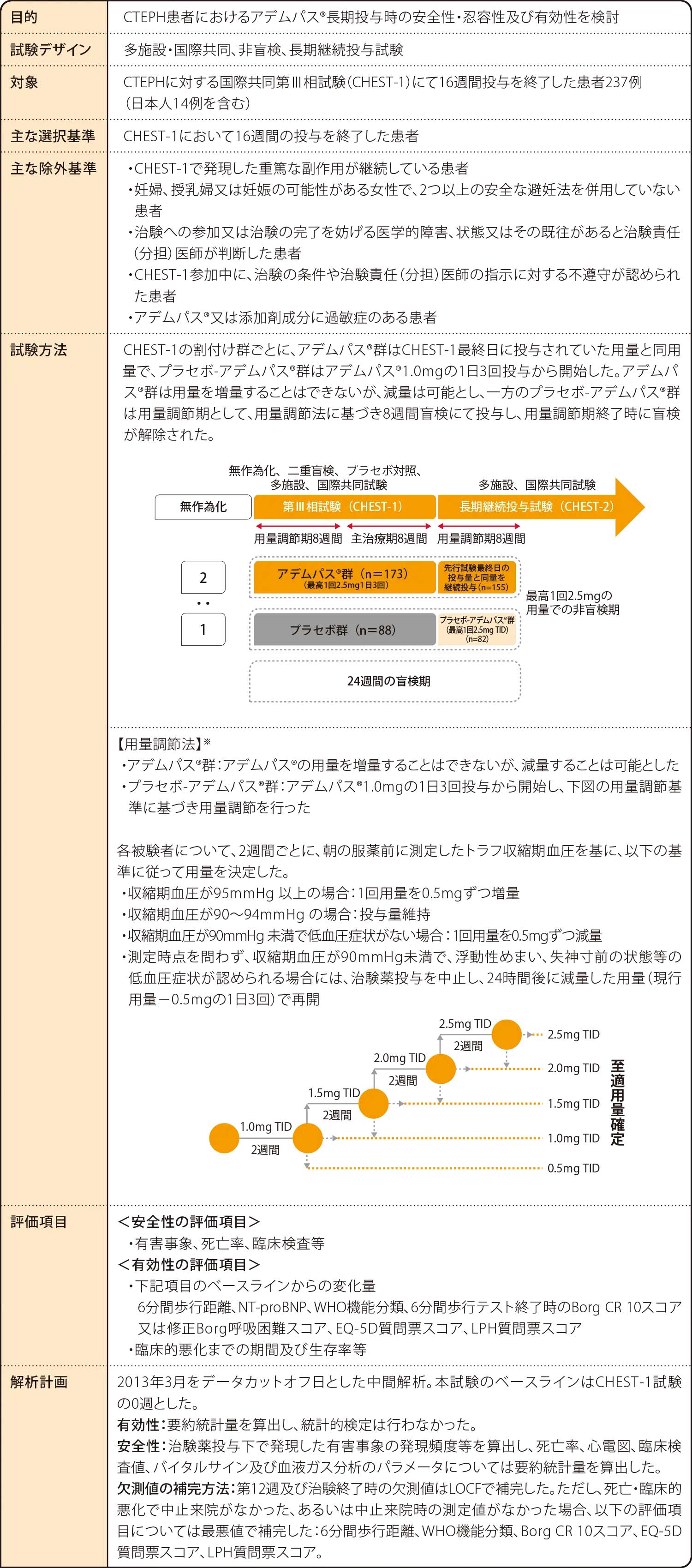
CTEPH(chronic thromboembolic pulmonary hypertension):慢性血栓塞栓性肺高血圧症
TID:1日3回
NT-proBNP(N-terminal prohormone of brain natriuretic peptide):ヒト脳性ナトリウム利尿ペプチド前駆体N端フラグメント
4. 効能又は効果(抜粋)
○外科的治療不適応又は外科的治療後に残存・再発した慢性血栓塞栓性肺高血圧症
※ 用量調節時の指標として用いる収縮期血圧について、第Ⅲ相試験ではその基準値を“95mmHg以上”、“90~94mmHg”及び“90mmHg未満”に分けたが、[承認用法及び用量]では日常臨床においてより実用的なものにするため、“95mmHg以上”と“95mmHg未満”の2つに分けた。
6. 用法及び用量
用量調節期:通常、成人にはリオシグアトとして1回1.0mg 1日3回経口投与から開始する。2週間継続して収縮期血圧が95mmHg以上で低血圧症状を示さない場合には、2週間間隔で1回用量を0.5mgずつ増量するが、最高用量は1回2.5mg 1日3回までとする。収縮期血圧が95mmHg未満でも低血圧症状を示さない場合は、現行の用量を維持するが、低血圧症状を示す場合には、1回用量を0.5mgずつ減量する。
用量維持期:用量調節期に決定した用量を維持する。用量維持期においても、最高用量は1回2.5mg 1日3回までとし、低血圧症状を示すなど、忍容性がない場合には、1回用量を0.5mgずつ減量する。
安全性
中間解析での副作用発現率は、アデムパス®群で45.2%(70/155例)、プラセボ-アデムパス®群で47.6%(39/82例)でした。
副作用
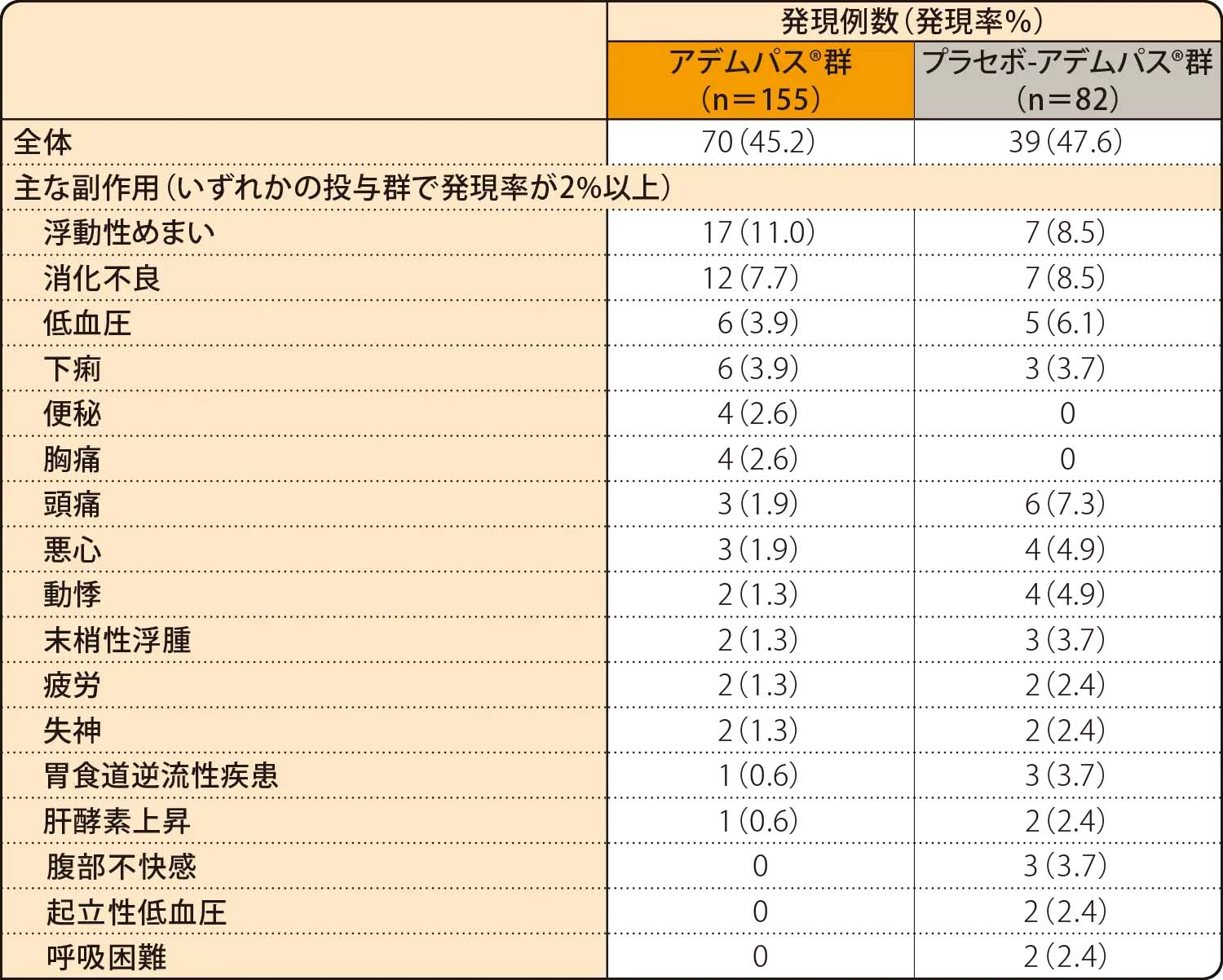
安全性解析対象集団
MedDRA version 15.1
副作用:治験薬と関連のある有害事象/治験薬投与下
重篤な副作用は、アデムパス®群で8例(5.2%)、プラセボ-アデムパス®群で4例(4.9%)に認められ、失神がアデムパス®群で2例(1.3%)及びプラセボ-アデムパス®群で2例(2.4%)、低血圧がアデムパス®群で2例(1.3%)、肺感染、浮動性めまい、精神的機能代償不全、肺高血圧症がアデムパス®群で各1例(0.6%)、プリンツメタル狭心症及び失神寸前の状態がプラセボ-アデムパス®群で各1例(1.2%)に認められました。
投与中止に至った副作用は、アデムパス®群で2例(1.3%)、プラセボ-アデムパス®群で2例(2.4%)に認められ、精神的機能代償不全及び肺高血圧症がアデムパス®群で各1例(0.6%)、上腹部痛、悪心、頭痛、プリンツメタル狭心症がプラセボ-アデムパス®群で各1例(1.2%)認められました。
本試験において死亡に至った副作用は認められませんでした。
有効性
237例(日本人14例を含む)を対象とした中間解析の結果、アデムパス®群(155例)におけるCHEST-1試験ベースラインからの平均変化量は、CHEST-2試験投与12週後(145例)で61.1m、投与6ヵ月後(143例)で60.4m、投与9ヵ月後(143例)で52.8m、投与1年後(114例)で58.6mでした。
6分間歩行距離のCHEST-1試験ベースラインからの平均変化量の推移は以下の通りでした。
6分間歩行距離のCHEST-1試験ベースラインからの平均変化量の推移
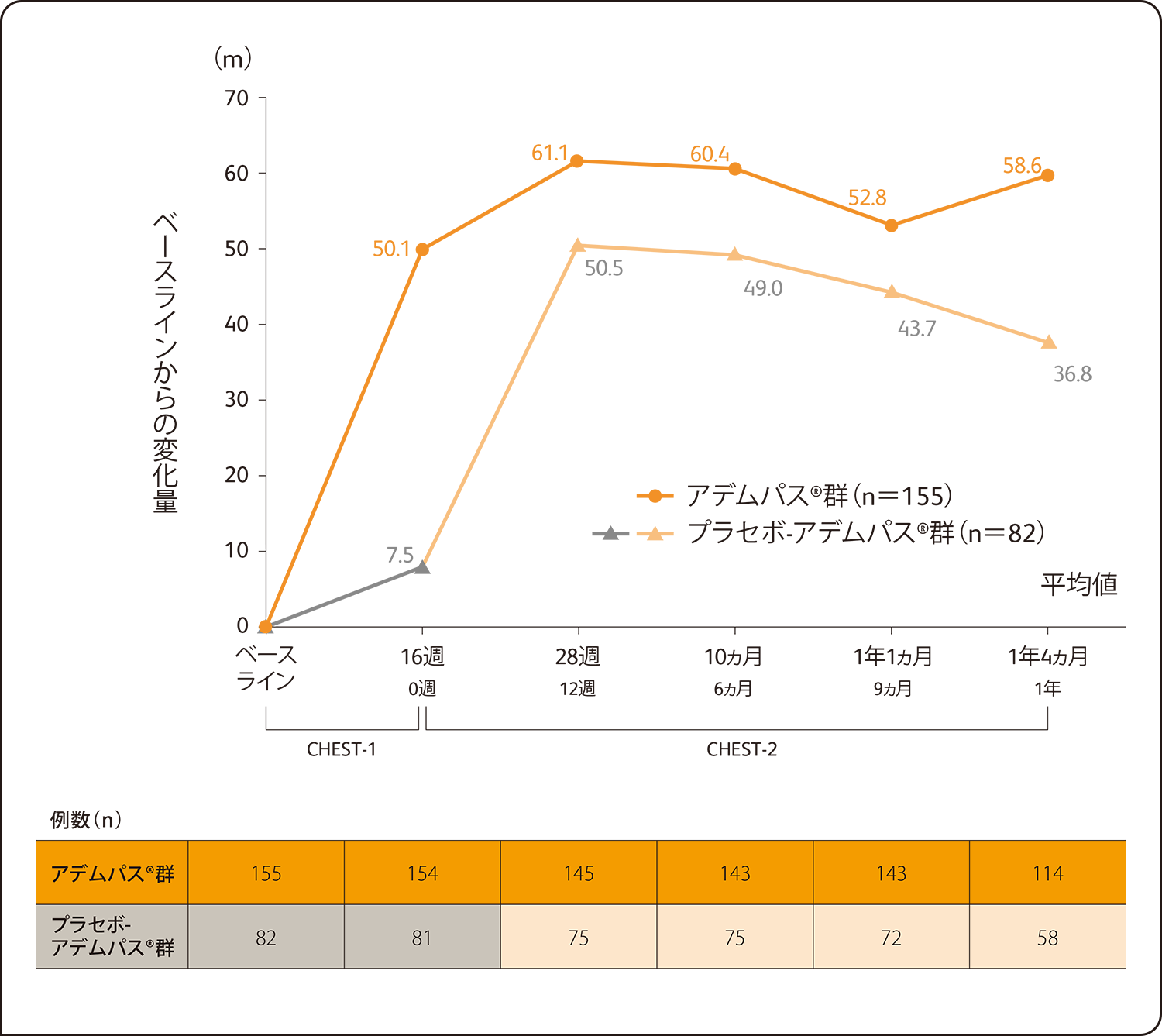
SAF解析による評価
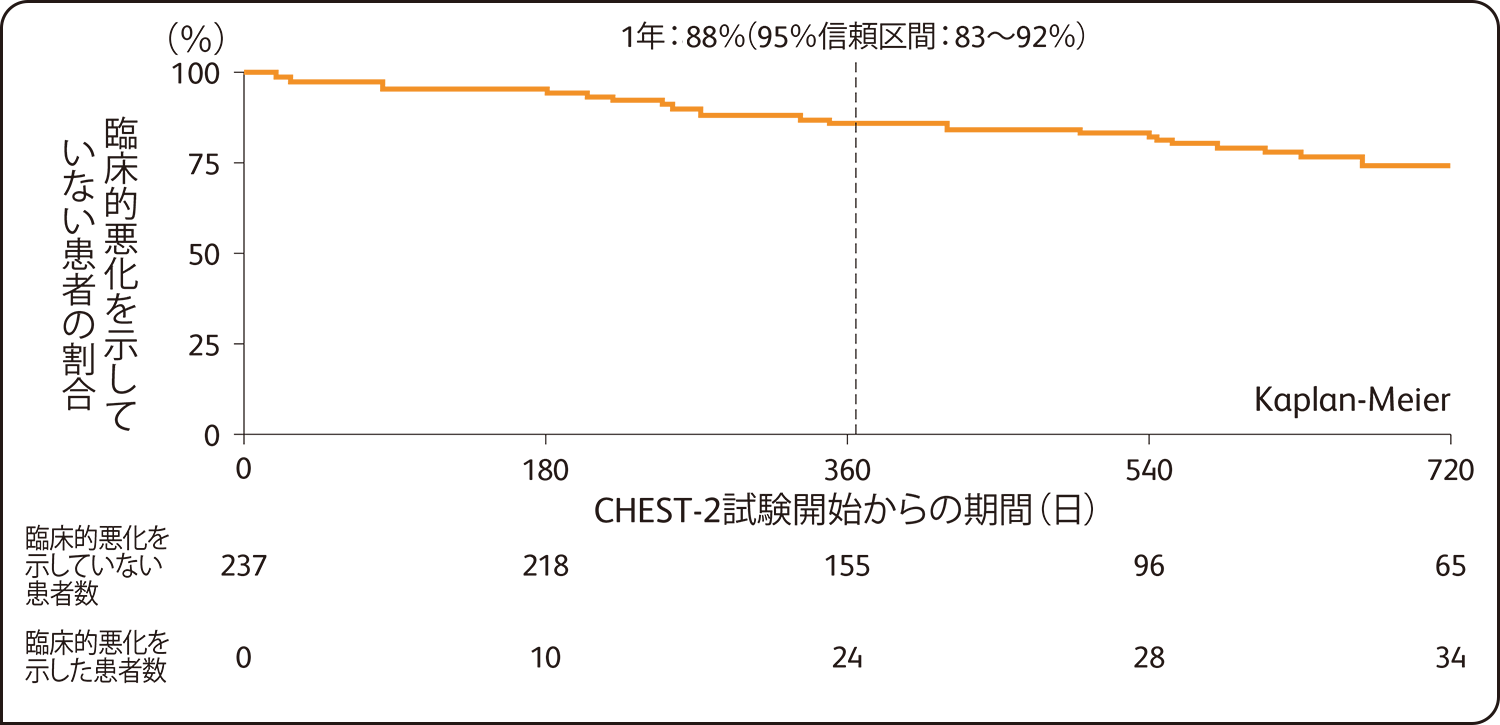
237例(日本人14例を含む)を対象とした中間解析の結果、CHEST-2試験開始から中間解析までの期間中、臨床的悪化を示した患者の割合は、CHEST-2試験全症例の16%(38例)でした。
臨床的悪化

PH(pulmonary hypertension):肺高血圧症
CHEST-2試験開始から1年後の臨床的悪化を示していない患者の割合は88%(95%信頼区間:83~92%)、生存率は97%(95%信頼区間:93~98%)でした。
臨床的悪化を示していない患者の割合(CHEST-2試験 全症例 n=237)
生存率(CHEST-2試験 全症例 n=237)
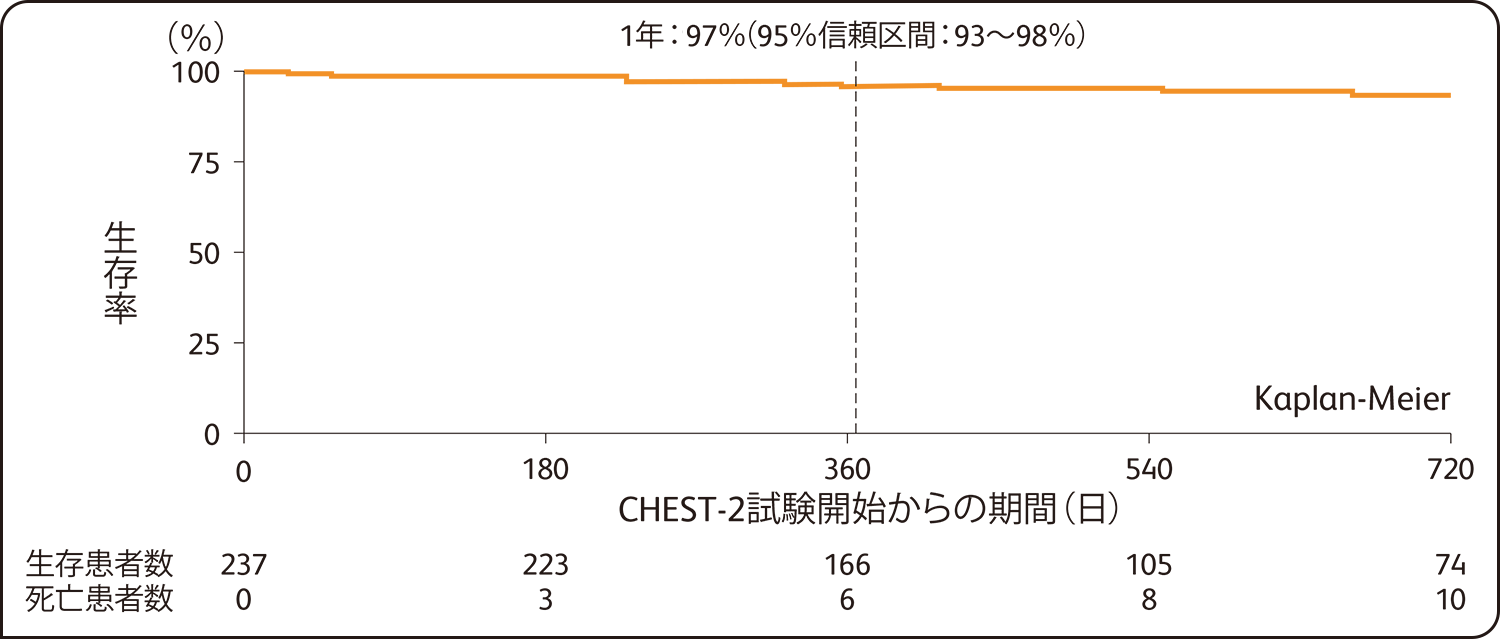
SAF解析による評価
Simonneau G et al. Eur Respir J. 45, 1293(2015)より改変
Reproduced with permission of the ©ERS 2023. European Respiratory Journal 45 (5) 1293-1302; DOI: 10.1183/09031936.00087114 Published 30 April 2015.